No todo lo que llega es sargazo: la diversidad oculta de macroalgas en las playas del Caribe
Alena B. Kharissova* ORCID: 0009-0004-6274-8361
Deyani Nocedo-Mena* ORCID:0000-0001-8061-8609
Sergio Manuel Salcedo Martínez* ORCID: 0000-0003-4672-420X
Shadai Lugo Loredo* ORCID: 0000-0002-7290-7571
CIENCIA UANL / AÑO 28, No.131, mayo-junio 2025
DOI: https://doi.org/10.29105/cienciauanl28.131-2
Cada año, miles de toneladas de algas marinas arriban a las costas del Caribe a causa del Gran Cinturón de Sargazo del Atlántico (GASB, por sus siglas en inglés), el mayor florecimiento de la macroalga de este tipo del mundo, de hasta 8,850 km y un peso que ronda las 22 toneladas (EPA, 2023).
Dichas playas, usualmente adornadas sólo por arena blanca y aguas turquesas, ahora se ven cubiertas por densas pilas en descomposición de macroalgas color pardo, conocidas coloquialmente como “sargazo”.
Si bien Sargassum spp. ha sido históricamente común en el Mar Caribe, en años recientes su abundancia se ha incrementado a niveles nunca antes vistos. Solamente en 2023, la NASA registró más de 13 millones de toneladas afectando estacionalmente el Golfo de México (NASA/Earth Observatory, 2023) entre los meses de abril a septiembre (Secretaría de Marina, 2023), la temporada de sargazo en el Golfo de México. Con justa razón, esta explosiva proliferación ha generado gran preocupación: su exceso puede causar serios problemas ambientales, económicos y de salud pública.
El gas lixiviado por el sargazo en descomposición (sulfuro de hidrógeno, H2S) asfixia los arrecifes coralinos y el ecosistema subyacente (Hendy et al., 2021), mientras que en Quintana Roo se ha reducido el producto interno bruto (PIB) un 11.6%, lo que equivale a 40 mil millones de pesos (Schling et al., 2022) a causa de la disminución del turismo. Sin embargo, al referirnos a la acumulación de algas en playas y litorales, solemos meterlas a todas en la misma bolsa de “sargazo”. Y aunque ciertamente esta alga parda domina la biomasa costera, sobre todo en primavera y verano con la llegada del GASB, lo cierto es que existe toda una diversidad de especies ocultas tras ese manto pardo que ha crecido anormalmente en los últimos años.
Un estudio publicado recientemente (Salgado-Hernández, 2023) analizó la composición de algas varadas en playas de Quintana Roo, México, si bien 98% de la biomasa corresponde a especies de sargazo (principalmente S. fluitans y S. natans) existen también otras algas que predominan en otoño e invierno. Asimismo, un estudio muy extenso (García-Sánchez et al., 2020) presentó los cambios temporales en la composición y biomasa de especies de Sargassum varadas en el caribe mexicano, las más abundantes fueron S. natans y S. fluitans; este último fue la forma predominante durante todo el periodo de estudio y comprendió en promedio >60% de la biomasa húmeda total.
En este trabajo se realizó una recolección de macroalgas no nativas en Playa del Carmen y
Playa el Recodo, en octubre de 2023. Fueron identificadas las siguientes: (1) Alsidium triquetrum, (2) Ceramium sp., (3) Digenea simplex, (4) Palisada perforata, (5) Gracilaria sp. (figura 1). Por cada kilogramo de alga mixta fresca, el 44.90% en peso es A. triquetrum, 17.70% Ceramium sp., 5.80% Digenea simplex, 25.60% P. perforata y 6.00% Gracilaria sp. Estas macroalgas rojas “no sargazo” representan fracciones muy pequeñas de la biomasa total comparadas con el arribo de sargazo cada año. Sin embargo, el hecho de que hayan llegado a las costas del Caribe significa que también deben estar proliferando y su presencia no se puede ignorar.
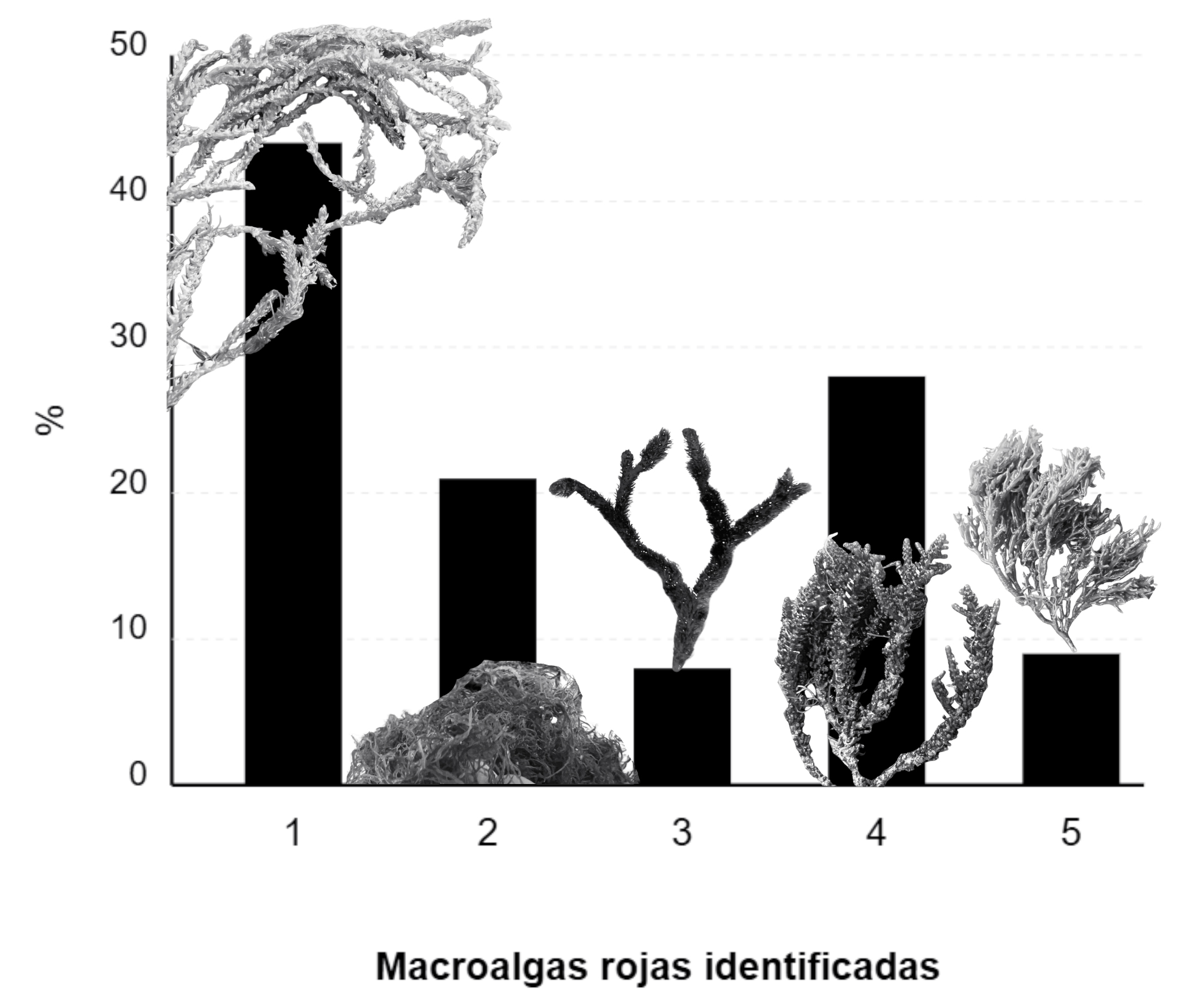
Figura 1. Cinco macroalgas rojas “no sargazo” en las costas de Playa del Carmen, obtenida de Km. 289+10, Carr. Cancún-Tulum, Centro, 77710, Playa del Carmen, Q.R., correspondientes a (1) Alsidium triquetrum, (2) Ceramium, (3) Digenea simplex, (4) Palisada perforata, (5) Gracilaria (recolectadas el 13 de octubre 2023).
IMPORTANCIA ECOLÓGICA
Las macroalgas cumplen roles ecológicos vitales en los ambientes tropicales. Por ejemplo, participan en el ciclo de nutrientes, proporcionan hábitats y fuentes de alimento a peces, erizos y otras especies marinas, y producen compuestos bioactivos (Fontenelle et al., 2018). También son el sustento de las comunidades de los arrecifes de coral y ecosistemas adyacentes.
Alsidium triquetrum (1) es común en los fondos rocosos y arenosos cercanos a la barrera arrecifal y se encuentra en aguas someras no más profundas de tres metros, aunque se ha visto hasta los 10 m (Areces et al., 2022). Es capaz de tolerar corrientes fuertes y aguas agitadas, pero no puede resistir la acumulación de sedimentos sobre su superficie. Bajo estas condiciones o con poca luz solar, sus ramas se rompen en varios pedazos y, eventualmente, desaparecen en corto tiempo (Areces et al., 2022).
Ceramium sp. (2) y Digenea simplex (3) suelen asentarse sobre rocas, siendo éstas de las más comunes en los arrecifes coralinos (Rzedowski, 1993). Mientras que Palisada perforata (4) se arraiga en fondos arenosos y se distingue por su patrón de crecimiento cespitoso. Todas ellas son consumidas por peces herbívoros. Otras algas como Gracilaria sp. (5) no sólo alimentan a la fauna marina, además sustentan toda una industria de granjas de especies comestibles. Gracilaria sp. es cultivada y cosechada para producir el agar-agar, un espesante que sirve de ingrediente en alimentos procesados (Quintero Ramírez et al., 2021).
CAUSAS DEL AUMENTO DE BIOMASA
Si estas macroalgas han existido desde siempre en los océanos tropicales, ¿por qué ahora vemos cada vez más de ellas llegar a las costas? Para responder la pregunta, primero hay que entender las causas que promueven su incremento desmedido. Los expertos apuntan a una combinación de factores ambientales alterados por las actividades humanas. La proliferación puede verse influenciada por varios factores, como la presencia de contaminantes y exceso de nutrientes en el medio marino (Ali y Hamed, 2006).
Además, las mayores tasas de crecimiento se han asociado con un aumento en la temperatura del agua de mar y disponibilidad de luz (Kortsch et al., 2012). El cambio climático con temperaturas y niveles de CO2 crecientes, junto a mayor escorrentía de fertilizantes agrícolas, están causando un ambiente muy propicio en el que las macroalgas proliferan. Éstas se caracterizan por una nutrición autótrofa, no necesitan tierra para su cultivo y su ritmo de desarrollo es más rápido que el de las plantas terrestres (Wan et al., 2019).
A esto hay que sumarle la sobrepesca, que ha contribuido como factor importante a su reproducción en los ecosistemas marinos. La eliminación de peces, particularmente de especies herbívoras, ha resultado en un aumento de la biomasa de macroalgas (Wan et al., 2019). Con menos consumidores naturales, pero con abundantes nutrientes, se crean las condiciones ideales para un desbalance del ecosistema de arrecifes de coral, donde un indicador es la multiplicación de éstas (Cheutin et al., 2021). Por si fuera poco, las corrientes marinas acarrean todo este exceso de biomasa hacia las costas.
SOLUCIONES INTEGRALES
Las crecientes cantidades de macroalgas varadas generan comprensibles preocupaciones por sus impactos sobre el turismo, la pesca y la salud de arrecifes coralinos. Para muchos pobladores costeros esto representa una crisis ambiental y económica. Identificar correctamente su composición resulta clave si se desea entender la dinámica ecológica de los litorales y diseñar soluciones integrales. Cada especie juega un rol único, proveyendo hábitat y alimento a diversos organismos; además, atrae una fauna asociada distinta. Conociendo las variedades afectadas por causas antropogénicas, nos ayuda a dimensionar integralmente el impacto del fenómeno y entender que la gravedad del desbalance ecológico es multifactorial e influye en los ciclos biogeoquímicos costeros.
Sin embargo, las respuestas no pueden ser simplistas. El enfoque no debe ser sólo “limpiar” las playas y encontrar una aplicación práctica a los sargazos y a las macroalgas rojas. Hay que entender que su acumulación es un síntoma de desequilibrio ecológico profundo. Por tanto, se requieren soluciones integrales. Esto implica regulaciones sobre fertilizantes, eliminación de fuentes de nutrientes mediante la gestión de aguas residuales, recuperación de poblaciones de peces herbívoros, monitoreo de arrecifes y transición hacia energías limpias.
Finalmente, se debe identificar y evitar la pesca de especies herbívoras clave con la capacidad de prevenir o revertir el crecimiento excesivo de algas, reducir la proliferación de macroalgas y la degradación de los arrecifes de coral.
CONCLUSIÓN
La masiva llegada de sargazo del Gran Cinturón del Atlántico (GASB) se origina a miles de kilómetros del Golfo de México, por causas oceanográficas y climáticas globales complejas que generan variaciones en el océano. Sin embargo, al agrupar indistintamente la proliferación simultánea de Alsidium, Ceramium, Digenea, Palisada y Gracilaria, en las playas de México como “sargazo”, se corre el riesgo de generalizar también su procedencia foránea. Esto lleva a asumir, erróneamente, que al igual que el sargazo que arriba estacionalmente, las demás macroalgas no tienen un origen local y que por tanto su proliferación y posibilidades de mitigación escapan a nuestro control.
Así, la falta de identificación certera de especies de macroalgas, cuyo crecimiento exacerbado representa una respuesta a desequilibrios ecológicos inducidos localmente por actividades humanas de la zona, es un indicador de desequilibrios ecológicos en los ambientes costeros a pequeña escala. Entender las causas específicas que llevan a su proliferación resulta clave en la búsqueda de un diagnóstico certero de la salud de pastos marinos y arrecifes coralinos. Esto permitirá enfocar las estrategias de conservación, restauración y aprovechamiento sustentable en los factores locales más relevantes sobre los que se puede incidir efectivamente. Más que enemigas, las macroalgas rojas son mensajeras de nuestros mares que claman acciones locales que salvaguarden el frágil equilibrio de las preciadas costas caribeñas.
* Universidad Autónoma de Nuevo León, San Nicolás de los Garza, México.
Contacto: alena.borisovnakh@uanl.edu.mx, deyani.nocedomn@uanl.edu. mx, sergio.salcedomr@uanl.edu.mx, shadai.lugolrd@uanl.edu.mx
REFERENCIAS
Abdel-Hamid, Ali, y Hamed, Mohamed. (2006). Impact of water quality deterioration on coral reef community structure in the northern red sea, Egypt, Egyptian Journal of Aquatic Biology and Fisheries, 10(2), 117-146, https://doi.org/10.21608/ejabf.2006.1854
Areces, Arsenio, Cabrera, Rubén, Diaz-Larrea, Johana. (2022). Guía ilustrada para el cultivo in situ de Alsidium triquetrum, Brazilian Journals Publicações de Periódicos e Editora https://doi.org/10.35587/brj.ed.0001359
Cheutin, Marie-Charlote, Villéger, Sébastien, Hicks, Christina C., et al. (2021). Microbial shift in the enteric bacteriome of coral reef fish following climate-driven regime shifts, Microorganisms, 9(8),1711, https://doi.org/10.3390/microorganisms9081711
Fontenelle, Thais P.C., Cruz-Lima, Glauber, Ximenes, Jacilane, et al. (2018). Lectin obtained from the red seaweed Bryothamnion triquetrum: secondary structure and antiinflammatory activity in mice, International Journal of Biological Macromolecules, 112, 1122-1130, https://doi.org/10.1016/j.ijbiomac.2018.02.058
García-Sánchez, Martha, Graham, Caroline, Vera, Elisa, et al. (2020). Temporal changes in the composition and biomass of beached pelagic Sargassum species in the Mexican Caribbean, Aquatic Botany, https://doi.org/10.1016/j.aquabot.2020.103275
Hendy, Ian W., Woolford, Katherine, Vincent-Piper, Alice, et al. (2021). Climate-driven golden tides are reshaping coastal communities in Quintana Roo, México, Climatic Change Ecology, 2, 100033, Available at: https://doi.org/10.1016/j.ecochg.2021.100033
Kortsch, Susanne, Primicerio, Raul, Beuchel, Frank, et al. (2012). Climate-driven regime shifts in arctic marine benthos, Proceedings of the National Academy of Sciences, 109(35), 14052-14057, https://doi.org/10.1073/pnas.1207509109
National Aeronautics and Space Administration (NASA) Earth Observatory. (2023). A Massive Seaweed Bloom in the Atlantic, NASA Earth Observatory, https://earthobservatory.nasa.gov/images/151188/a-massive-seaweed-bloom-in-the-atlantic
Quintero-Ramírez, Maribel, Mujica-Niño, Anyi, Linarez-Arellano, María, et al. (2021). Efecto gelificante del agar de Gracilaria debilis en la elaboración de una compota de níspero (Manilkara zapota), Revista Chilena de Nutrición, 48(2), 195-202, https://dx.doi.org/10.4067/S0717-75182021000200195
Rzedowski, J. (1993). La vegetación de México, Comisión Nacional para el Conocimiento y Uso de la Biodiversidad, https://www.biodiversidad.gob.mx/publicaciones/librosDig/pdf/VegetacionMxC19.pdf
Salgado-Hernández, Enrique (2023). Evaluación del sargazo (Sargassum spp.) del Caribe mexicano como sustrato para la producción de metano y comunidad microbiana asociada a la digestión anaerobia, tesis, Universidad Veracruzana/Instituto de Biotecnología y Ecología Aplicada (Inbioteca).
Schling, Maja, Guerrero-Compeán, Roberto, Pazos, Nicolás, et al. (2022). El impacto económico del sargazo: evidencia de la costa mexicana, Banco Interamericano de Desarrollo (BID), http://dx.doi.org/10.18235/0004470
Secretaría de Marina. (2023). Boletín semanal No. 218/23 sobre el seguimiento y pronósticos de sargassum en el Mar Caribe, Instituto Oceanográfico del Golfo y Mar Caribe.
United States Environmental Protection Agency (EPA). (2023). Great Atlantic Sargassum Belt (GASB), https://www.epa.gov/cyanohabs/great-atlantic-sargassum-belt-gasb
Wan, Alex H.L., Davies, Simon J., Soler-Vila, Anna, et al. (2019). Macroalgae as a sustainable aquafeed ingredient, Reviews in Aquaculture, 11, 458-492, https://doi.org/10.1111/raq.12241
Recibido: 08/02/2024
Aceptado: 03/05/2024