FIMBRIAS BACTERIANAS, NANOESTRUCTURAS VERSÁTILES
Martín A. González-Montalvo* Gloria M. González-González*
Ángel Andrade*
CIENCIA UANL / AÑO 22, No.93 enero-febrero 2019
Las bacterias son organismos microscópicos unicelulares que se encuentran en todo lo que nos rodea. Pueden hallarse sobre múltiples objetos o alimentos, en el cuerpo humano, en ríos y mares, en el suelo, sobre plantas y prácticamente en cualquier ambiente que nos imaginemos. La mayoría de las bacterias son inofensivas para el ser humano, incluso muchas de éstas establecen relaciones benéficas con nuestro organismo. Sin embargo, existen algunas que pueden causarnos enfermedades, las denominadas bacterias patógenas.
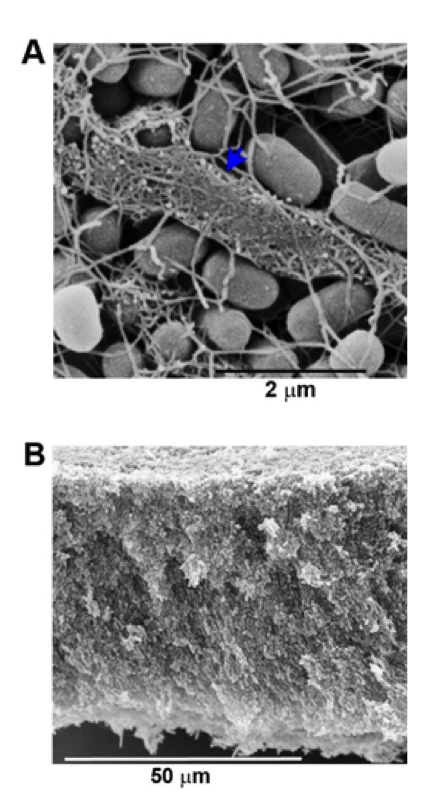
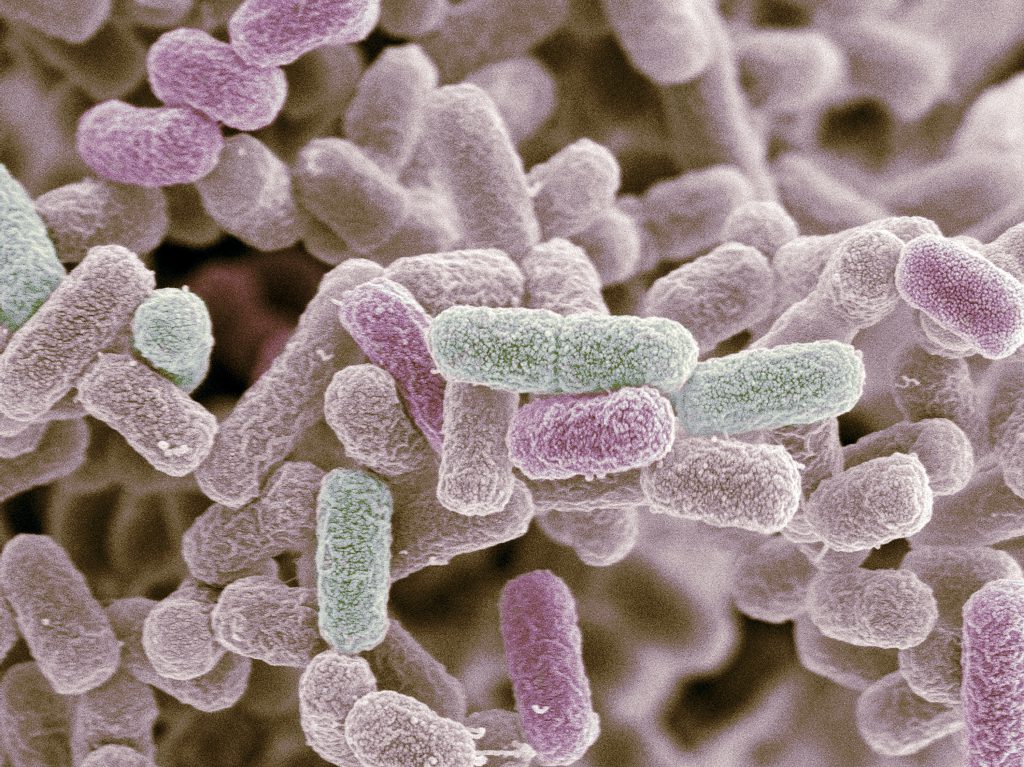
Al mecanismo mediante el que las bacterias se fijan y colonizan alguna superficie (ya sea inerte o viva) se le conoce como adherencia. Este proceso requiere la participación de diferentes proteínas que se localizan en la cubierta de las bacterias, desde donde actúan como ganchos pegadizos. Las proteínas bacterianas con propiedades adherentes generalmente se encuentran en múltiples copias formando estructuras largas y filamentosas que se extienden hasta por varios micrómetros (un micrómetro equivale a una milésima parte de un milímetro) por fuera de la célula (figura 1A). Estos apéndices se encuentran en la mayoría de las bacterias y se les conoce como fimbrias o pili (que en latín significa pelos). Además del papel de las fimbrias en la colonización de superficies, también permiten la adherencia entre bacterias aledañas, aglutinándolas unas con otras formando comunidades microbianas complejas a las que se denomina biopelículas o tapetes bacterianos (figura 1B). Los microorganismos que conforman estas biopelículas se encuentran embebidos en una especie de gel extracelular adherente que les brinda resistencia al daño mecánico, a la desecación y algunos agentes tóxicos (como antisépticos, desinfectantes y antibióticos) (Rijavec et al., 2008). Recientemente, también se han descrito bacterias anaerobias que han adaptado sus fimbrias a procesos metabólicos únicos, como la captura de metales pesados o el anclaje de proteínas que aceptan y transfieren electrones; en estos procesos, las fimbrias se comportan como verdaderos nanocables metálicos con capacidad de transferir corrientes eléctricas (Sure et al., 2016).
En este artículo abordaremos ejemplos de los diferentes tipos de fimbrias bacterianas, estructuras que se han descrito principalmente en bacterias patógenas e incluso han sido consideradas posibles blancos terapéuticos. Por último, se revisarán las recientes aplicaciones biotecnológicas en las que se han visto implicadas estas formidables estructuras.

FIMBRIAS DE BACTERIAS PATÓGENAS
El principal papel de las fimbrias durante la patogénesis es la adherencia y la colonización de un tejido; este mecanismo les permite a las bacterias secretar, de manera eficiente y localizada, factores de virulencia e iniciar un proceso infectivo. Por su parte, las fimbrias mejor caracterizadas son las producidas por bacterias Gram-negativas y su estudio a detalle ha derivado en una clasificación basada en tres grandes familias: (I) curli, (II) chaperona-acomodador y (III) tipo 4 (esta última también presente en bacterias Gram-positivas) (Thanassi et al., 2013). A continuación, describiremos diversos ejemplos de microorganismos en los que se ha evidenciado la producción de apéndices fimbriales y su relación con el desarrollo de un cuadro clínico.
Las fimbrias de la familia curli pertenecen a una clase de fibras conocidas como amiloides y se localizan sobre toda la periferia de las bacterias que las producen (figura 1A). Las fimbrias curli se han estudiado principalmente en enterobacterias patógenas, en las que se ha demostrado que participan en la adherencia a diferentes epitelios, a proteínas de matriz extracelular y en la formación de biopelícula e internalización de las bacterias a las células que infectan (Proft y Baker, 2009). Este tipo de fimbrias también media la adherencia a tejidos vegetales, como el germinado de alfalfa o a las hojas de lechuga, permitiendo el desarrollo y persistencia de las bacterias sobre estos productos de consumo. Consecuencia de lo anterior, bacterias productoras de curli, como Escherichia coli O157:H7 (causante de diarrea hemorrágica y síndrome urémico hemolítico) y Salmonella (familia a la que pertenece el agente causal de la fiebre tifoidea) pueden mantenerse adheridas a dichos alimentos y eventualmente ocasionar brotes (Thanassi et al., 2013).
Por otra parte, las fimbrias de la familia chaperona-acomodador (C-A) son estructuras que pueden ser cortas o largas, rígidas o flexibles y, semejante a las curli, se ubican sobre toda la superficie celular bacteriana. Estas fimbrias son las de mayor abundancia en bacterias Gram-negativas y los apéndices fimbriales más estudiados; se sabe que participan en adherencia, invasión y formación de biopelícula (Costa et al., 2015; Thanassi et al., 2013). Por ejemplo, algunas cepas de E. coli patógenas del tracto urinario poseen una fimbria C-A que les permite mantenerse firmemente unidas al epitelio del aparato urinario, evitando su eliminación a través del flujo de la orina durante la micción (figura 2A). Esta fimbria C-A también facilita la internalización de las bacterias en células epiteliales y da lugar a infecciones recurrentes (Costa et al., 2015). Una segunda fimbria, también de la familia C-A, es producida por estas cepas patógenas de E. coli, y se ha relacionado directamente con la progresión de las infecciones de vejiga y la migración de las bacterias a través de los uréteres hasta alcanzar el riñón, condición que puede originar una pielonefritis (Thanassi et al., 2013). Las fimbrias de la familia C-A también juegan un papel importante en infecciones intestinales, se ha demostrado que la pérdida de alguna de estas estructuras reduce drásticamente la adherencia y la consiguiente enfermedad diarreica ocasionada por E. coli enterotoxigénica, causante de la llamada diarrea del viajero (Madhavan y Sakellaris 2015).
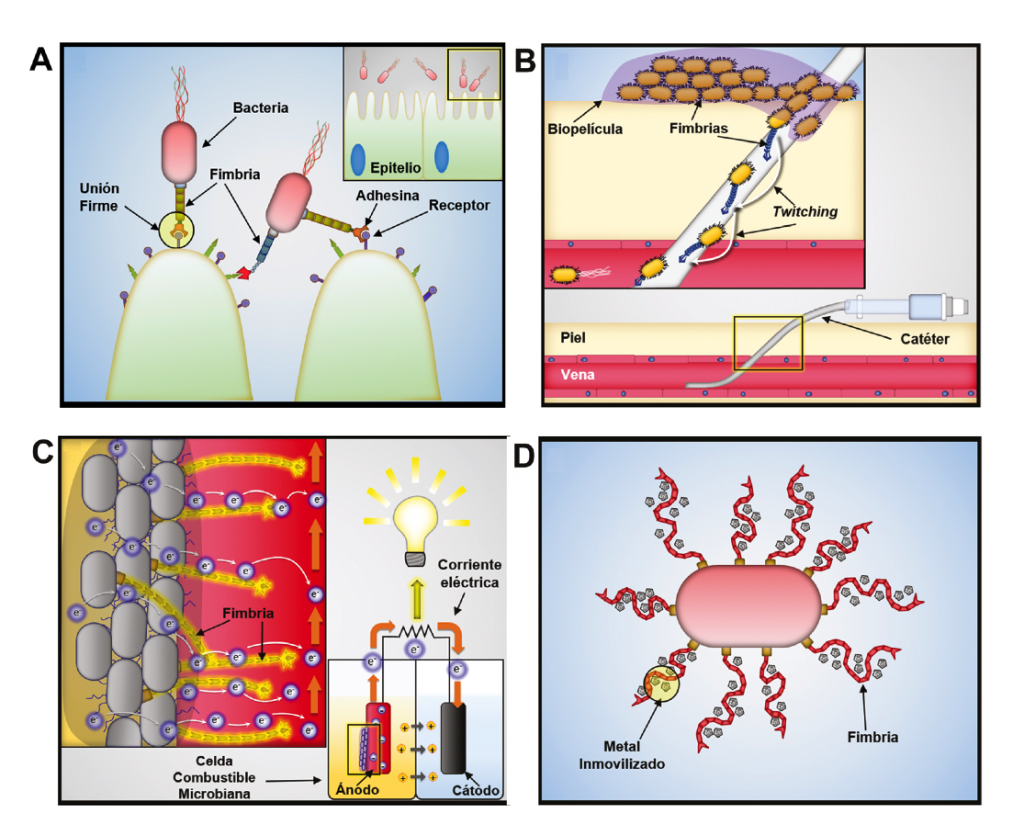
Por último, las fimbrias pertenecientes a la familia tipo 4 (o pili tipo 4), parecen tener una mayor versatilidad pues se les atribuyen las siguientes funciones: adherencia a tejidos, formación de microcolonias, incorporación de DNA exógeno, movilidad y secreción de proteínas (Thanassi et al., 2013). Las fimbrias tipo 4 se caracterizan por una localización polarizada, es decir, todas las fimbrias se ensamblan en un solo extremo de la célula bacteriana. Además de ser las únicas fimbrias con la capacidad de mediar un tipo de movimiento denominado twitching. En este movimiento, el filamento se extiende y se ancla a una superficie, posteriormente la bacteria se jala hacia ese punto, muy similar a trepar por una cuerda, esto le confiere a la bacteria un mecanismo de desplazamiento en superficies sólidas. Este tipo de movilidad se ha estudiado principalmente en Pseudomonas aeruginosa, bacteria implicada en infecciones de quemaduras y de vías urinarias (Proft y Baker, 2009). Otros ejemplos de fimbrias del tipo 4 implicadas en la virulencia bacteriana incluyen a Clostridium perfringens y Neisseria meningitidis. C. perfringens utiliza una fimbria tipo 4 para adherirse a mioblastos y fibroblastos (células halladas en músculo), posteriormente la bacteria secreta toxinas que provocan la muerte del tejido, a esta patología se le conoce como gangrena gaseosa (Melville y Craig, 2013). Por su parte, N. meningitidis (importante agente causal de meningitis bacteriana), emplea una fimbria tipo 4 para adherirse con firmeza a los vasos sanguíneos del cerebro, esto ocasiona una reacción en cadena a nivel celular que culmina en la alteración de la barrera hematoencefálica y permite el acceso de la bacteria al sistema nervioso y al cerebro (Kolappan et al., 2016).
En algunas bacterias Gram-positivas patógenas también se han descrito fimbrias. Por ejemplo, en Actinomyces naeslundii, las fimbrias le permiten colonizar el tejido oral, el esmalte dental y formar biopelículas, lo que da lugar a la aparición de la placa dental o “sarro”. Por otra parte, la bacteria conocida como neumococo (Streptococcus pneumoniae) presenta genes fimbriales que se han asociado con la adherencia bacteriana a células de pulmón y con una fuerte inducción inflamatoria (Proft and Baker, 2009). No obstante, todavía se conoce muy poco sobre el papel de estos apéndices en la patogénesis de bacterias Gram-positivas, por lo que es de interés continuar el estudio de las fimbrias en este grupo de microorganismos.
Si bien las fimbrias son importantes en la patogénesis de las bacterias, estas estructuras también son relevantes en infecciones intrahospitalarias. Como se mencionó al inicio, estos apéndices permiten que las bacterias se adhieran a superficies inertes, como mesas de operación, relojes, material quirúrgico, catéteres y un sinfín de objetos. Por lo que la desinfección deficiente del material médico puede favorecer el desarrollo de biopelículas bacterianas y el establecimiento de un foco de infección. En este sentido, son frecuentes las infecciones de vías urinarias en pacientes que utilizan sondas vesicales. Además, el uso prolongado de catéteres venosos representa también un riesgo potencial para desarrollar bacteriemias (figura 2B).
FIMBRIAS COMO BLANCOS TERAPÉUTICOS
El entendimiento del papel de las fimbrias en la patogénesis bacteriana ha llevado a que se proponga utilizarlas como blancos terapéuticos, es decir, se ha alentado la búsqueda y diseño de fármacos que bloqueen la actividad adherente o el ensamblaje de estos pili y poder de esta manera “rasurar” a las bacterias y reducir su virulencia.
En diferentes estudios se ha evaluado una amplia librería de moléculas para identificar aquéllas que sean capaces de inhibir el ensamblaje de las fimbrias. Sin embargo, uno de los problemas que se enfrenta es la variabilidad que existe en los distintos tipos de fimbrias, esto implica que un fármaco no puede bloquear de manera general a todas. Las moléculas pilicidas más estudiadas son aquéllas que están dirigidas contra las fimbrias de la familia C-A. Estos pilicidas bloquean el sistema de transporte y de ensamblaje de las subunidades del filamento impidiendo su síntesis y de manera indirecta la formación de biopelícula (Åberg y Almqvist, 2007). Por otra parte, los fármacos que bloquean las fimbrias de la familia curli (curlicidas) han cobrado relevancia, ya que actúan impidiendo la agregación de amiloides, lo que los convierte en una opción atractiva para el tratamiento de patologías ocasionadas por la agregación de este tipo de moléculas, como es el caso de las enfermedades neurodegenerativas de Alzheimer, Huntington y las ocasionadas por priones (Cegelski et al., 2010).
Otra estrategia dirigida contra las fimbrias de bacterias patógenas que se ha evaluado es la vacunación. Como se ha enfatizado a lo largo de este artículo, la adherencia es un paso primordial en la colonización previa a la infección. El diseño de vacunas fimbriales tiene como finalidad prevenir infecciones bacterianas mediante la estimulación de una respuesta inmune específica que evite la colonización del patógeno en cuestión. Entre las enfermedades que se ha buscado prevenir están la peste bubónica y pulmonar, para las cuales se ha desarrollado una vacuna que combina una fimbria de la familia C-A con el antígeno V, ambos de Yersinia pestis. Esta formulación ha mostrado una alta eficacia usando ratones como modelo, previniendo que desarrollen infecciones después de exponerlos a Y. pestis; diferentes formulaciones de esta vacuna están actualmente en proceso de patente (Derbise et al., 2015). Otro ejemplo de vacunas fimbriales son las evaluadas en la prevención de infecciones intestinales causadas por E. coli enterotoxigénica. En este caso las formulaciones (orales e intranasales) están compuestas de fimbrias de la familia C-A y toxinas inactivadas de este patógeno, su administración a personas que viajarán a lugares donde la bacteria es endémica ha demostrado una reducción en la incidencia de dichas enfermedades, no obstante, se ha observado que la protección disminuye con el tiempo (Holmgren y Levine, 2015).

APLICACIONES BIOTECNOLÓGICAS DE LAS FIMBRIAS
La energía eléctrica es una fuente de poder fuertemente arraigada a la vida moderna. Uno de los grandes avances de la tecnología ha sido la creación de baterías (o pilas) capaces de almacenar y proveer de energía eléctrica. No obstante, estas baterías tienen el inconveniente de ser contaminantes una vez concluida su vida útil. Una estrategia alternativa ha sido el diseño de pilas recargables y más recientemente el desarrollo de baterías biológicas o biobaterías (Kannan et al., 2008). Las celdas de combustible microbianas (CCM) son biobaterías que emplean bacterias y substratos orgánicos para generar electricidad (figura 2C). Las CCM se componen de dos cámaras, cada cámara contiene un electrodo: ánodo (positivo) y cátodo (negativo). Es en la cámara aniónica donde se agrega el microorganismo y el substrato. Ya que uno de los propósitos de las CCM es el aprovechar desechos, se pueden emplear aguas negras o aguas de residuos industriales como substratos, o bien mezclas de compuestos puros como azúcares o polímeros orgánicos (Pant et al., 2010).
Para que tenga lugar la generación de corriente eléctrica en las CCM, el microorganismo primero debe adherirse al ánodo (en la mayoría de los casos a través de una biopelícula). En esta primera fase, las fimbrias contribuyen al establecimiento y fijación de las colonias bacterianas sobre los electrodos. Posteriormente, las fimbrias desempeñan un papel fundamental en la generación de electricidad, operan como un puente a través del cual los electrones generados al metabolizar los substratos fluyen directamente hacia los electrodos, generando una corriente eléctrica. Esta capacidad de transferir electrones mediada por fimbrias ha sido estudiada principalmente en la bacteria ambiental, Geobacter sulfurreducens (Sure et al., 2016). A la fecha, las CCM han sido utilizadas exitosamente para alimentar dispositivos eléctricos remotos (sensores en altamar) y en plantas de tratamiento de agua. También se plantea su uso acoplado a procesos de biorremediación utilizando metales pesados o compuestos contaminantes como substratos.
En relación a lo anterior, se han descrito bacterias capaces de reducir metales pesados (como uranio VI) durante su respiración, transformándolos a formas menos tóxicas (uranio IV) para el ambiente (Reguera, 2018). Entre las estrategias que estas bacterias utilizan para capturar metales destaca la producción de fimbrias (figura 1D), en estos casos las fimbrias capturan directamente iones metálicos, concentrándolos en su cercanía para posteriormente llevar a cabo su reducción (Reguera, 2018).
CONCLUSIONES
El desarrollo de los antibióticos representa uno de los grandes logros de la medicina del siglo XX, desafortunadamente su uso indebido y desmedido ha derivado en la aparición de “superbacterias” resistentes a la gran mayoría de estos fármacos. En la actualidad se buscan alternativas para enfrentar las infecciones originadas por bacterias multirresistentes y una estrategia prometedora es el desarrollo de moléculas que disminuyan las capacidades virulentas de los microorganismos patógenos. Como hemos revisado a lo largo de este artículo, la adherencia mediada por fimbrias representa un evento crucial en la patogénesis de múltiples bacterias, y en consecuencia un blanco farmacológico atractivo. Adicionalmente, la participación de fimbrias bacterianas en procesos con aplicaciones industriales como la generación de electricidad y la biorremediación de ambientes contaminados nos ejemplifica los vastos alcances y las repercusiones tecnológicas que se pueden conseguir a partir del estudio y entendimiento de procesos biológicos fundamentales como la regulación y el ensamblaje de estos filamentos extracelulares microscópicos.
* Universidad Autónoma de Nuevo León.
Contacto: angel.andradet@uanl.edu.mx
REFERENCIAS
Åberg, V., y Fredrik, A. (2007). Pilicides-Small Molecules Targeting Bacterial Virulence. Organic and Biomolecular Chemistry. 5(12): 1827-34.
Cegelski, L., et al. (2010). Small-Moleculer Inhibitors Target Escherichia coli Amyloid Biogenesis and Biofilm Formation. Nature Chemical Biology. 5(12): 913-19.
Costa, T.R.D., et al. (2015). Secretion Systems in Gram-Negative Bacteria: Structural and Mechanistic Insights. Nature Reviews Microbiology. 13(6): 343-59.
Derbise, A., et al. (2015). Complete Protection against Pneumonic and Bubonic Plague after a Single Oral Vaccination. PLoS Neglected Tropical Diseases. 9(10): 1-19.
Holmgren, J., y Myron, M.L. (2015). Mucosal Immunology. Fourth Edi: Elsevier.
Kannan, A.M., et al., (2008). Bio-Batteries and Bio-Fuel Cells : Leveraging on Electronic Charge Transfer Proteins. Nanoscience and Nanotechnology. 8(00).
Kolappan, S., et al. (2016). Structure of the Neisseria Meningitidis Type IV Pilus. Nature Communications. 7: 1-12. Madhavan, T.P., et al. (2015). Colonization Factors of Enterotoxigenic Escherichia coli. In Advances in Applied Microbiology, Elsevier, 155-97. Melville, S., y Craig, L. (2013). Type IV
Pili in Gram-Positive Bacteria. Microbiology and Molecular Biology Reviews. 77(3): 323-41.
Pant, D., et al. (2010). A Review of the Substrates Used in Microbial Fuel Cells (MFCs) for Sustainable Energy Production. Bioresource Technology. 101(6): 1533-43.
Proft, T., y Baker, E.N. (2009). Pili in Gram-Negative and Gram-Positive Bacteria-Structure, Assembly and Their Role in Disease. Cellular and molecular life sciences. 66(4): 613-35.
Reguera, G. (2018). Microbial Nanowires and Electroactive Biofilms. FEMS Microbiol. Ecol. (1):1-13.
Rijavec, M., et al. (2008). Virulence Factors and Biofilm Production among Escherichia coli Strains Causing Bacteraemia of Urinary Tract Origin. Journal of medical microbiology. 57(Pt 11): 1329-34.
Serra, D.O., et al. (2013). Microanatomy at Cellular Resolution and Spatial Order of Physiological Differentiation in a Bacterial Biofilm. mBio. 4(2):1-12.
Sure, S., et al. (2016). Microbial Nanowires: An Electrifying Tale. Microbiology (United Kingdom). 162(12): 2017-28.
Thanassi, D.G., et al. (2013). Fimbriae: Classification and Biochemistry. EcoSalPlus. 2(2).
