La muerte celular: un proceso indispensable para la vida
Ana Carolina Martínez-Torres*, Luis Gómez-Morales*, Cristina Rodríguez-Padilla*
CIENCIA UANL / AÑO 21, No. 87 enero-febrero 2018
Todos los seres vivos estamos compuestos por una o varias células, desde las bacterias que habitan nuestra flora intestinal, hasta el gran elefante que se pasea en la sabana africana. En efecto, cada uno de nosotros es un mundo habitado por billones de ellas. Diferentes poblaciones celulares conforman los distintos tejidos que construyen órganos, los cuales, a su vez, componen los sistemas que permiten que nuestro cuerpo funcione. Así, la célula es considerada la unidad básica de la vida pues, además, en ella se alberga toda la información genética del organismo. Pero, ¿qué esculpe tan diversas formas?, ¿qué dicta el tamaño de cada una de las partes de un ser vivo?
Las respuestas a estas preguntas se encuentran en los procesos celulares que mantienen la homeostasis del organismo. Por ejemplo, el ciclo celular permite a cada célula dividirse y generar descendencia. Por otra parte, la diferenciación celular concede a las células hijas capacidades diferentes a las de su progenitor. Y la muerte celular ofrece la oportunidad de controlar la cantidad y la calidad de las células en el organismo. De todos, este último es un proceso cuya importancia ha sido difícil de explicar a lo largo de la historia de la biología celular, pero que cada vez comprendemos mejor.
HISTORIA DE LA MUERTE CELULAR REGULADA
Durante cientos de años, incluso antes de que el concepto de célula fuera completamente entendido, se había observado la muerte celular; en el tránsito claramente anómalo de los tejidos gangrenosos tras un daño severo, o en los procesos descritos por Galeno a finales del siglo II d.C., en los que alude a ciertas estructuras efímeras, cuya desaparición pareciera programada desde el nacimiento. Sin embargo, estos dos procesos no parecían coincidir en ningún punto.
Fue hasta 1972, cuando Kerr, Willie y Currie utilizaron los términos de necrosis y apoptosis para unificar ambos conceptos y, a su vez, diferenciar la muerte celular accidental de la regulada. Ellos definieron la necrosis como un proceso de muerte celular violento y patológico, iniciado por estímulos ambientales que resultaban en una rápida pérdida de la homeostasis celular. En contraparte, acuñaron la palabra apoptosis para definir a un tipo de muerte celular “alternativa” caracterizada por ser altamente regulada y poseer características morfológicas precisas, como el encogimiento celular, la formación de vesículas en la membrana, la condensación de la cromatina y la degradación del ADN, sin afectar la permeabilidad de la membrana plasmática.
Desde entonces, la identificación de un universo de reguladores genéticos que definen la apoptosis y muchos otros procesos de muerte celular fisiológica ha aumentado de manera exponencial. Así, a finales del siglo XX se identificaron las caspasas (proteasas, proteínas capaces de romper enlaces peptídicos de proteínas, que presentan un residuo del aminoácido cisteína que media la ruptura de proteínas al nivel de un residuo de aspartato; las proteínas cortadas por las caspasas a menudo están relacionadas con la supervivencia e integridad celular), y la proteína antiapoptótica Bcl-2 (B-cell lymphoma 2). Posteriormente, una a una se han descubierto proteínas que han sido clasificadas dentro de la familia Bcl-2 (que tienen homología con cuatro regiones, llamadas dominios de homología Bcl-2, denominados BH), la cual incluye proteínas antiapoptóticas (con multidominio BH1-4) y proapoptóticas (que a su vez se dividen en proteínas con multidominio, BH1-3, o sólo con dominio BH3), así como una gran variedad de proteínas involucradas en la regulación, positiva y negativa, del suicidio celular.
Así, con el reconocimiento del papel de la muerte celular durante el desarrollo y en el mantenimiento de la homeostasis de los organismos, y con el descubrimiento de moléculas intracelulares dedicadas a la autodestrucción, ahora se sabe que todas las células que componen a los seres vivos están intrínsecamente programadas para autodestruirse (Ameisen, 2002).
LA MUERTE DE LA CÉLULA ES UN PROCESO ALTAMENTE REGULADO
Las células deben morir para preservar la homeostasis del organismo que constituyen. Los programas de muerte celular están codificados en el genoma y se expresan de manera ubicua. Su regulación es ejecutada por mecanismos moleculares extremadamente conservados que se pueden encontrar incluso en organismos unicelulares, y cuya existencia se remonta a los principios de la vida misma. Existe evidencia que soporta que dichos organismos pueden “suicidarse”, activando una maquinaria intracelular cuando alguno de ellos compromete la homeostasis de la colonia que conforman, sugiriendo que la capacidad de autodestrucción es tan antigua como la primera célula que existió (Ameisen, 2002).
De esta manera, la evolución favoreció a organismos más complejos que ejecutan dicho proceso. La muerte celular se requiere para la adecuada formación y correcta escultura del embrión. Además, durante la edad adulta también juega un papel primordial, pues la eliminación de células anormales, infectadas o innecesarias, es imprescindible como defensa ante daños externos e internos (por ejemplo, infecciones y mutaciones), en la diferenciación celular y en el control de la cantidad de células en el ambiente (Fuchs y Steller, 2011).
MÚLTIPLES VÍAS LLEVAN A UN MISMO FIN
Debido a la importancia de este proceso, desde su nacimiento, cada célula produce sus propias herramientas de autodestrucción. Dicha producción es controlada por las capacidades individuales de cada célula para recibir, procesar y generar señales que activen o inhiban algún elemento de la maquinaria letal (Eisenberg-Lerner et al., 2009). Con la enorme heterogeneidad celular de los organismos superiores, lo anterior supone numerosos caminos que la célula puede tomar para autodestruirse. Estas rutas son sumamente complejas y pueden converger o divergir en varios puntos del proceso o entre tipos celulares. Así, la muerte celular regulada (MCR) puede activarse por estímulos intracelulares (como estrés o daño al DNA) o extracelulares (como la recepción de señales letales) que desencadenan una serie de eventos que guían a la célula a su muerte.
Durante estos caminos que la célula toma para suicidarse, el proceso puede detenerse debido a alguna intervención fisiológica, farmacológica o genética. Sin embargo, cuando traspasan este umbral, llegan a un “punto sin retorno” en el que el deceso de la célula moribunda es inminente. A partir de este momento, el proceso ya no puede detenerse y cualquiera de las rutas conduce a la célula a un destino común: la muerte.
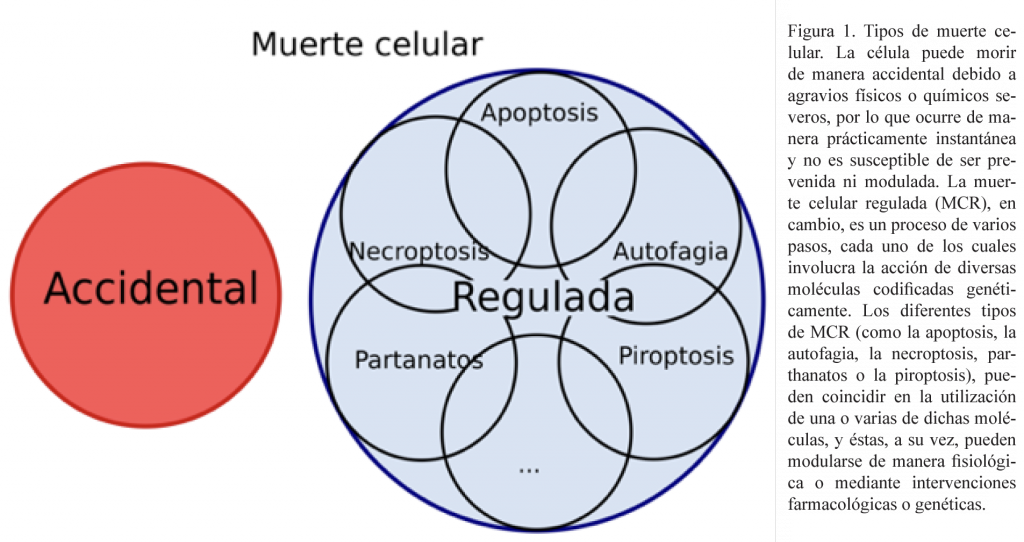
Los avances tecnológicos han hecho posible la identificación de un sinfín de actores que participan en la ejecución de la MCR (como las caspasas y los miembros de la familia Bcl-2). Aunado a esto, los esfuerzos liderados por el Comité de Nomenclatura de Muerte Celular para homogeneizar el lenguaje entre la comunidad científica han posibilitado la unificación de conceptos, facilitando la comprensión de estos procesos y permitiendo clasificar la muerte celular en grupos (figura 1). Esta clasificación resume la variedad y complejidad de estos procesos, y ha tomado una alta relevancia biomédica, dado que el tipo de muerte, sus inductores y ejecutores, se han visto involucrados en un gran número de patologías, además, su comprensión y regulación juegan un papel fundamental en el diagnóstico y tratamiento de estas enfermedades.
Por todas estas razones, la MCR es considerada como uno de los programas básicos de la célula, indispensables para mantener la homeostasis celular, siendo su regulación necesaria para el mantenimiento del organismo.
IMPLICACIÓN BIOMÉDICA DE LA MCR
La muerte celular, lejos de ser un proceso fortuito, es un mecanismo con una sofisticada regulación de gran importancia médica, pues es susceptible a intervenciones farmacológicas y genéticas.
Es un hecho que una gran cantidad de enfermedades comprenden una desregulación en la MCR (Fuchs y Steller, 2011). Incluso, de acuerdo con la Organización Mundial de la Salud, las principales causas de mortalidad, tanto en países desarrollados como en vías de desarrollo, son enfermedades caracterizadas por anomalías en la MCR. Enfermedades como las de Alzheimer o Parkinson se caracterizan por un exceso de MCR de las células neuronales (WHO infobase, 2017). En contraparte, el cáncer es un conjunto de enfermedades en las que las células evaden la MCR, lo que lleva a que éstas continúen dividiéndose sin que su número sea controlado, llevando a la formación de tumores malignos. Así, paradójicamente, inhibir la muerte desregula la homeostasis, conduciendo a un estado patológico y, en algunos casos, a la muerte del individuo.
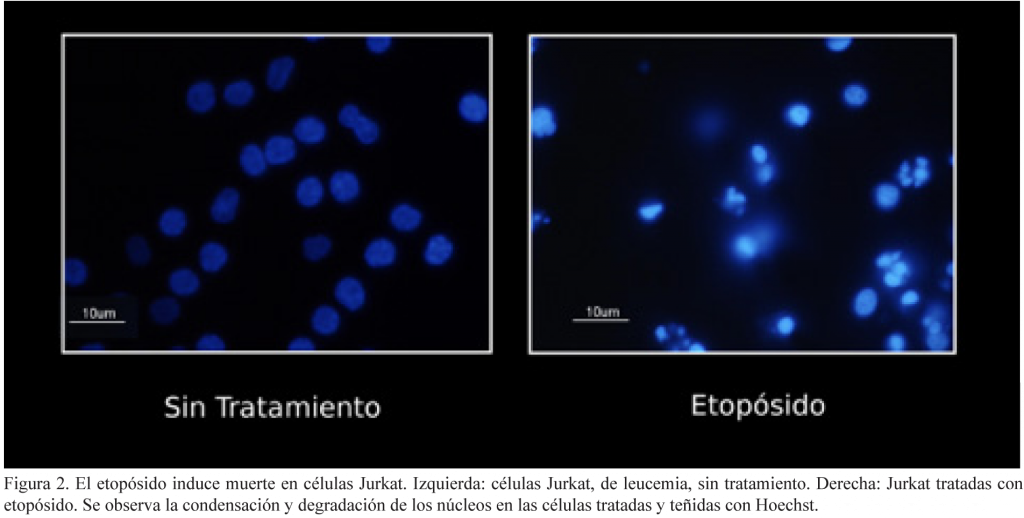
La mayoría de los tratamientos contra el cáncer (como las quimioterapias y radioterapias) buscan inducir la muerte de las células tumorales, que han perdido la capacidad de autorregularse, volviéndose resistentes a este proceso. Las quimioterapias, como el etopósido, son capaces de matar a las células de cáncer por apoptosis (ver figura 2). Sin embargo, las células pueden desarrollar mutaciones, ya sea en caspasas o en otras proteínas que regulan la apoptosis (como el receptor de muerte Fas, el guardián del genoma, P53, entre otros), inactivándolos o sobreexpresando proteínas antiapoptóticas (como Bcl-2, BcL-xL, Mcl-1, proteínas inhibidoras de apoptosis –IAPs–, entre otros) que después les permiten volverse resistentes a este tipo de muerte.
Por estas razones, la búsqueda de nuevos tratamientos que logren matar las células de cáncer resistentes a la muerte inducida por terapias convencionales es de vital importancia. Actualmente se comienzan a proponer múltiples alternativas que involucran tanto inhibidores de proteínas antiapoptóticas (como fármacos miméticos de BH3, que inhiben proteínas antiapoptóticas de la familia Bcl-2), solos o en combinación con quimioterapias, o tratamientos que induzcan muerte independiente de estas proteínas, como los péptidos agonistas de CD47 (Martínez-Torres et al., 2017). Sin embargo, el estudio de estas nuevas alternativas sigue siendo crucial, debido a que la MCR es dependiente del tipo celular, el inductor y las condiciones microambientales precisas. Esto hace que, a pesar de los avances realizados en el estudio de la muerte celular, aún quede un largo camino por recorrer en el entendimiento de este proceso celular.
AGRADECIMIENTOS
Agradecemos a Conacyt por el apoyo Ciencia Básica 252017 otorgado a CR-P y la beca doctoral 473279 otorgada a LG-M, a la SEP-Conacyt-ANUIES-ECOS por el apoyo 291297 otorgado a ACM-T, a la Red In- munocanei de Conacyt, a Paicyt por el apoyo SA092- 15 otorgado a ACM-T, y al Laboratorio de Inmunología y Virología de la Facultad de Ciencias Biológicas, UANL, por el apoyo económico y de infraestructura otorgado.
*Universidad Autónoma de Nuevo León
Contacto: ana.martinezto@uanl.edu.mx
REFERENCIAS
Ameisen, J.C. (2002). On the origin, evolution, and nature of programmed cell death: a timeline of four billion years. Cell Death Differ, 9(4): pp. 367-93.
Ameisen, J.C. (2004). Looking for death at the core of life in the light of evolution. Cell Death Differ, 11(1): pp. 4-10.
Eisenberg-Lerner, A., et al. (2009). Life and death partners: apoptosis, autophagy and the cross-talk between them. Cell Death Differ, 16(7): pp. 966-75.
Fuchs, Y. y Steller, H. (2011). Programmed cell death in animal development and disease. Cell, 147(4): pp. 742-58.
Kroemer, G., et al. (2009). Classification of cell death: recommendations of the Nomenclature Committee on Cell Death. Cell Death Differ, 16(1): pp. 3-11.
Martínez-Torres, A.C., et al. (2017). CD47: un prometedor blanco terapéutico contra el cáncer. Ciencia y desarrollo, 43(290): pp. 13-17.
WHO infobase (2017, enero). The top 10 causes of death. Disponible en: http://www.who.int/mediacentre/ factsheets/fs310/en/index.html