Respuesta fenológica de especies maderables a los factores ambientales del noreste de México
Maginot Ngangyo Heya*, Rahim Foroughbakch Pournavab*, Artemio Carrillo
Parra***, Lidia Rosaura Salas Cruz**
CIENCIA UANL / AÑO 20, No. 86 octubre-diciembre 2017
Resumen
Los eventos fenológicos ilustran la sincronización de los procesos biológicos con los cambios climáticos. En cinco especies maderables del matorral espinoso tamaulipeco (Acacia berlandieri, Havardia pallens, Helietta parvifolia, Ebenopsis ebano y Acacia wrightii) se observaron quincenalmente, durante 12 meses, las etapas de desarrollo en hojas, flores y frutos, por cuantificación porcentual. Se obtuvo que el estrés por sequía prolongada en verano provocó un cambio del desarrollo vegetativo y reproductivo. La foliación registró mayor continuidad con el tiempo, y varió menos con los factores climáticos, mientras que las fases reproductivas fueron más cortas y discontinuas, registrando mayor variación con el clima.
Palabras clave: factores ambientales, fenología, matorral espinoso tamaulipeco, especies maderables.
Abstract
Phenological events illustrate the synchronization of biological processes with climate change. From the Tamaulipan shrublands, five timber species (Acacia berlandieri, Havardia pallens, Helietta parvifolia, Ebenopsis ebano y Acacia wrightii) were observed fortnightly, during 12 months, the developmental stages in leaves, flowers and fruit, per percentage quantification. It showed that the stress, due to prolonged drought in summer, caused changes in vegetation and reproductive development. Foliation registered greater continuity with time and varied less with climate factors, while the reproductive phases were shorter and discontinuous, registering greater variation with climate.
Keywords: environmental factors, phenology, Tamaulipan shrublands, timber species.
Desde hace algunas décadas, el planeta ha experimentado un significativo cambio climático global, caracterizado principalmente por un incremento en la temperatura global y en la concentración de CO2 atmosférico (Wigley, Jones y Raper, 1997; Hansen et al., 2000; Hansen et al., 2002). Estas alteraciones afectan las condiciones climáticas en todas las regiones del mundo, la estacionalidad ambiental y con ello las respuestas de los organismos al ambiente (Hughes, 2000), y de forma muy particular, la fenología de las plantas (Famsworth et al., 1995; Thorhallsdcttir, 1997; Spano et al., 1999).
Este último término deriva del griego phaino que significa manifestar, y logos, que significa tratado, y se entiende entonces como el estudio de los eventos periódicos naturales involucrados en la vida de las plantas (Volpe, 1992; Villalpando y Ruiz, 1993; Schwartz, 1999). Como son procesos naturales, estos fenómenos se relacionan con el clima de la localidad en que ocurren y viceversa, de manera que se puede referir a las secuencias fenológicas relativas al clima y sobre todo al microclima cuando ni uno ni otro se conoce debidamente.
Los procesos fenológicos proveen información sobre los ritmos funcionales de plantas y comunidades vegetales (Abd El-Ghani, 1997), donde los eventos fenológicos pueden ser determinados por condiciones bióticas o abióticas ambientales. De ahí, se puede decir que los ciclos fenológicos representan adaptaciones morfológicas y fisiológicas de las especies para la utilización de los recursos (Abd El-Ghani, 1997; Kemp y Gardetto, 1982). El ciclo de estas respuestas adaptativas de las plantas permite identificar una diversidad de fenofases que están, en mayor o menor grado, reguladas por la estacionalidad (Battey, 2000). En este sentido, los patrones fenológicos pueden indicar que los recursos son utilizados por diferentes especies en diferentes épocas del año. Por lo que cada vez más, cobra mayor importancia el uso de escalas fenológicas que permiten a la vez referirse a las observaciones y prácticas de manejo de cultivos en una etapa de desarrollo determinado. Esto puede ser útil para desarrollar programas de manejo, recuperación de pastizales y para explicar la adaptación de las especies al ambiente (Fresnillo-Fedorenko et al., 1996).
Las plantas del desierto exhiben fenologías fuertemente relacionadas con la disponibilidad de humedad y
temperatura, así como fotoperiodo y disponibilidad de nutrientes. Los eventos fenológicos en estas plantas son disparados principalmente por la precipitación y temperaturas adecuadas (Beatley, 1974; Rossi et al., 1999). El matorral espinoso tamaulipeco es una vegetación de zonas áridas y semiárdias, que consiste en árboles de porte medio alto y arbustos (Ludwig, Reynolds y Whitson, 1975; Rzedowski, 1978; Garrett, 2002), y se extiende en 125,000 km2 , desde la planicie costera del Golfo de México hasta la ribera sur de Texas en Estados Unidos de América (Foroughbakhch et al., 2005). Estos ecosistemas guardan un delicado equilibrio con el clima, lo que representa particular importancia dentro del manejo forestal, ya que con ello se puede determinar cómo responden a las condiciones climáticas regionales, y por tanto, a los cambios climáticos (Chmielewski y Rótzer, 2001) y las épocas propicias para efectuar actividades silvícolas (Aguirre, 1992).
El conocimiento de estas respuestas adaptativas de la fenología puede constituir un excelente indicador en el manejo de agroecosistemas y recursos forestales. Por lo tanto, el presente trabajo pretende determinar la fenología de especies maderables del matorral espinoso tamaulipeco, para utilizarla como una herramienta que podría llevar a un mejor entendimiento de la variación estacional en la aparición de nuevas hojas, flores y frutos, a fin de poder determinar la magnitud de los cambios e incluso poder predecirlos y establecer patrones fenológicos indispensables para el aprovechamiento y manejo adecuados de este recurso.
Materiales y métodos
Área de estudio
El estudio se desarrolló en el matorral-escuela de la Facultad de Ciencias Forestales (FCF) UANL, en el municipio de Linares, Nuevo León, que se encuentra dentro de las coordenadas 24° 47‟ de latitud Norte y 99° 32‟ de longitud Oeste en una región de la planicie entre 430 a 450 m de altitud en el piedemonte de la Sierra Madre Oriental, México (Foroughbakhch, Hernández-Piñero y Carrillo-Parra, 2014). El clima regional se define como semiárido y subhúmedo [(A) C (Wo)] en el esquema de Köppen modificada por García (2004). Con dos estaciones de lluvias (verano y otoño) y una temporada seca entre noviembre y abril. La temperatura media anual es de 22.3°C con temperaturas superiores a 40°C durante el verano, y heladas de diciembre a marzo. La precipitación media anual es de 749 mm (Foroughbakhch et al., 2001), con la relación de precipitación a la evaporación libre de 0.48 y la precipitación de la evaporación potencial de 0.62 (Návar y Bryan, 1994).
Selección de especies y diseño experimental
El criterio de selección consistió en elegir las especies leñosas características del matorral tamaulipeco, considerando su valor de importancia (Cabral y Treviño, 1989) y basándose en la información proporcionada por Foroughbakhch, Peñaloza y Stienen (1987) en un área del matorral tamaulipeco (tabla I).
El diseño experimental consistió en 24 parcelas de 10 x 10 m, distribuidas en dos diferentes tipos de vegetación: a) 15 parcelas se ubican en plantaciones forestales con cinco especies nativas seleccionadas, a razón de tres repeticiones por especie, con aproximadamente 25 árboles por parcela, separados a 3 m de distancia; b) nueve parcelas en el matorral nativo, delimitadas al azar a lo largo de transectos realizados para el inventario forestal correspondiente a este estudio.
Variables climáticas
Los datos de las condiciones climáticas del periodo de estudio se consiguieron en los registros de la Comisión Nacional del Agua (2014). La figura 1 presenta las variaciones de precipitación pluvial y la temperatura del aire durante ese periodo.
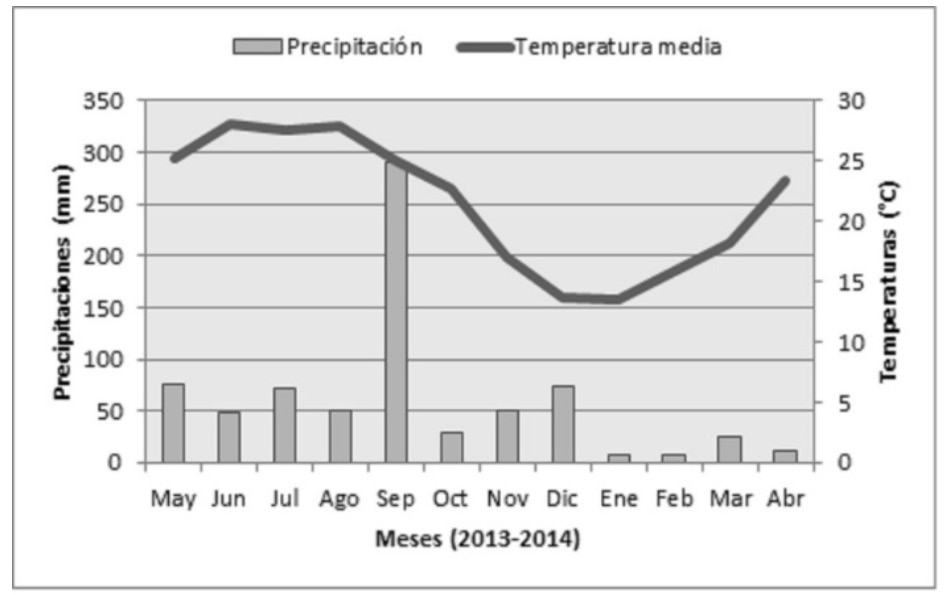
Figura 1. Climograma del periodo de estudio.
Métodos de muestreo
Se seleccionaron y marcaron nueve árboles a monitorear por parcela. El estado fenológico de cada árbol fue medido cada 15 días durante un año (de mayo 2013 a abril 2014), para ello se utilizó un método de evaluación visual y cuantitativa en términos porcentuales, cubriendo todo el periodo de manifestación de las siguientes fenofases: desarrollo vegetativo y reproductivo en inicio, plenitud y declinación, de acuerdo a Villasana y Suárez (1997).
Análisis Estadístico
Los valores porcentuales se transformaron mediante la función raíz cuadrada del arcoseno (Zar, 2010), y se realizaron pruebas de normalidad de los datos para cada variable mediante la prueba Kolmogorov-Smirnov. Se hicieron pruebas de comparación de medias Tukey, a un nivel de confianza de 95% (p=0.05). Estos análisis se realizaron con el programa estadístico SPSS v. 21.0.
Resultados y conclusiones
Los resultados del estudio fenológico de cada especie se presentan en función de las fenofases vegetativa (foliación) y reproductiva (floración y fructificación).
Foliación
El desarrollo vegetativo presentó diferencias significativas (P<0.05) tanto entre especies como por tipo de formación vegetal, con un patrón similar de una irregularidad temporal y cuantitativa de las diferentes fenofases (figura 2).
La formación de nuevas hojas se presentó principalmente durante las estaciones primavera-otoño (de mayo a octubre) del año de estudio, con los picos en primavera (abril, mayo). La tasa de renovación de hojas osciló entre 50 y 100%, siendo Havardia pallens la especie con mayor renuevo (95-100%) y Helietta parvifolia la de menor renuevo (50%). Por otra parte, Ebenopsis ebano, Acacia berlandieri y A. wrightii renovaron sus hojas a 70-85%, 70-80% y 55-70%, respectivamente. Este desarrollo de los renuevos coincidió con los altos valores de precipitaciones, que presentaron promedios de 76 mm en mayo, y hasta 291 mm en septiembre. Sin embargo, la renovación foliar se acercó apenas a un 10%, sería tal vez por las altas temperaturas registradas entre mayo (25.3°C) y octubre (22.7°C), con el valor máximo (28°C) en junio y agosto.
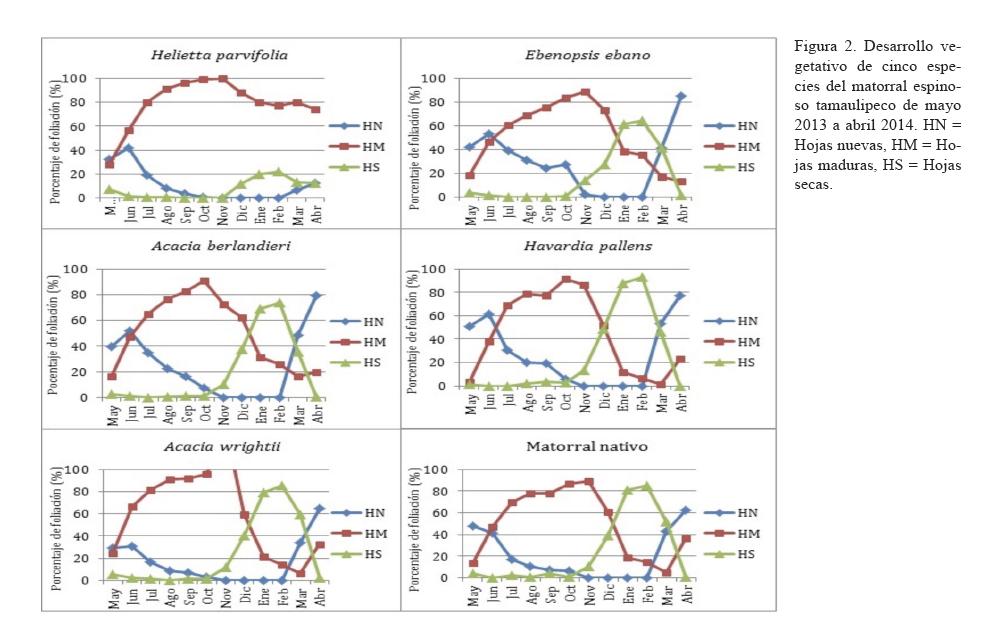
Todas las especies presentaron un cambio gradual de hojas en las diferentes épocas, en las cuales las hojas maduras se mantuvieron en la mayor parte del año.
En invierno, cuando la temperatura llega a su valor más bajo (13.5°C), se registró la máxima pérdida de hojas, del orden de 75 a 95%. Esto corrobora lo que Reid et al. (1990), han reportado: que en los matorrales del noreste de México, las bajas temperaturas invernales influyeron notablemente sobre la pérdida de follaje de 58 especies leñosas en 1989. De igual manera, los mismos autores enfatizaron el efecto de la sequía y altas temperaturas del medio verano sobre la pérdida de hojas. Sin embargo, no se presentó una pérdida significativa de hojas en el presente estudio, lo que representa un cambio preocupante que puede afectar la disponibilidad a largo plazo de este recurso, ya que se considera la pérdida de hojas como un mecanismo de adaptación, en respuesta a la sequía causada por mayores temperaturas. Además, la pérdida de hojas es una vía de retorno de los minerales al suelo, con la finalidad de mantener la productividad de las plantas.
Se puede apreciar que Helietta parvifolia no perdió completamente sus hojas en ninguna época del año, tampoco las renueva completamente; pero la duración e intensidad de las diferentes etapas del desarrollo vegetativo puede constituir adaptaciones a los cambios observados en las condiciones climáticas.
Floración
El desarrollo floral fue irregular en términos cuantitativos, se observaron cuatro eventos (figura 3), con diferencias estadísticas significativas (p<0.05) entre especies. La etapa de formación de botones para la mayoría de las especies fue la más larga (mayo-noviembre) correspondiendo al largo periodo de calor (temperaturas de 22.7 a 28°C), con excepción de A. wrightii (mayo-julio), H. parvifolia (80%) y H. pallens (90%) presentaron los picos máximos en el mes de junio. Para la vegetación nativa, el pico de flores inmaduras se registró en septiembre (50%). Las flores inmaduras se tardaron más en aparecer en E. ebano, presentándose hasta en agosto, al igual que las flores maduras, que se observaron hasta octubre, con una intensidad de 35%.
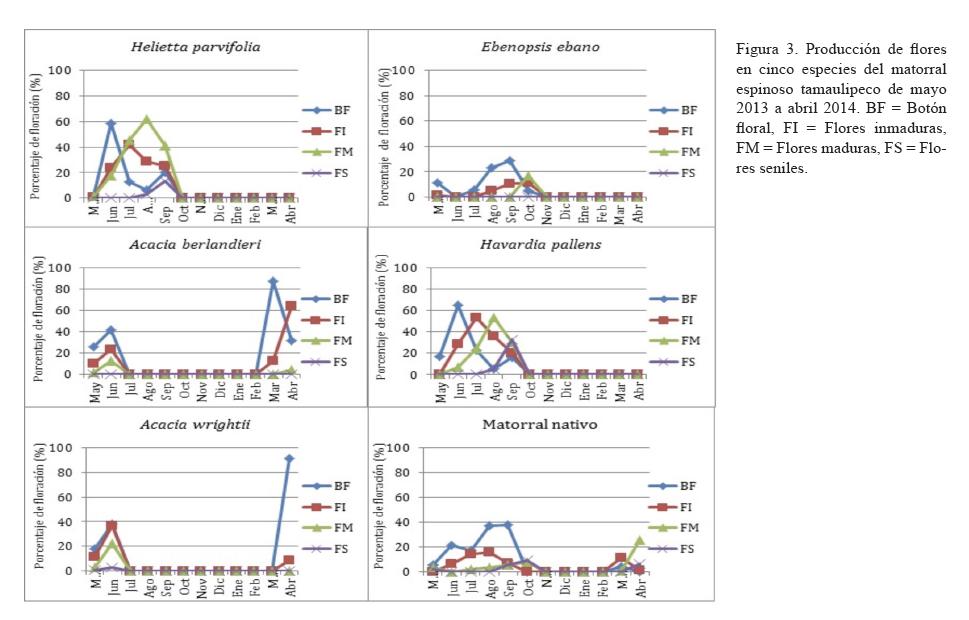
El periodo de maduración de flores fue muy breve y con un solo pico de baja intensidad para A. berlandieri (10%) y A. wrightii (30%), mientras que fue considerable, con dos picos para H. parvifolia (70% en agosto y 65% en septiembre) y H. pallens (65% en agosto y 35% en septiembre). Se puede apreciar que el proceso de maduración frutal es más lento con E. ebano en comparación con las demás especies, las cuales maduraron en forma simultánea. El matorral nativo presentó una secuencia sucesiva en términos de duración e intensidad, con la aparición de botones en mayo (20%), las flores inmaduras en junio (10%) y las flores maduras en agosto (8%). No se han registrados flores seniles en E. ebano y A. berlandieri. En cuanto a H. parvifolia y H. pallens, las flores se desprendieron hasta octubre (otoño), registrándose porcentajes de 25 y 65% de flores seniles, respectivamente. El menor valor se registró con A. wrightii (5%) en el mes de junio (primavera).
De acuerdo a las observaciones en H. pallens y Z. fagara, Alvarado (2003) supone que aquellas especies que evolutivamente han optado por desarrollar con mucha anticipación sus botones florales, posiblemente han ajustado la antesis de los mismos con determinadas condiciones ambientales (por ejemplo, temperatura, precipitación o fotoperiodo), con lo cual corren el riesgo de llevar a maduración los botones al presentarse una determinada condición ambiental, y si esta condición no es sostenida, las flores posiblemente no completarán su desarrollo, por lo que la planta opta por abortarlos tempranamente y no invertir recursos en flores que difícilmente alcanzarán el objetivo final de producir semillas; y para compensar estas pérdidas de estructuras reproductoras, la planta ha desarrollado estrategias como: a) formar una gran cantidad de botones y ante una determinada condición ambiental favorable madurar solamente una parte de ellos, b) la capacidad de desarrollar nuevamente y con rapidez nuevas estructuras reproductoras y c) flores pequeñas para poder producir muchas y en caso de pérdida el costo sea mínimo. De este modo, la floración es considerada como una de las etapas fenológicas más sensibles a cambios climáticos, como lo reportan Spano et al. (1999).
Fructificación
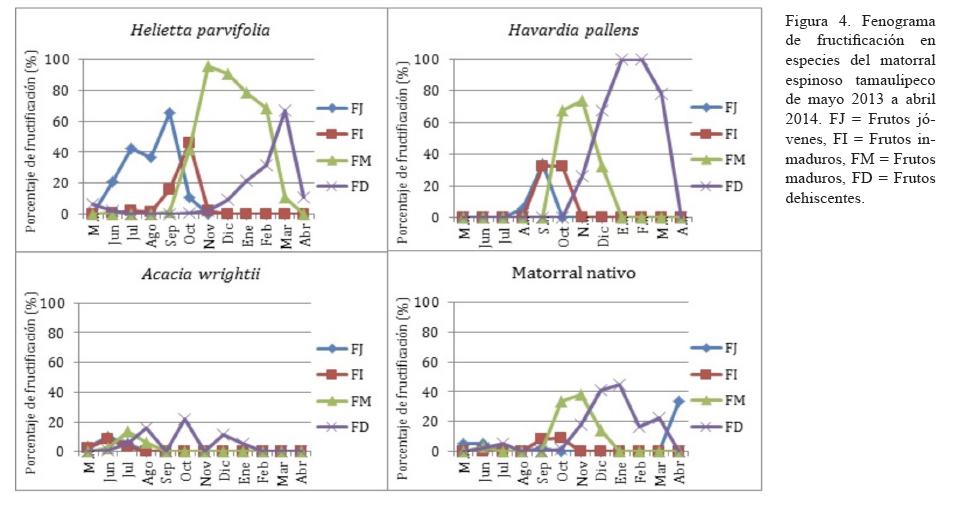
Evento consecutivo a la floración, la fructificación fue muy variada en función de las especies (figura 4). Se presentaron diferencias altamente significativas (p<0.001) entre especies y por formación vegetal. No se observaron frutos en E. ebano debido a los eventos de aborto floral que ocurrieron en esta especie. Para A. berlandieri, la actividad frutal se limitó a unos frutos inmaduros (<10%) registrados a finales de primavera (julio), que no pudieron madurar y se desprendieron inmediatamente.
En las demás especies, las respuestas frutales se distinguieron de manera positiva, con los cuatro eventos bien marcados. Desde la fase embrionaria a la senescencia, los frutos permanecieron más en H. parvifolia (junio-marzo), seguido de H. Pallens y la vegetación nativa (septiembre-marzo), y de A. wrightii (junio-enero). Con excepción de A. wrightii, la maduración de los frutos empezó en septiembre, después de cuatro a seis semanas del inicio de la fructificación, lo que coincidió con las altas precipitaciones registradas en este mes (291.3 mm). En la mayoría de los casos, la duración de las fases de frutos embrionarios a inmaduros es relativamente breve. Sin embargo, la dispersión de las semillas fue bastante lenta, ocupando varios meses.
Con respecto a la época de dispersión de frutos y semillas, los resultados indican que éstos son más abundantes en el verano y a principios del invierno, lo cual es consecuencia de los picos de floración registrados en primavera y otoño. Según Sharp y Davis (1989), los procesos fenológicos de las plantas están determinados por factores ambientales como agua, luz y temperatura. Sin embargo, en las plantas de zonas áridas, la disponibilidad de agua quizá sea el factor limitante (Sayed, 1998; Pavón y Briones, 2001); lo que se ha observado con los eventos fenológicos de las especies estudiadas, particularmente floración y desarrollo vegetativo. La temperatura se presenta entonces como principal factor climático que afecta la fenología de las plantas de zonas áridas y semiáridas, de acuerdo con Menzel (2000), quien indicó que los incrementos en la temperatura del aire pueden ser detectados fácilmente en los datos fenológicos. Los eventos fenológicos de primavera se han mostrados como particularmente sensibles a la temperatura, y según Menzel (2000), el calentamiento que se ha experimentado en las últimas décadas ya ha mostrado efectos en la fenología, provocando en la mayoría de los casos un adelantamiento de los eventos fenológicos de primavera y un alargamiento de la época de desarrollo.
Es evidente la presencia en la región de un patrón de precipitación bimodal, con lluvias en primavera y otoño, separadas en medio verano por un notable periodo de sequía y altas temperaturas, y en invierno también por sequía y temperaturas bajas, lo cual ha determinado notablemente los eventos fenológicos de las especies en estudio, ya que la mayor parte de estos eventos se presentaron en primavera y otoño, además de finales de invierno, previo a las lluvias. Esto es congruente con reportes de sistemas estacionales de desarrollo tanto vegetativo como reproductivo (Murali y Sukumar, 1994; Smith-Ramírez y Armesto, 1994; Ghazanfar, 1997; Ramírez, 2002).
Conclusión
La mayoría de las especies estudiadas desprendió sus hojas y las renovó gradualmente en las épocas favorables del año. La fructificación en la mayoría de los casos se presentó inmediatamente después de la floración y por tanto, el número de eventos fue similar, con excepción de E. ebano y H. pallens en las que se presentaron eventos de aborto de flores, por lo que no llegaron a fructificar. Los frutos pasaron rápidamente del estado embrionario a frutos inmaduros, y permanecieron en esta etapa durante dos a tres meses hasta alcanzar su madurez alrededor del mes de agosto. Los frutos maduros fueron particularmente abundantes en los meses de julio-agosto y noviembre. Estas variaciones tanto en duración como en intensidad del desarrollo vegetativo y reproductivo del matorral espinoso tamaulipeco se presentaron de acuerdo a las condiciones climáticas, constituyéndose como una herramienta factible para el manejo de este recurso, de manera que se pueden predecir los potenciales cambios en su dinámica, para asegurar su permanencia y sustentabilidad. Los rangos obtenidos justifican el gran potencial de los estudios fenológicos para entender la influencia de los factores climáticos sobre las plantas.
* Facultad de Ciencias Biológicas.
** Facultad de Agronomía.
Universidad Autónoma de Nuevo León.
*** Universidad Juárez del Estado de Durango.
Contacto: nheyamaginot@yahoo.fr
Referencias
Abd El-Ghani, M.M. (1997). Phenology of Ten Common Plant Species in Western Saudi Arabia. Journal of Arid Environments. 35:673-683.
Aguirre, C.O. (1992). Investigación del crecimiento radial de diversas especies forestales. Facultad de Ciencias Forestales, UANL (inédito) 19 p.
Alvarado V., M.A. (2003). Análisis fenológico y algunos aspectos reproductivos en especies selectas del matorral xerófilo del noreste de México. Tesis de Doctorado, Facultad de Ciencias Biológicas, UANL. 145 p.
Battey, N.H. (2000). Aspects of seasonality. Journal of Experimental Botany. 51(352): 1769- 1780.
Beatley, J.C. (1974). Phenological events and their environmental triggers in Mojave desert ecosystems. Ecology. 55: 856-863.
Cabral, I., y Treviño, B. (1989). Efecto de corte en la dinámica de crecimiento de especies de uso múltiples del matorral espinoso tamaulipeco en el noreste de México. Simposio Agroforestal de México: sistemas y métodos de uso múltiple del suelo. Facultad de Ciencias Forestales, UANL (memorias) tomo II: 457-469.
Chmielewski, F.M, y Rótzer, T. (2001). Response of Tree Phenology to Climate Change Across Europe.
Agricultural and Forest Meteorology. 108:101-112.
Comisión Nacional del Agua (Conagua). (2014). Servicio meteorológico nacional, resúmenes mensuales de lluvia y temperatura. Disponible en: http://smn.cna.gob.mx/index.php?option=com_content&view=article&id=12&Itemid=112
Famsworth, E.J., et al. (1995). Phenology and Growth of three Temperate Forest Life Forms in Response to Artificial Soil Warming. Journal of Ecology. 83:967-977.
Fresnillo-Fedorenko, D.E., et al. (1996). Phenology of Medicago minima and Enodium cicutarium in Semi-arid Argentina. Journal of Arid Environments. 33:409-416.
Foroughbakhch, R., Peñaloza, R., y Stienen, D.H. (1987). Increasing the productivity in the matorral of northeastern Mexico: domestication of ten multipurpose tree species. In: Symposium of the USDA, 1. Tucson. CD-ROM.
Foroughbakhch, R., et al. (2001). Evaluation of 15 indigenous and introduced species for reforestation and agroforestry in Northeastern Mexico. Agroforestry Syst. 51: 213-221.
Foroughbakhch, R., et al. (2005). Use of quantitative methods to determine leaf biomass on 15 woody shrub species in northeastern Mexico. Forest Ecology and Management. 216: 359-366.
Foroughbakhch, R.P., Hernández-Piñero, J.L., y Carrillo-Parra, A. (2014). Adaptability, growth and firewood volume yield of multipurpose tree species in semiarid regions of Northeastern Mexico. Int. J. Agric. Pol. Res. 2 (12): 444-453. http://dx.doi.org/10.15739/IJAPR.016.
García, E. (2004). Modificaciones al sistema de clasificación climática de Koppen para adaptarlo a las condiciones de la república mexicana. 3ra edición. UNAM, México D.F. P 252.
Garrett, H. (2002). Texas Trees. Traylor Trade Publishing Lanham. Lanham, MD. USA. 253p.
Ghazanfar, S.A. (1997). The phenology of desert plants: a 3-year study in a gravel desert wadi in northern Oman. Journal of Arid Environments. 35:407-417.
Hansen, J., et al. (2000). Global warming in the twentyfirst century: an alternative scenario. Proc. Natl. Acad. Sci. 97(18): 9875-9880.
Hansen, J., et al. (2002). Global warming continues. Science. 295(5553): 275.
Hormazabal, F. (1986). Especies forestales exóticas de interés económico para Chile (Vol. 32). Santiago: Instituto Forestal, 61-111.
Hughes, L. (2000). Biological consequences of global warming: is the signal already apparent. TREE. 15(2): 56-61.
Kemp, P.R., y Gardetto, P.E. (1982). Photosynthetic pathway types of evergreen rosette plants (Liliaceae) of the Chihuahan Desert. Oecologia. 55, 149-156.
Ludwig, J.A., Reynolds, J.F., y Whitson, P.D. (1975). Size-biomass relationships of several Chihuahuan desert shrubs. Amer. Midl. Natur. 94:45 1-46 1.
Menzel, A. (2000). Trends in phenological phases in Europe between 1951 and 1996. Int. J. Biometeorol. 44(2): 76-81
Murali, K.S., y Sukumar, R. (1994). Reproductive Phenology of a Tropical Dry Forest in Mudumalai, Southern India. Journal of Ecology. 82:759-767.
Návar, J., y Bryan, R.B. (1994). Fitting the analytical model of rainfall interception of Gash to individual shrubs of semiarid vegetation in northeastern Mexico. Agric. For. Meteorol. 68: 133-143.
Niembro-Rocas, A. (1990). Árboles y arbustos útiles de México. Mexico, DF: Limusa.
Pavón, N.P., y Briones, O. (2001). Phenological Patterns of Nine Perennial Plants in an Intertropical Semi-Arid Mexican Scrub. Journal of Arid Environments. 49:265-277.
Ramírez, N. (2002). Reproductive phenology, life-forms, and habitats of the Venezuelan central plain. Am. J. Bot. 89 (5):836-842.
Reid, N., et al. (1990). Floristic and Structural Variation in the Tamaulipan Thornscrub, Northeastern Mexico. Journal of Vegetation Science. 1:529-538.
Rossi, B.E., et al. (1999). Comparative Phenology and Floral Patterns in Larrea Species (Zygophyllaceae) in the Monte Desert (Mendoza, Argentina). Journal of Arid Environments 43:213-226.
Rzedowski, S.H. (1978). Vegetación de México. Editorial LIMUSA, México, D. F. 432p.
Sayed, O.H. (1998). Phenomorphology and Ecophysiology of Desert Succulents in Eastern Arabia. Journal of Arid Environments. 40:177-189.
Schwartz, M.D. (1999). Advancing to full bloom: planning phenologlcal research for the 21st century. Int. J. Biometeorol. 42(3): 113-118.
Sharp, R.E., y Davis, W.J. (1989). Regulation of growth and development of plants growing with restricted supply of water. In: Hamlyn, G. J., Flowers, T. J. and Jones, M.B. (eds.), Plants under stress. Cambridge University Press, pp. 71-93.
Smith-Ramírez, C., y Armesto, J.J. (1994). Flowering and Fruiting Patterns in the Temperate Rainforest of Chiloé, Chile-Ecologies and Climatic Constraints. Journal of Ecology. 82: 353-365.
Spano, D., et al. (1999). Phenological stages of natural species and their use as climate indicators. Int. J. Biometeorol. 42(3): 124-133.
Thorhallsdcttir, T.E. (1997). Flowering phenology in the central highland of Iceland and implications for climatic warming in the Artie. Oecologia. 114(1): 43-49.
Velazco-Macías, C.G., et al. (2011). Endemic Flora from Nuevo León, Mexico and Adjacent States. Journal of the Botanical Research Institute of Texas. 5, 275-298.
Villasana, R.A., y Suárez de G., A. (1997). Estudio Fenológico de Dieciséis Especies Forestales Presentes en la Reserva Forestal Imataca Estado Bolívar-Venezuela. Revista Forestal Venezolana. 41(1):13-21.
Villalpando, J.F., y Ruiz, J.A. (1993). Observaciones agrometeorológicas y su uso en la agricultura. UTEHA, México. 134 p.
Volpe, C.A. (1992). Citrus Phenology. In: Proceedings of the Second International Seminar on Cítrus Physiology, p. 103-122.
Wigley, T.M.L., Jones, P.D., y Raper, S.C.B. (1997). The observed global warming record: What does it tell us? Proc. Natl. Acad. Sci. 94: 8314-8320.
Zar, J.H. (2010). Biostatistical Analysis (5th ed.). New Jersey: Prentice-Hall, Inc., 947.
Recibido:06/05/2016
Aceptado:04/10/2017
