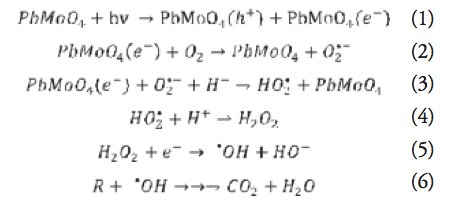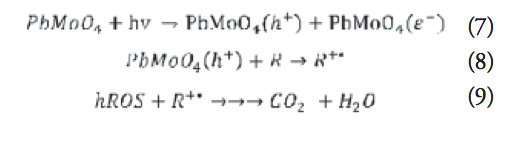Síntesis y caracterización de PbMoO4 fotoactivo para la eliminación de contaminantes orgánicos de agua
D.B. HERNÁNDEZ URESTI*, A. MARTÍNEZ DE LA CRUZ*
CIENCIA UANL / AÑO 16, No. 64, OCTUBRE-DICIEMBRE 2013
El presente artículo está basado en la investigación “Síntesis y caracterización de PbMoO4 fotoactivo para la eliminación de contaminantes orgánicos de agua”, galardonada con el Premio de Investigación UANL 2013, en la categoría de Ingeniería y Tecnología, otorgado en sesión solemne del Consejo Universitario, en septiembre de 2013.
El agua es un compuesto abundante en la Tierra que cubre cerca de 70% de su superficie; sin embargo, 97.5% del vital líquido se concentra en mares y océanos como agua salada. Del 2.5% restante, considerada como agua dulce, 2% se encuentra congelada en casquetes polares y 0.48% está almacenada a 1000 metros de profundidad como agua subterránea. De esta manera, sólo 0.02% del agua total de nuestro planeta se utiliza para consumo humano. Es por ello que suministrar agua potable a la sociedad es un problema que requiere especial atención.
Para eliminar la contaminación del agua procedente de actividades humanas y elevar su calidad para su posterior uso, se han desarrollado un sinnúmero de técnicas físicas y químicas. No obstante, la eficiencia de estas técnicas de purificación es limitada, dada la naturaleza de los procesos involucrados y a las regulaciones cada vez más exigentes de organismos internacionales para alcanzar niveles mínimos de contaminación en el agua dedicada al uso doméstico e industrial.
Hasta hace poco, bastaba que un proceso de purificación de agua fuera viable técnicamente, aplicable a gran escala y en gran medida, económico. Sin embargo, en tiempos modernos debemos incorporar la sustentabilidad del mismo a cualquier propuesta que pretenda atacar esta problemática. Así, la búsqueda de nuevas tecnologías de purificación eficientes y económicamente factibles a escala industrial ha incorporado el uso de la energía solar como fuente energética sustentable.
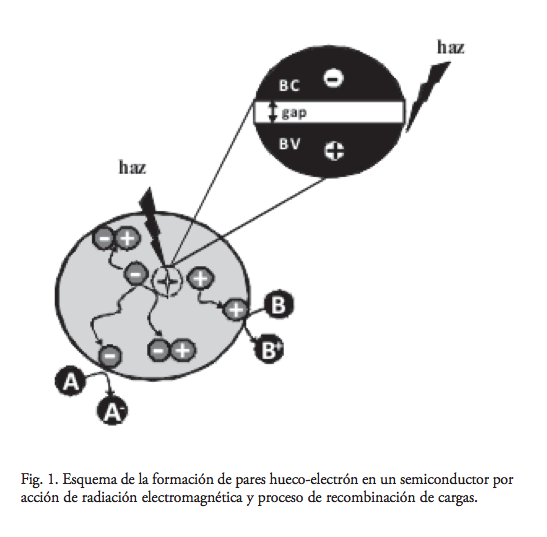
El presente trabajo de investigación se ha realizado en la dirección del desarrollo de una tecnología limpia y redituable, basada en el principio de la fotocatálisis heterogénea para la purificación de agua. La fotocatálisis heterogénea es un proceso que se basa en utilizar un sólido semiconductor que es capaz de absorber energía radiante igual o superior a su banda de energía prohibida. Cuando un fotón con una energía que iguala o supera la energía de banda prohibida (Eg) del semiconductor que incide sobre éste, se promueve un electrón e– de la banda de valencia (BV) hacia la banda de conducción (BC), y se genera un hueco (h+) en la primera banda. Los electrones que llegan a la banda de conducción se desplazan dentro de la red del material semiconductor. De igual forma, se desplazan los huecos vacíos que han dejado en la banda de valencia. Los electrones y los huecos fotogenerados siguen caminos diferentes, como se muestra en la figura 1. Los pares hueco-electrón son fácilmente recombinados para restablecer al semiconductor a su estado inicial, con la consecuente liberación de energía excedente en forma de calor. Aunque poco eficiente, el proceso de separación de cargas progresa al migrar éstas hacia la superficie del fotocatalizador, creando así sitios activos donde, por ejemplo, una molécula orgánica experimenta procesos de oxidación que inicien su descomposición.
La presente propuesta incluye la selección de un semiconductor (PbMoO4) y la modificación de sus propiedades fisicoquímicas para potenciar su actividad fotocatalítica en reacciones de degradación de colorantes orgánicos (rodamina B, índigo carmín, naranja G y naranja de metilo). Lo anterior, mediante el empleo de diversas rutas de síntesis química (estado sólido, coprecipitación, hidrotermal, ultrasonido y microondas), que emplean diferentes condiciones de tratamiento térmico y de enfriamiento para la preparación de óxidos semiconductores con propiedades morfológicas y texturales específicas que inciden en la actividad fotocatalítica del material. La investigación que se presenta forma parte de un estudio sistemático sobre las posibilidades fotoactivas del PbMoO4 que hemos venido realizando en los últimos cuatro años, y cuyos principales resultados han sido publicados recientemente. (1-4)
EXPERIMENTAL
Síntesis de las muestras
El material PbMoO4 se preparó en forma policristalina mediante diferentes métodos: reacción en estado sólido (SS), coprecipitación (Cop), hidrotermal (H60), sonoquímica (Sono) y radiación con microondas (MW). Para la preparación del molibdato, por el método de reacción en estado sólido, se pesaron cantidades en relación estequiométrica apropiada del óxido MoO3 y la sal Pb(NO3)2, se homogeneizaron y la mezcla reactiva se compactó en forma de pastilla por medio de una prensa mecánica. Las pastillas se calcinaron a 950ˆC en un horno eléctrico durante 72 horas. Posteriormente, la muestra se enfrió a temperatura ambiente.
Para la síntesis por coprecipitación se utilizaron como precursores Pb(NO3)2 y (NH4)6Mo7O24 •4H2O. A partir de dichas sales, se prepararon dos soluciones acuosas. La solución de Pb(NO3)2 se vertió lentamente gota a gota en la solución de (NH4)6Mo7O24.4H2O, manteniendo una agitación vigorosa que originó una suspensión de color blanco. Se ajustó a pH= 11, utilizando NH4OH. La suspensión se mantuvo en agitación durante 30 minu- tos adicionales. Una vez formado el precipitado, éste se separó por filtración.
En la preparación de PbMoO4, mediante el método hidrotermal, se utilizaron como reactivos H2MoO4 y Pb(NO3)2, los cuales se disolvieron en 75 mL de agua desionizada. Posteriormente, la disolución se mantuvo en agitación vigorosa dentro de un baño de ultrasonido y se ajustó a pH= 11 por adición de NH4OH. La suspensión se transfirió a una autoclave de acero inoxidable. El proceso hidrotermal se realizó a 60ˆC, con una velocidad de calentamiento de 2ˆC.min-1, durante 10 minutos. Transcurrido este tiempo, se realizaron varios lavados con agua desionizada al precipitado resultante, con el fin de neutralizar el pH (~7), y después se procedió a la evaporación del solvente a 70ˆC.
En la síntesis del método por sonoquímica se partió de los reactivos H2MoO4 y Pb(NO3)2, y se siguió el procedimiento experimental descrito a de- talle en la bibliografía. (5) Para la preparación de la muestra por radicación con microondas, se vertieron 15 mL de etilenglicol anhídrido en un vaso de precipitado, y se añadieron 5 mmoles de H2MoO4 y de Pb(NO3)2, con agitación constante, y se ajustó a pH= 11 con NH4OH. La dispersión de color blanco se transfirió a un equipo de microondas para someterla a un calentamiento mediante la aplicación de 50% de la potencia del horno de 120W, durante 20 minutos. Posteriormente, el sólido obtenido se separó por filtración.
CARACTERIZACIÓN
La caracterización estructural del óxido PbMoO4 fue realizada por difracción de rayos-X en polvo (DRX) con un difractómetro Bruker Advanced X-Ray Solution D8, con radiación K del Cu (λ= 1.5418 Å). Las mediciones se realizaron en un intervalo 2θ de 10° a 60°, con un tamaño de paso de 0.05°, y un tiempo de 0.05 segundos por cada paso. La banda de energía prohibida (Eg) se determinó mediante espectroscopía de reflectancia difusa (DRS), con un espectrofotómetro Perkin Elmer Precisely Lambda 35 UV/Vis, con esfera de integración. El área superficial de los fotocatalizadores se determinó mediante la fisisorción de nitrógeno (método BET), utilizando un analizador Bel-Japan Minisorp II. La morfología de las muestras se analizó mediante la técnica de microscopía electrónica de barrido (SEM) con un microscopio FEI Nova Nano SEM de bajo vacío, con un voltaje máximo de aceleración de 3 kV.
Pruebas fotocatalíticas
Las reacciones de degradación fotocatalítica se llevaron a cabo en un reactor de inmersión de borosilicato con chaqueta de enfriamiento para mantener la temperatura de reacción en 25°C ± 1°C. Como fuente de radiación UV, se utilizó una lámpara heterocromática de Xe de 10,000 K. La intensidad de la radiación UV ( > 390nm) fue de 1,380 μW.cm-2.
La actividad fotocatalítica de PbMoO4 se evaluó en la reacción de degradación de rodamina B (RhB), índigo carmín (IC), naranja G (OG) y naranja de metilo (MO) en solución acuosa. En un vaso de precipitado, se agregaron 200 mL de una solución del colorante orgánico que contenía 200 mg de PbMoO4, posteriormente se transfirió a un baño de ultrasonido para la eliminación de agregados. Tomando en cuenta el coeficiente de absorción molar de cada colorante, las concentraciones iniciales fueron 5, 30, 20, y 20 mg. L-1 para RhB, IC, OG y MO, respectivamente. A fin de asegurar que el equilibrio de adsorción-desorción del colorante en la superficie de catalizador se hubiera alcanzado, la solución se mantuvo en reposo en la oscuridad por 1 h. Después de este tiempo, la lámpara se encendió. Durante la reacción, las muestras se tomaron del reactor a diferentes intervalos de tiempo, y luego se analizaron mediante un análisis colorimétrico, tomando como referencia el máximo de absorción de cada colorante para determinar su concentración.
Durante la reacción de fotodegradación, se analizó el efecto del pH de la dispersión y O2 disuelto. Se llevaron a cabo experimentos en condiciones ácidas y básicas a pH= 4 y 10, añadiendo HNO3 o NH4OH, respectivamente. Se realizaron experimentos con un flujo continuo de O2 de 120 mL.min-1, el cual se burbujeó durante el curso de la reacción para saturar la solución.
El grado de mineralización se siguió mediante el análisis del contenido de carbón orgánico total (TOC) de las soluciones con diferentes tiempos de irradiación. Se utilizaron 250 mL de la solución del colorante (50 mg.L-1 para RhB, OG y MO; y 100 mg.L-1 para IC) con 250 mg de fotocatalizador. Las muestras irradiadas se analizaron en un analizador de TOC Shimadzu VSCN8.
RESULTADOS Y DISCUSIONES
Caracterización de las muestras
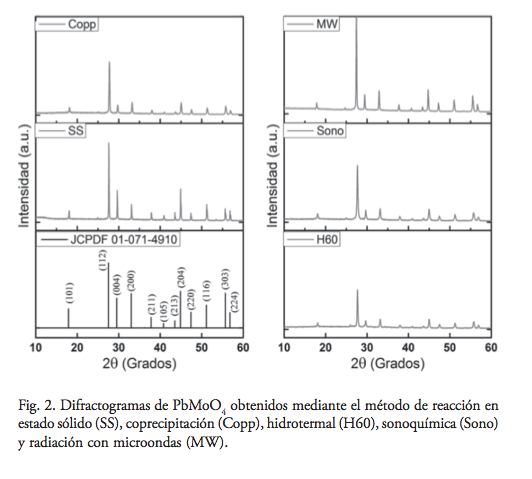
Las muestras obtenidas por los diferentes métodos de síntesis se caracterizaron estructuralmente mediante difracción de rayos-X en polvo. Los difractogramas obtenidos mostraron la presencia de la fase tetragonal de PbMoO4, sin la presencia de impurezas, de acuerdo a la tarjeta JCPDS No. 01-071-4910, como se observa en la figura 2. En particular, la muestra PbMoO4 (MW) presentó la mayor cristalinidad, como lo demuestra su difractograma con líneas de difracción bien definidas y altas intensidades.
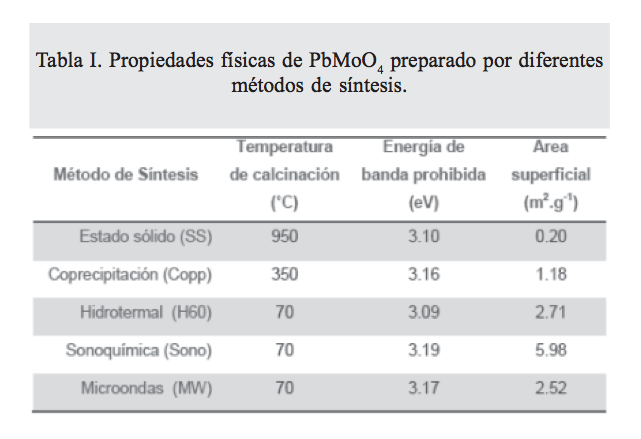
La energía de banda prohibida se obtuvo mediante los espectros de reflectancia difusa (DRS), y los valores se muestran en la tabla I. Todas las muestras obtenidas presentaron un valor de Eg mayor a 3 eV, lo cual define que son fotocatalizadores que pueden activarse mediante radiación UV. Para determinar el área superficial de los materiales sintetizados, se realizaron análisis de fisisorción de nitrógeno, con el método BET (tabla I). La muestra PbMoO4 (SS) exhibió el menor valor de área, debido a que la alta temperatura de síntesis promovió un proceso de crecimiento de partícula mediante un mecanismo de sinterización. Cuando el PbMoO4 fue sintetizado por el resto de los métodos de síntesis, el área superficial del material se incrementó en aproximadamente un orden de magnitud, alcanzando un valor máximo de 5.98 m2.g-1 para PbMoO (Sono).
La morfología de las muestras se observó mediante SEM (figura 3). De acuerdo al análisis por SEM, la muestra (SS) no presentó una morfología definida en particular, con ausencia de aglomerados y con tamaños superiores a 2 μm (3a). La fase obtenida mediante el método de coprecipitación presentó una morfología irregular tipo oval en sus partículas, con un tamaño menor al observado para PbMoO4 (SS), del orden de 350 nm (3b).
La muestra obtenida mediante el método hidrotermal presentó una morfología de sus partículas en forma octaédrica o de bipirámide, con tamaño de 150-300 nm (3c). Esta morfología es ocasionada por la temperatura y la presión utilizada en el reactor hidrotermal, ya que estas condiciones son capaces de promover el mecanismo de nucleación, agregación y recristalización de las partículas. En el proceso de coalescencia se incrementó la concentración de partículas, que durante su crecimiento probablemente causó la formación de defectos superficiales en sus caras. (6) Las partículas presentaron una orientación preferencial al plano cristalográfico [001], ya que los cristales tendieron a formarse con una mayor velocidad de crecimiento en esa dirección. (7)
Las partículas obtenidas mediante el método de sonoquímica mostraron una morfología semiesférica, utilizando como medio dispersante etilenglicol (EG) (3d). Los efectos físicos del ultrasonido como la cavitación originaron núcleos limitados durante la etapa de crecimiento de las partículas, debido al tiempo de duración de los colapsos de implosión de las burbujas en el líquido (> 1ns). Dicha implosión ocasionó una distribución homogénea en el tamaño de cristal y tamaño de partícula, disminuyendo la formación de aglomerados y promoviendo una morfología definida.
La muestra de PbMoO4 (MW) está formada por partículas con una morfología en forma ovalada (3e). La radiación con microondas produjo un calentamiento muy rápido de toda la suspensión que favoreció la nucleación de los cristales, alcanzando una distribución de tamaño de partícula homogénea. El EG absorbe las ondas de alta frecuencia, al formarse la fase PbMoO4 también absorbió las microondas y produjo partículas de tamaño homogéneo mediante el mecanismo de Ostwald Ripening. (8)
En este mecanismo, los centros de nucleación se aglomeran y disuelven, generando pequeñas partículas, en las que los aglomerados grandes crecen a partir de los aglomerados de partículas más pequeñas, que se disuelven y desaparecen.
La síntesis por reacción en estado sólido (SS) se realizó con el propósito de tomar el material obtenido por este método como referencia. Para los cuatro colorantes utilizados, se observó una incipiente actividad fotocatalítica de PbMoO4 (SS), alcanzándose decoloraciones apenas de 11 (RhB), 12 (IC), 8 (OG) y 10% (MO). Un notable incremento en la actividad fotocatalítica de PbMoO4 (SS) se observó a pH= 4 para RhB, IC y OG. Los porcentajes de degradación alcanzados bajo condiciones ácidas, luego de 240 min de irradiación UV, fueron de 85 (RhB), 98180min (IC), 52 (OG) y 18% (MO).
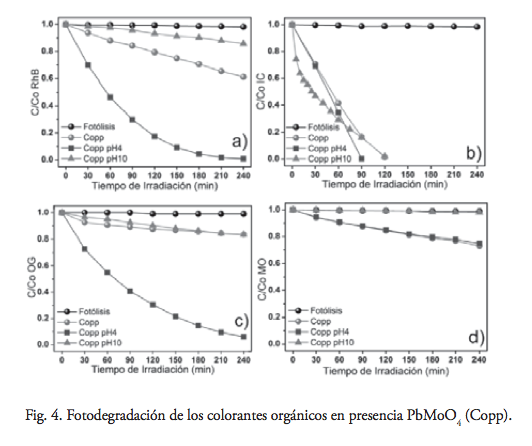
La actividad fotocatalítica de PbMoO4 obtenido mediante coprecipitación en la degradación de los colorantes orgánicos mencionados se muestra en la figura 4.
Primero se evaluó la fotólisis y se observó que no hay cambios en la concentración del colorante res- pecto al tiempo. Posteriormente, se realizaron experimentos en presencia de PbMoO4 (Copp), se observó un descenso en el tiempo de vida media del RhB y OG en condiciones ácidas (pH = 4), en comparación con el fotocatalizador PbMoO4 (SS). Sin embargo, IC y MO mostraron el mismo comportamiento a pH natural y ácido, lo cual sugiere que un mecanismo alterno de degradación se está llevando a cabo, mismo que se discutirá más adelante.
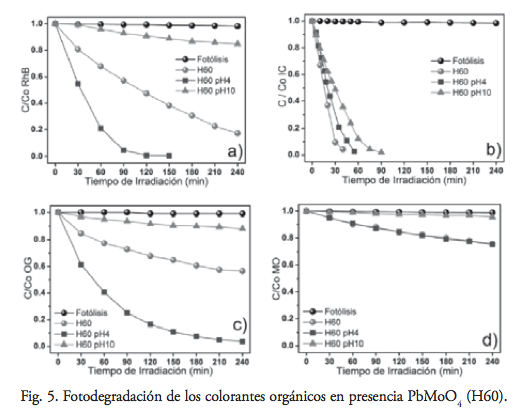
La figura 5 muestra la variación de la concentración de los colorantes RhB, IC, OG y MO en función del tiempo de irradiación UV, cuando PbMoO4 (H60) se utilizó como fotocatalizador. Bajo condiciones normales del experimento, esto es al pH natural de la dispersión, se observó una mayor actividad de PbMoO4 (H60) para la degradación de RhB, IC y OG, con respecto a (SS) y (Copp).
El efecto del pH de la dispersión en la velocidad de degradación de los colorantes mostró un aumento considerable de la actividad a pH= 4 para RhB y OG, un nulo aumento de la actividad bajo esta condición ácida para IC, aunque presentando alta actividad incluso para el pH básico de 10 y, por último, un incremento despreciable en la actividad bajo condiciones ácidas para MO.
La decoloración total (100%) de los colorantes orgánicos en condiciones ácidas se alcanzó a los 120, 60 y 240 minutos de irradiación para RhB, IC y OG, respectivamente. Para el caso del MO, sólo se alcanzó 25% de decoloración después de 240 minutos de irradiación UV, confirmando el comportamiento recalcitrante del colorante azo.
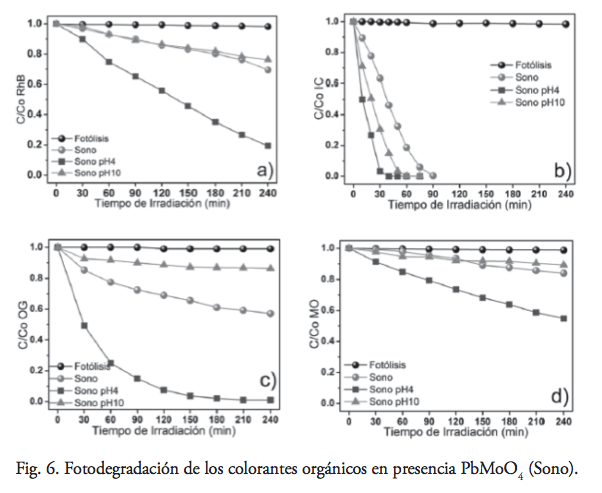
En términos globales cualitativos, el comportamiento del sistema en presencia de PbMoO4 (Sono) es similar al detallado anteriormente para las muestras de PbMoO4 (SS, Cop, H60), y se muestra en la figura 6. No obstante, para este caso particular se presentó un considerable aumento de la actividad fotocatalítica en la degradación del colorante MO, que hasta entonces había mostrado un comportamiento recalcitrante.
Para esta serie de experimentos se observó un descenso en la actividad fotocatalítica de la reacción con RhB, incluso cuando se compara con PbMoO4 (SS), pero al mismo tiempo el mayor incremento en la actividad fotocatalítica observado para el caso de IC (nueve veces) y MO (doble de veces). Lo anterior, permite inferir la existencia de una correlación entre las propiedades superficiales de PbMoO4 y la estructura molecular del colorante orgánico.
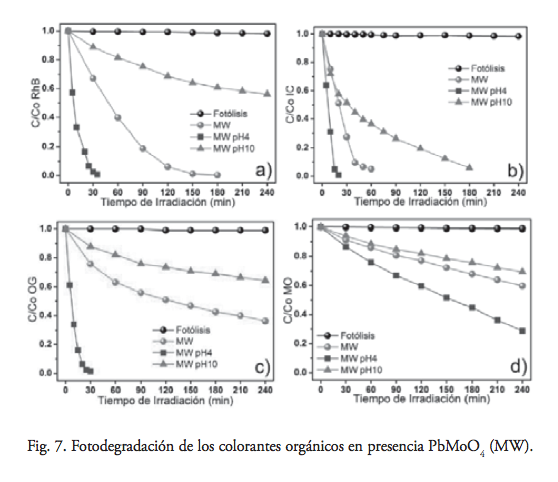
En la figura 7 se observa que PbMoO4 (MW) presenta la mayor actividad fotocatalítica de lo hasta ahora presentado por PbMoO4, preparado por otros métodos de síntesis para los cuatro colorantes. Las propiedades físicas resaltables para esta muestra obtenida por radiación con microondas radican en que tiene un área superficial trece veces mayor que PbMoO4 (SS), y es la fase que presentó la mayor cristalinidad. La combinación de estas propiedades físicas y la eficacia de irradiación sobre las partículas operarían para alcanzar la mayor actividad fotocatalítica observada.
De acuerdo a lo expuesto en los resultados anteriores, la actividad fotocatalítica de PbMoO4 se modifica por variación del pH de la dispersión, así como por las propiedades texturales y morfológicas del molibdato, de acuerdo al método de síntesis empleado. En particular, el pH ácido de la dispersión trajo consigo para algunos casos un aumento en la velocidad de degradación del colorante orgánico (R).
Este efecto se explica al considerar que un posible mecanismo de reacción que siga los siguientes pasos, de acuerdo a la formación de especies reactivas altamente oxidantes (hROS):
El mecanismo de degradación propuesto establece que los electrones de la banda de conducción (e–) y los huecos de la banda de valencia (h+) se generan cuando la suspensión de PbMoO4 se irradia con radiación UV de mayor energía que la de la banda de energía prohibida del molibdato (reacción 1). Los electrones (e–) pasan a la banda de conducción, y dejan huecos (h+) en la banda de valencia. Los electrones interaccionan con el oxígeno molecular disuelto para generar el radical superóxido (02.- ), como se indica en la reacción 2.
El aumento en la actividad fotocatalítica a pH ácido se justifica bajo este mecanismo, porque una mayor concentración de protones desplaza las reacciones 3 y 4 hacia la derecha, situación que promueve una serie de reacciones que favorecen la generación de radicales •OH (reacción 5). Este mecanismo propone la reducción por medio de los electrones y es favorecido por la presencia de protones (H+) para una mayor fotodegradación del compuesto orgánico. Paralelo al mecanismo de degradación propuesto, otras series de reacciones competitivas tienen lugar en la dirección de degradar la molécula del colorante orgánico sin involucrar la presencia de protones. Así, un segundo mecanismo de degradación opera mediante la oxidación directa de la molécula orgánica (R) por acción de los huecos fotogenerados:
En este mecanismo, la molécula del colorante orgánico se somete a una degradación oxidativa a través de los huecos de la banda de valencia (reacción 8), para generar especies reactivas de oxígeno (hROS), lo que origina una serie de reacciones que llevan a la remoción del contaminante orgánico (reacción 9).
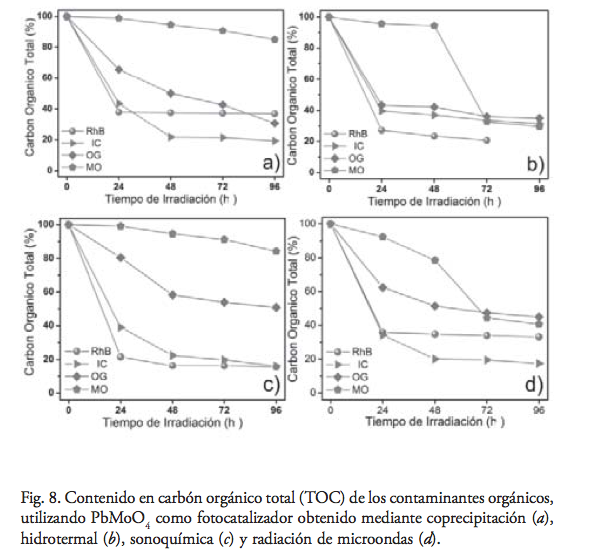
Con el fin de determinar el grado de mineralización de los colorantes orgánicos por acción del PbMoO4, se realizaron experimentos para determinar el contenido del carbón orgánico total (TOC) en solución a distintos tiempos de irradiación de luz UV. La relación fotocatalizador-solución utilizada fue de 1 mg de fotocatalizador por 1 mL de solución de colorante, y la dispersión fue irradiada durante 96 horas, como se muestra en la figura 8. La degradación de la RhB por los cuatro fotocatalizadores exhibió un alto grado de mineralización durante las prime- ras 24 h de irradiación de la dispersión con luz UV.
Este fenómeno se explica por la formación de intermediarios en las reacciones iniciales que producen la decoloración de la solución, pero cuya naturaleza recalcitrante frena el proceso de mineralización. En los colorantes IC y OG, se observó un comportamiento similar al caso de RhB, en el que la mayor mineralización se alcanzó durante las primeras 24 h de irradiación UV. Cabe mencionar que, para las muestras PbMoO4 (Copp) y PbMoO4 (Sono), la mineralización de OG no fue detenida del todo a las 24 horas de irradiación UV, observándose un ligero des- censo en la concentración para tiempos posteriores.
La mineralización del MO fue de manera gradual y con un pequeño grado de conversión a lo largo de las 96 h del experimento, en presencia de PbMoO4 (Copp) y PbMoO4 (Sono). Lo anterior indica el grado recalcitrante del colorante, así como de los intermediarios primarios formados, situación acorde con lo observado durante los experimentos de decoloración de MO. En un segundo tipo de comportamiento, observado en PbMoO4(H60) y PbMoO4(MW), la mineralización se conduce de manera lenta, pero variando abruptamente después de 72 h. Esto no sólo indica un mayor grado de conversión de MO para PbMoO4 (H60) y PbMoO4 (MW), sino una mayor velocidad de reacción, en la que se percibe nuevamente un descenso en la misma, para tiempos más largos, debido a la oxidación a compuestos más estables.
CONCLUSIONES
En el presente trabajo de investigación, se propone al óxido semiconductor PbMoO4 como potencial fotocatalizador en la reacción de fotodegradación de colorantes orgánicos en medio acuoso bajo radiación UV. A partir de la hipótesis de que la modificación de las propiedades fisico-químicas del óxido puede potenciar su capacidad como fotocatalizador, se han propuesto cinco métodos de síntesis para revisar esta posibilidad.
Los resultados mostraron una notable diferencia en la actividad de PbMoO4, en función del método de síntesis, observándose que la actividad fotocatalítica sigue la dirección MW > Sono > H60 > Copp > SS. La naturaleza de los métodos de síntesis y, por ende, el tipo de material que produjeron (homogeneidad del material, tamaño de partícula, área superficial, morfología) son los factores que determinaron este orden de actividad fotocatalítca.
Los mejores resultados revelaron la capacidad de la muestra MW para reducir el tiempo de vida media de los colorantes RhB, IC y OG de 100, 87 y 223 min, hasta sólo 7 min en los tres casos. Por un lado, esto muestra la versatilidad de PbMoO4 para actuar efectivamente ante diferentes familias de compuestos orgánicos; y por otro lado, la efectividad del fotocatalizador al reducir el t1/2 a valores más que competitivos para pensar en una potencial aplica- ción tecnológica.
Independientemente del método de síntesis, la actividad fotocatalítica de PbMoO4 para la degradación de los colorantes fue en la dirección IC > RhB > OG > MO. La dificultad para degradar OG y MO se asocia con la presencia de grupos funcionales azo (-N=N-), en sus respectivas estructuras moleculares y con la formación de compuestos intermediarios estables en el curso de la reacción. El análisis del efecto del pH permitió proponer un mecanismo de degradación que opera mediante la fotorreducción del oxígeno, y alternativamente un segundo mecanismo en el que ocurre una oxidación directa del colorante por acción de los huecos generados.
El grado de mineralización alcanzado para los cuatro colorantes estudiados, así como la estabilidad del fotocatalizador ante sucesivos ciclos de uso y su insolubilidad en el medio de reacción, son factores que justifican su potencial aplicación en procesos de purificación de agua. A la luz de los resultados obtenidos, como trabajo futuro se vislumbra buscar las condiciones experimentales para preparar PbMoO4 en forma de película delgada y evaluar su actividad ante un mayor espectro de especies orgánicas contaminantes (fármacos, insecticidas y plaguicidas), en aras de encaminar la posible aplicación comercial del semiconductor.
RESUMEN
En el presente trabajo, se propone al molibdato de plomo PbMoO4 como fotocatalizador para la degradación de contaminantes orgánicos en medio acuoso para la purificación de agua. En términos generales, la parte medular del trabajo se divide en tres partes: el diseño de la síntesis del material, su caracterización y su posible aplicación tecnológica. Así, el trabajo consta de una parte en la que se utilizan diferentes rutas de síntesis de PbMoO4, con la finalidad de potenciar su actividad fotocatalítica; en una segunda etapa, se realiza su caracterización, y en una tercera se encamina el trabajo hacia una aplicación tecnológica, mediante el estudio de la actividad de los materiales para la degradación foto-oxidativa de contaminantes orgánicos presentes en agua.
Palabras clave: Fotocatálisis heterogénea, PbMoO4, molibdato, Colorantes orgánicos, Mecanismos de degradación.
ABSTRACT
In this work the PbMoO4 molybdate is proposed as photocatalyst for the degradation of organic pollutants in water. In general, the core part of the work can be divided in three sections that include the design of the synthesis of material, its characterization, and finally, the evaluation of its possible technological application. In this way, this work consists of a first section where PbMoO4was synthesized by different routes in order to improve its photocatalytic activity, a second section where the samples were characterized and, a third section where was evaluated the possible application of the material by the study of its photocatalytic activity for the photo-oxidative degradation of organic dyes in water.
Keywords: Heterogeneous photocatalysis, PbMoO4, Molybdate, Organic dyes, Degradation ́s mechanism.
AGRADECIMIENTOS
Agradecemos al Conacyt, por su apoyo a este trabajo de investigación, a través del proyecto 167018, y a la UANL por el apoyo del proyecto Paicyt 2012.
*Universidad Autónoma de Nuevo León, FIME-CIIDIT. Contacto: azael70@yahoo.com.mx
REFERENCIAS
1. A. Martínez de la Cruz, D.B. Hernández Uresti, Leticia M. Torres Martínez, S.W. Lee, Photocatalytic properties of PbMoO4 synthesized by a hydrothermal reaction, Reac. Kinet. Mech. Cat., 2012. 107: pp.467-475.
2. D.B. Hernández Uresti, A. Martínez de la Cruz, Leticia M. Torres Martínez, Photocatalytic properties of PbMoO4 synthesized by co-precipitation method: organic dyes degradation under UV irradiation. Res.Chem.Inter., 2012. 38: pp. 817-828.
3. D.B. Hernández-Uresti, J.A. Aguilar-Garib, A. Martínez- de la Cruz, Photocatalytic degradation of RhB with microwave prepared PbMoO4, J. Microwave Power and Electromagnetic Energy, 2012. 46 (3): pp. 163-173.
4. D.B. Hernández Uresti, A. Martínez de la Cruz, J.A. Agui- lar-Garib, Photocatalytic activity of PbMoO4 molybdate synthesized by microwave method, Catalysis Today, 2013. 212: pp.70-74.
5. A. Phuruangrat, T. Thongtem, S. Thongtem, Analysis of lead molybdate and lead tungstate synthesized by a sonochemical method, Curr. App. Phys., 2010. 10(1): pp. 342-345.
6. J.C. Sczancoski, L.S. Cavalcante, M.R. Joya, P.S. Pizani, J.A. Varela, E. Longo, M.S. Li, J.A. Andrés, Morphology and blue photoluminescence emission of PbMoO4 processed in conventional hydrothermal, J. Phys. Chem. C, 2009. 113: pp. 5812-5822.
7. W.S.J. Liu, B. Hu, J.Y. Gong, S.H. Yu, Novel anatase TiO2 boxes and tree-like structures assembled by hollow tubes: D,L-malic acid-assisted hydrothermal synthesis, growth mechanism, and photocatalytic properties, Cryst. Growth Des., 2009. 9: pp.1511-1518.
8. M.A. Mahmood, S. Baruah, J. Dutta, Enhanced visible light photocatalysis by manganese doping or rapid crystallization with ZnO nanoparticles, Materials Chemistry and Physics, 2011. 130: pp. 531-535.
Recibido: 1 de agosto de 2013 Aceptado: 9 de septiembre de 2013