Actividad antibacteriana del extracto metanólico de Ficus carica sobre bacterias multifarmacorresistentes
Catalina Leos-Rivas ORCID: 0000-0002-3626-7263
David Gilberto García-Hernández ORCID: 0000-0001-8409-139X
María Julia Verde-Star ORCID: 0000-0001-8837-2682
Catalina Rivas-Morales ORCID: 0000-0001-9786-4953
Luis Ángel Alba-Ipiña
CIENCIA UANL / AÑO 27, No.125, mayo-junio 2024
RESUMEN
Desde tiempos antiguos las plantas han constituido un recurso en los sistemas de salud en países en desarrollo, la OMS ha estimado que más de 80% de la población emplea la medicina tradicional. Las bacterias van adquiriendo resistencia a los fármacos, debido a esto se buscan alternativas. El propósito de este estudio fue la evaluación del extracto metanólico de Ficus carica (higuera) contra cepas bacterianas multifarmacorresistentes. Éste presenta actividad contra E. coli 25922 y S. aureus BAA-44 con una concentración mínima inhibitoria de 1,000 μg/ml, además contiene esteroles, terpenos, flavonoides carbohidratos.
Palabras clave: Ficus carica, farmacorresistencia, extracto metanólico, actividad antibacteriana, extracto de plantas.
ABSTRACT
Since ancient times, plants have been a resource in health systems in developing countries, the WHO has estimated that more than 80% of the population employs traditional medicine. Bacteria are acquiring drug resistance, due to this alternatives are sought. The purpose of this study was the evaluation of the methanolic extract of Ficus carica (Fig tree) against multidrug-resistant bacterial strains. The methanolic extract of F. carica shows activity against E. coli 25922 and S. aureus BAA-44 with a minimum inhibitory concentration of 1,000 μg/ml, as well as the presence of sterols, terpenes, flavonoids and carbohydrate.
Key words: Ficus carica, drug resistance, methanolic extract, antibacterial activity, plant extracts.
Desde tiempos remotos la humanidad ha utilizado las plantas contra diversos padecimientos; en la actualidad representa un recurso muy valioso en los sistemas de salud de los países en desarrollo. Los datos precisos para evaluar la extensión sobre su empleo global son inexistentes, pero la Organización Mundial de la Salud (OMS, 2016) ha estimado que más de 80% de la población mundial emplea de manera rutinaria la medicina tradicional en la satisfacción de su necesidad primaria de salud. Además, la mayor parte de los tratamientos implica el uso de extractos y principios activos de éstas (Ssegawa y Kasenene, 2007; Katewa et al., 2005).
Las plantas medicinales en México y en diversas zonas del mundo se utilizan en padecimientos comunes: dolor estomacal, de cabeza, afecciones en la piel, anemia. También se usan en el tratamiento de enfermedades más complejas: diabetes, epilepsia, problemas de fertilidad, cálculos renales, gangrena y cáncer, ya que la medicina moderna carece de tratamientos definitivos que las eliminen o erradiquen (Aguilar et al., 1994; Argueta, 1994).
El descubrimiento de la penicilina por Alexander Fleming (1929) marcó el comienzo de la era de los antibióticos. Después de este hallazgo, en la década de 1940, se presentaron cepas productoras de penicilinasa, esto generó la producción de penicilinas semisintéticas resistentes a esta enzima. Un año más tarde se reportó la presencia de cepas resistentes a la meticilina (MRSA) en el Reino Unido (RU) (Jevons, 1961).
Acorde con esto, la búsqueda de nuevas alternativas para controlar enfermedades ocasionadas por microrganismos farmacorresistentes es imprescindible y de vital importancia en el control de enfermedades ocasionadas por microrganismos farmacorresistentes. Por lo que el estudio se enfocó en evaluar la actividad antibacteriana de F. carica sobre Staphylococcus aureus (ATCC BAA-44), Pseudomonas aeruginosa (ATCC 27853), Escherichia coli (ATCC 25922), Klebsiella pneumoniae (ATCC 700603), Acinobacter baumannii (ATCC 15308) y Enterococcus faecalis (ATCC 29212).
ANTECEDENTES
Los primeros antecedentes sobre el uso de las plantas medicinales parten de la prehistoria, en estudios realizados en Shanidar, Irak, con 60,000 años de antigüedad, en donde se encontraron restos de ocho especies de plantas posiblemente empleadas como medicina (Porter, 1967).
La medicina tradicional desempeña un doble papel: por un lado ser competitiva con la medicina llamada oficial u occidental, en cuanto a la cura y profilaxis. Pero también se convierte en un instrumento valioso, proveedor de medios específicos que guían investigaciones cuyos objetivos son la búsqueda de nuevos medicamentos o terapias no normalizadas (Prieto-González et al., 2004). Actualmente, el consumo de plantas medicinales se asocia al concepto de inocuo y saludable. Sin embargo, se debe tener conocimiento sobre las interacciones con otros medicamentos para evitar riesgos en la salud de quienes lo consumen (Moreale et al., 2012).
Cruzado et al. (2013) recomiendan masticar las hojas de Ficus carica (higuera) si se quiere eliminar las ulceras; el jugo de las hojas contiene una gran cantidad de fibra que beneficia el sistema digestivo, esto se recomienda en personas con sobrepeso, ya que mejora el ritmo digestivo y combate el estreñimiento pues es un laxante natural.
Abarca y Chávez (2018) determinaron que el extracto etanólico de las hojas de F. carica L (higo) presenta actividad antiulcerosa en ratas a una dosis de 800 mg/kg, ya que inhibe 83.01% la ulceración gástrica, en comparación con la ranitidina, que inhibe 73.58%. Además contiene flavonoides, alcaloides, compuestos fenólicos y grupos amina libres detectados por análisis fitoquímico.
Expósito et al. (2017) obtuvieron fracciones de A-F de hojas y órganos aéreos, frutos verdes y maduros de F. carica L, en los cuales detectaron compuestos por tamizaje fitoquímico. La fracción A contiene aminas, taninos, la fracción B contiene triterpenos-esteroideos y las fracciones C y D de hojas y frutos presentan flavonoides, las fracción D y E proantocianidinas-catequinas. En la fracción E sólo se detectaron azúcares reductores y en la F las saponinas. La composición química de los frutos y hojas de F. carica L es similar a las especies de otros países.
Belattar et al. (2021) determinaron el potencial antimicrobiano de esencias crudas de hojas de F. carica (Argelia) contra bacterias patógenas en alimentarios: Staphylococcus aureus, Pseudomonas aeruginosa, Klebsiella pneumonia y Escherichia coli. La actividad bactericida del extracto de hojas (Blanquette) sobre P. aeruginosa fue de 9.25, 8.75 y 8.0 mm a concentraciones de 100, 50 y 25 mg/ml, respectivamente; para E. coli fue de 6.5 mm, a 25 mg/ ml y la actividad antibacteriana resistente se mostraba a 6 mm.
MATERIALES Y MÉTODOS
Obtención de los extractos
Las hojas de Ficus carica fueron recolectadas en el área de Escobedo, Nuevo León, México. La planta se secó a la sombra a temperatura ambiente durante dos semanas. Posteriormente se trituraron y se colocaron en matraces Erlenmeyer, se les agregó metanol, se dejaron reposando alrededor de dos semanas con agitaciones diarias de 15 min con el fin de homogenizar la muestra. Posteriormente se pasaron al rotavapor.
Preparación de las soluciones a evaluar
La solución del extracto metanólico se preparó a 25 mg/ml en un vial, posteriormente se prepararon seis viales más a los que se les agregó 1,500 μl de agua estéril y se realizó una dilución seriada quedando 12.50, 6.25, 3.13, 1.56, 0.78 y 0.39 mg/ ml (Barry et al., 1999; Espinoza, 2020).
Actividad antibacteriana
Con el fin de evaluar el efecto antibacteriano se utilizaron cepas de referencia: Staphylococcus aureus (ATCC BAA-44), Pseudomonas aeruginosa (ATCC 27853), Escherichia coli (ATCC 25922), Klebsiella pneumoniae (ATCC 700603), Acinobacter baumannii (ATCC 15308) y Enterococcus faecalis (ATCC 29212). Cada una por separado se inoculó en un tubo con medio de cultivo Muller Hilton, éstos se incubaron durante 24 h a 36°C (Barry et al., 1999; Espinoza, 2020).
Luego se estandarizó el inóculo de cada cepa con la escala de 0.5 de McFarland (1 x 108 UFC/ml), se tomaron 100 μl del inóculo y se sembró en una placa de agar Müller Hinton mediante la técnica de extendido empleando un asa Digralsky, donde se dispusieron los pocillos alejados de los bordes y con espacio entre cada uno de los orificios, de esta manera se evita que los halos de inhibición se agrupen, se realizaron cinco pocillos sobre el agar, en el centro el control negativo (25 μl agua destilada estéril), los otros cuatro con 25 μl de las diluciones del extracto previamente preparado, las placas se incubaron a 36°C por 24 h y se midieron los halos de inhibición (Barry et al., 1999; Espinoza, 2020).
Concentración mínima inhibitoria
Se utilizó la difusión en placa por pocillo, pero empleando la concentración mínima obtenida en el procedimiento anterior preparando seis diluciones a una concentración de 12.50, 6.25, 3.13, 1.56, 0.78 y 0.39 mg/ml para observar la menor concentración, donde no haya desarrollo de halo de inhibición, considerando como resultado aquél que a la menor concentración no presente desarrollo.
Tamizaje fitoquímico
Se realizó con pruebas químicas según la metodología de Verde et al. (2016). Alcaloides: prueba de Dragendorff; flavonoides: prueba de Shinoda; sesquiterpenlactonas: prueba de Baljet; carbohidratos: prueba de Molish; esteroles y triterpenos: prueba de Liebermann-Buchard y oxhidrilos fenólicos (taninos vegetales): prueba de ![]() .
.
Análisis estadístico
Los valores se expresaron como media ± DE (n=3).
RESULTADOS
Actividad antibacteriana
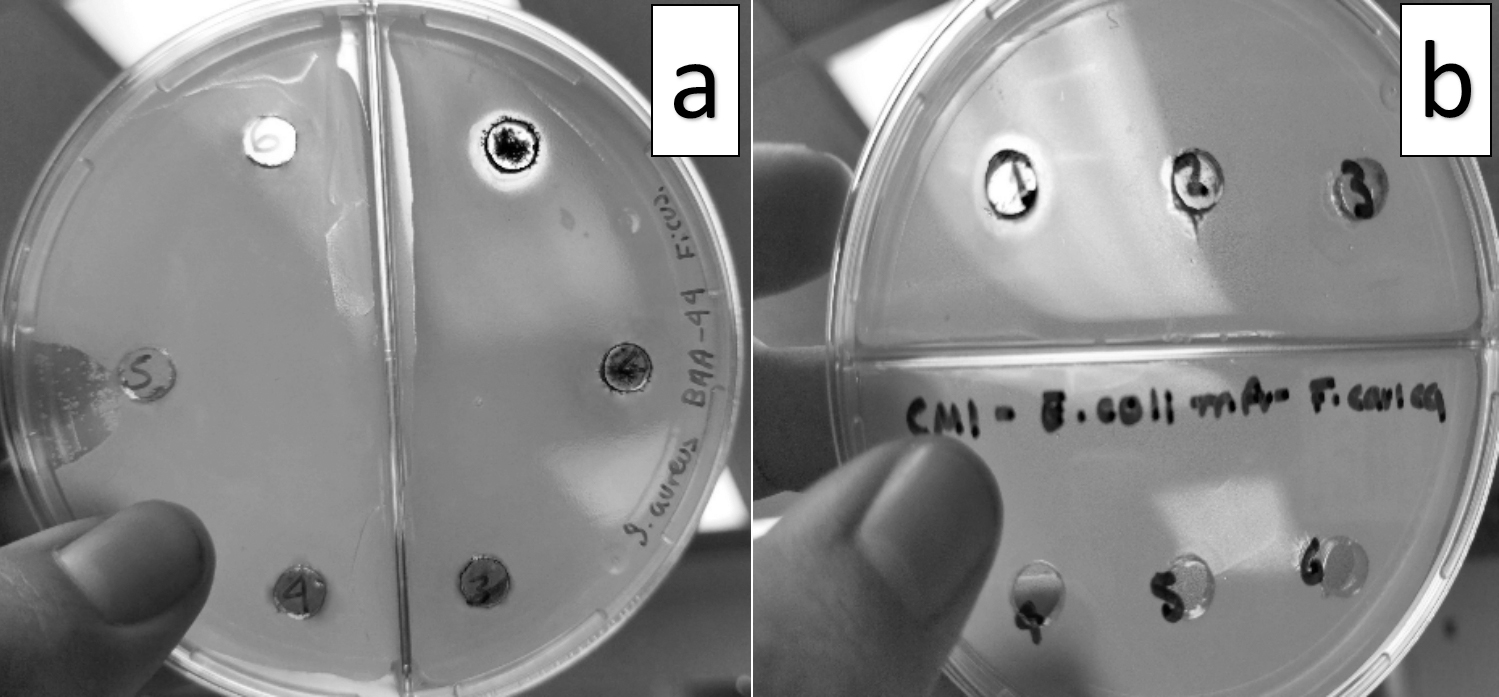
Primeramente se verificó la resistencia de las bacterias evaluadas ante distintos fármacos por medio de antibiogramas Multibac ID (amplicilina –10 meq–, cefalotina –30 meq–, cefotaxima –30 meq–, ciprofloxacina –5 meq–, clindamicina –30 meq–, dicloxacilina –1 meq–, eritomicina –15 meq–, gentamicina –10 meq–, penicilina –10 U– tetraciclina–30 meq–, sulfametoxasol/trimetroprim –25 meq–, bancomicina –30 meq–), posteriormente se determinó la actividad bactericida utilizando la técnica de difusión en placa por pocillo, observándose operación únicamente en la cepa de S. aureus BAA-44 y en la cepa de E. coli 25922 con el extracto de F. carica resuspendido en metanol a una concentración de 25 mg/ml. El pocillo en el que se mostró la inhibición en ambos casos fue en el marcado con el número 1 en las tres repeticiones realizadas, como se muestra la figura 1.
Concentración mínima inhibitoria-CMI
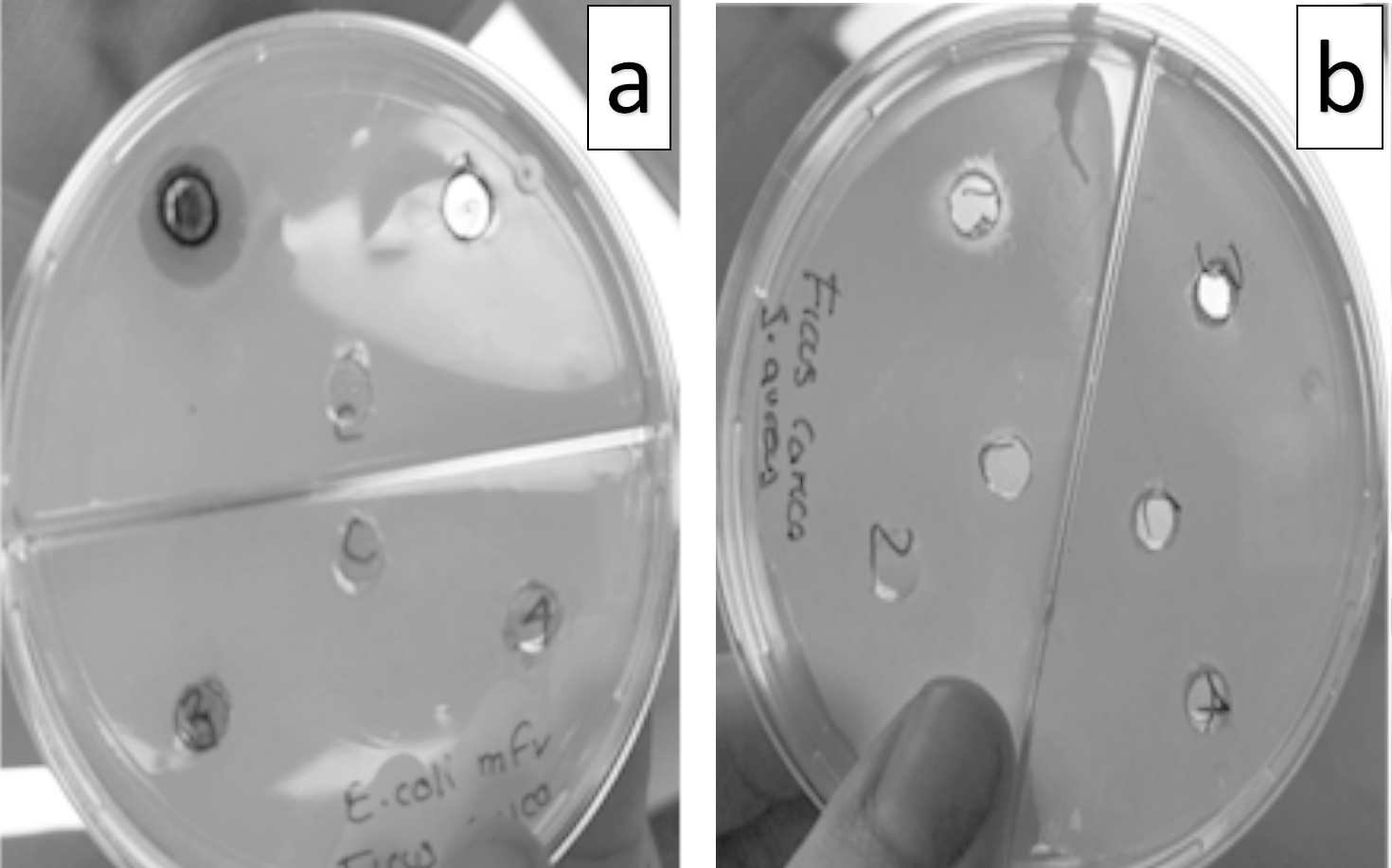
A partir de la difusión en placa por pocillo se tomó la concentración mínima encontrada, que en su caso correspondía a 1,000 μg/ml, y se realizaron seis diluciones (12.50, 6.25, 3.13, 1.56, 0.78 y 0.39 μg/ml), a partir de éstas se corroboró que efectivamente para el extracto de F. carica ante las cepas multifarmacorresistentes de E. coli y S. aureus la CMI es de 1,000 μg/ml (figura 2).
DISCUSIÓN
En esta investigación se llevó a cabo la evaluación de la actividad antimicrobiana del extracto metanólico de F. carica (higo), proveniente de Nuevo León, México. Se partió desde la elaboración de un antibiograma que fue de utilidad en el establecimiento de las resistencias adquiridas por las bacterias manipuladas. Posterior a esto se empleó la técnica de difusión en placa por pocillo para analizar la capacidad del extracto de la planta ante estas cepas bacterianas de interés, obteniendo así resultados favorables ante las cepas de S. aureus y E. coli, lo que coincide con lo encontrado por Belattar et al. (2021). Asimismo, Aref et al. (2010) muestran el potencial de F. carica ante cepas clínicas utilizando solventes como cloroformo y etanol; sin embargo, la actividad bactericida observada en las presentes investigaciones difiere del resultado obtenido, esto podría deberse a la multirresistencia a antibióticos que presentan las cepas evaluadas, así como el solvente utilizado.
Luego de la obtención de los halos de inhibición se procedió a buscar la cantidad mínima inhibitoria con el fin de crear una dosificación específica, en la cual el rango mínimo que se obtuvo fue de un aproximado de 1,000 μg/ml, esta cantidad se puede comparar con la obtenida en las investigaciones de Jeong et al. (2009): 250 mg/ml, observándose así una diferencia significativa, partiendo de que se obtuvieron los extractos metanólicos de la misma forma, por lo que consideramos que la diferencia obtenida puede deberse a la región y la época de recolección de la planta.
Al comparar los resultados con las dosis reportadas por Belattar et al. (2021), podemos observar que los rangos iniciales de actividad son de 100 mg/ml, siendo la dosificación mínima de 25 mg/ml, en la cual se obtienen las inhibiciones más pequeñas de 6 mm por pocillo, a diferencia de las encontradas en esta investigación, en las cuales se emplearon dosis menores a 25 mg/ ml con inhibiciones de 2-4 mm. Otro hecho a considerar de las diferencias en el resultado es la posible distribución de la cantidad de muestra depositada en los pocillos: 100 μl, siendo ésta la que mostraba mayor inhibición.
Por último se realizaron pruebas fitoquímicas de F. carica para observar qué componentes se encuentran presentes, se observó la presencia de metabolitos secundarios: esteroles, terpenos, flavonoides y carbohidratos, se ha reportado la aparición de terpenos, flavonoides, azúcares reductores y aminas en la investigación de Expósito et al. (2017), a éstos se les atribuyen varias funciones tanto medicinales como contra bacterias como S. aureus y E. coli.
CONCLUSION
El extracto métanolico de hojas de Ficus carica presenta actividad antimicrobiana sólo con dos de las seis cepas evaluadas: S. aureus BAA-44 y E. coli 25922, con una inhibición de 2 mm y 4 mm, respectivamente, a una concentración mínima inhibitoria de 1,000 μg/ml. En el tamizaje fitoquímico se determinó la presencia de esteroles, terpenos, flavonoides y carbohidratos, a los cuales se las puede atribuir la actividad biológica. La esencia de esta planta puede ser considerada en un futuro como alternativa en el tratamiento o coadyuvante contra enfermedades producidas por estos microrganismos.
* Universidad Autónoma de Nuevo León, San Nicolás de los Garza, México.
Contacto: catalina.rivasmr@uanl.edu.mx
REFERENCIAS
Aref, H.L., Salah, K.B., Chaumont, J.P., et al. (2010). In vitro antimicrobial activity of four Ficus carica latex fractions against resistant human pathogens (antimicrobial activity of Ficus carica latex), Pak. J. Pharm. Sci., 23(1), 53-58.
Abarca, E., Chávez, J. (2018). Actividad antiulcerosa del extracto etanólico de las hojas de Ficus carica L. (higo) en ratas, Universidad Norbert Wiener, http://repositorio.uwiener. edu.pe/handle/123456789/2201
Aguilar, A., Camacho, J.R., Chino, S., et al. (1994). Plantas medicinales del herbario, Instituto Mexicano del Seguro Social, México.
Argueta, V., Cano, A.L., Rodarte, M.E. (1994). Atlas de las plantas de la medicina tradicional mexicana, Instituto Nacional Indigenista, México.
Barry, A., Craig, W., Nadler, H., et al. (1999). Métodos para determinar la actividad bactericida de los agentes antimicrobianos; directriz aprobada, Instituto de Estándares Clínicos y de Laboratorio, 19(8), 1-29.
Blettar, H., Homour. S., Yahia, A. (2021). Cribado fitoquimico y evaluación de la actividad antimicrobiana del extracto metanólico de Ficus carica, Revista Mexicana de Ciencias Agrícolas, 12(1), https://doi.org/10.29312/remexca.v12i1.2435
Cruzado, M., Pastor, A., Castro, N., et al. (2013). Determinación de compuestos fenólicos y actividad antioxidante de extractos de alcachofa (Cynara scolymus L.), Rev Soc Quím Perú, 79(1), 57-63.
Espinoza, A.J. (2020). Actividad antimicrobiana de extractos acuosos de plantas sobre cepas multifarmacorresistentes (tesis de licenciatura), Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León.
Expósito, E., Díaz, A., Contreras, J., et al. (2017). Estudio cualitativo de sustancias químicas presentes en la planta Ficus carica L., Rev Electron Dr Zoilo Mar Vidaurreta, 42(3).
Jevons, M. P. (1961). “Celbenin” – resistant Staphylococci, British Medical Journal, 1(5219), 124-125.
Jeong M., Kim, H., Cha, J. (2009). Antimicrobial activity of methanol extract from Ficus carica leaves against oral bacteria, Journal of Bacteriology and Virology, 39(2), https://doi. org/10.4167/jbv.2009.39.2.97
Jain, A., Katewa, S.S., Galav, P.K., et al. (2005). Medicinal plant diversity of Sitamata wildlife sanctuary, Rajasthan, India, Journal of Ethnopharmacology, 102(2), 143-157.
Moreale, J., González, T., Giménez, A., et al. (2012). Evaluación de las interacciones farmacológicas de las hierbas medicinales en Uruguay, Biomedicina, 7(3), 6-21.
Porter, C.L. (1967). Taxonomy of flowering plants. N.H. Freeman and Company. New York. 73 p.
Prieto-González, S., Garrido-Garrido, G., González-Lavaut, J.A., et al. (2004). Actualidad de la medicina tradicional herbolaria. Revista CENIC: Ciencias Biológicas, 35(1), http://www. academia.edu/download/30280904/cb-2004-1-019-036_0.Pdf
Ssegawa, P., Kasenene, J.M. (2007). Medicinal plant diversity and uses in the Sango Bay area, Southern Uganda, Journal of Ethnopharmacology, 113(3), 521-540, https://doi.org/10.1016/j.jep.2007.07.014
Verde-Star, M.J., García-González, S., Rivas-Morales, C. (2016). Metodología científica para el estudio de plantas medicinales, en Rivas-Morales, C., Oranday Carenas, M.A., Verde-Star, M.J. (eds). Investigación en plantas de importancia médica, OmniaScience, Barcelona, España.
Recibido: 29/09/2022
Aceptado: 23/08/2023