Desarrollo biotecnológico para la producción de probióticos viables de chucrut a escala industrial
Claudio Guajardo-Barbosa ORCID: 0000-0003-4601-9404
Julio César Beltrán-Rocha ORCID: 0000-0002-8063-725X
Ulrico Javier López-Chuken ORCID: 0000-0002-2100-9982
Alma Delia Nava-Torres ORCID: 0000-0002-1714-8410
Myriam Elías-Santos ORCID: 0000-0002-4179-0251
Rahim Foroughbakhch-Pournavab ORCID: 0000-0002-9783-9464
RESUMEN
A nivel global, millones de personas padecen problemas gastrointestinales derivados de un desbalance en la microbiota intestinal ocasionada por la mala alimentación y el excesivo uso de antibióticos. Alternativamente, para disminuir esta problemática se generan alimentos funcionales a base de probióticos de origen lácteo; no obstante, éstos normalmente contienen trazas de metabolitos de origen animal, principalmente hormonas y medicamentos. Por este motivo existe, en años recientes, una marcada tendencia hacia la adopción de dietas vegetarianas que excluyen el consumo de probióticos lácteos. El presente avance biotecnológico contribuye en la solución de esta demanda al desarrollar, a nivel industrial, un producto liofilizado con microorganismos probióticos viables de origen vegetal.
Palabras clave: probióticos, chucrut, desarrollo biotecnológico, industria.
ABSTRACT
Globally, millions of people suffer from gastrointestinal problems derived from an imbalance in the intestinal microbiota caused by poor diet and excessive use of antibiotics. Alternatively, to reduce this problem, functional foods based on probiotics of dairy origin are being generated; however, these products usually contain metabolites traces of animal origin, mainly hormones and drugs. For this reason, there has been a marked trend in recent years towards the adoption of vegetarian diets that exclude the consumption of dairy probiotics. The present biotechnological advance contributes to the solution of this demand by developing at an industrial level a freeze-dried product with viable probiotic microorganisms of vegetable origin.
Keywords: probiotics, chucrut, biotechnology development, industry.
USO DE PRODUCTOS PROBIÓTICOS LÁCTEOS
Según la Organización de las Naciones Unidas para la Alimentación y la Agricultura, y la Organización Mundial de la Salud (FAO/ OMS, 2002), los probióticos se definen como microorganismos vivos que al ser ingeridos en cierta proporción brindan beneficios al hospedero. Asimismo, sus características dependen de las materias primas de las que se generan (tabla I). Las principales desventajas en los probióticos lácteos es que se derivan de la leche animal, la cual es considerada una de las mayores fuentes de consumo de estrógenos en la nutrición humana.
Está reportado que la leche del último periodo de la gestación y los primeros días de lactancia contiene cantidades importantes de estrógeno del tipo estrona E1 (Pierre et al., 2006). Las razones de este contenido derivan de que la dieta del ganado incluye fito- y micoestrógenos, uso de medicamentos y el estado hormonal de la vaca cuando es ordeñada (Socas et al., 2017). A todo lo anterior se le suma el uso ilegal de esteroides anabolizantes para el crecimiento del ganado, los cuales, en el metabolismo animal, atraviesan las glándulas mamarias y se transfieren a la leche (Noppe et al., 2008).
CHUCRUT COMO FUENTE DE PROBIÓTICOS DE ORIGEN VEGETAL
El chucrut es un alimento fermentado a base de col (Brassica oleracea L.), rico en probióticos. Se consume en Europa Oriental y Central desde hace más de diez siglos. Este alimento lo llegaron a emplear los antiguos romanos en algunos inviernos cuando las cosechas eran malas y escaseaba el alimento. Gracias a su fermentación mantenía sus propiedades nutricionales y organolépticas (Zabat et al., 2018).
Las bacterias ácido-lácticas fueron clasificadas inicialmente por Orla-Jensen en 1919. En la segunda mitad del siglo XX se dio a conocer que el chucrut contenía este tipo de bacterias, destacando la abundancia de Lactiplantibacillus spp. y Bifidobacterium spp. Los probióticos de origen vegetal han tomado gran importancia en el mercado de los alimentos funcionales, especialmente por sus beneficios a la salud, por ejemplo, dentro del género Lactobacillus se sabe que Lactiplantibacillus plantarum o, como se le denominaba anteriormente, Lactobacillus plantarum (Zheng et al. 2020), reduce los niveles de colesterol y triglicéridos en la sangre (Nguyen et al., 2007). El consumir chucrut tiene la capacidad de cambiar y mejorar la estabilidad del microbioma intestinal, también alivia y reduce los síntomas del síndrome del intestino irritable (IBS por sus siglas en inglés) generando una mejor calidad de vida (Nielsen et al., 2018; Zabat et al., 2018).
MATERIALES Y MÉTODOS
Este trabajo fue efectuado en el Instituto de Biotecnología de la Facultad de Ciencias Biológicas de la UANL y en la empresa Hervar Fam, S.A. de C.V. Antes de empezar el proceso de elaboración del chucrut, todo el material fue desinfectado de acuerdo a la norma MNX-F-605-NORMEX 2016. Se desecharon las primeras hojas que recubren la col y parte del tallo central, recuperando las tiernas. Para cortarlas se utilizó un equipo marca Torrey modelo PV-90, con el que se obtuvieron trozos de 0.5 cm de ancho a los que se les añadió sal de mar en grano (sin refinar y sin aditivos) en una proporción de 1.5% con respecto al peso de las hojas ralladas. Posteriormente, esta mezcla se prensó con el fin de liberar parte del agua contenida, este líquido permitió crear un ambiente anaerobio al sumergir los trozos, dando paso a la fermentación de los microorganismos probióticos a una temperatura de incubación de 20°C.
Al terminar el prensado, se transfirió el resultante a un fermentador de acero inoxidable Foshan DM-F700 de 200 kg de capacidad (figura 1). Con la finalidad de compactar la mezcla y evitar formación de burbujas de aire y espuma durante el proceso fermentativo, se cubrió la superficie con las hojas externas de la col y se aplicó presión sosteniéndola con placas de cerámica.
Al llegar a la fase de crecimiento máximo de la población de células probióticas, se drenó la masa sólida de col fermentada, se pesó y se separó en seis grupos, a tres se les añadió, como crioprotector, 5% de sacarosa (Beganovic et al, 2014) desinfectada con dióxido de etileno y tres a los que no se añadió crioprotector. Posteriormente se procedió a liofilizar en un equipo KEMOLO FD-50 con una capacidad de 50 Kg (figura 2). Las condiciones generales de liofilización fueron las siguientes: temperatura de sublimación de -37 a -10°C durante 24h y una temperatura final de 25°C.
Parámetros de crecimiento microbiano en col
Durante la fermentación se realizó la medición de ácido láctico según el método descrito en la NMX-F-420-1982. Para verificar las fases de la cinética del crecimiento microbiano se realizó el conteo en placa cada tres días usando el medio de cultivo de Man, Rogosa y Sharpe (MRS) específico para Lactobacillus spp.
Viabilidad de los microorganismos probióticos
Se procedió a determinar el porcentaje de viabilidad realizando el conteo de UFC/g en medio MRS antes y después del liofilizado. Se cuantificaron las UFC/g (expresados en peso seco) con la siguiente fórmula: % Viabilidad = 100 – ((A-B) ×100/A). Donde: A = Con- teo bacteriano (UFC/g) previo a la liofilización y B = Conteo bacteriano (UFC/g) posterior a la liofilización.
RESULTADOS Y DISCUSIÓN
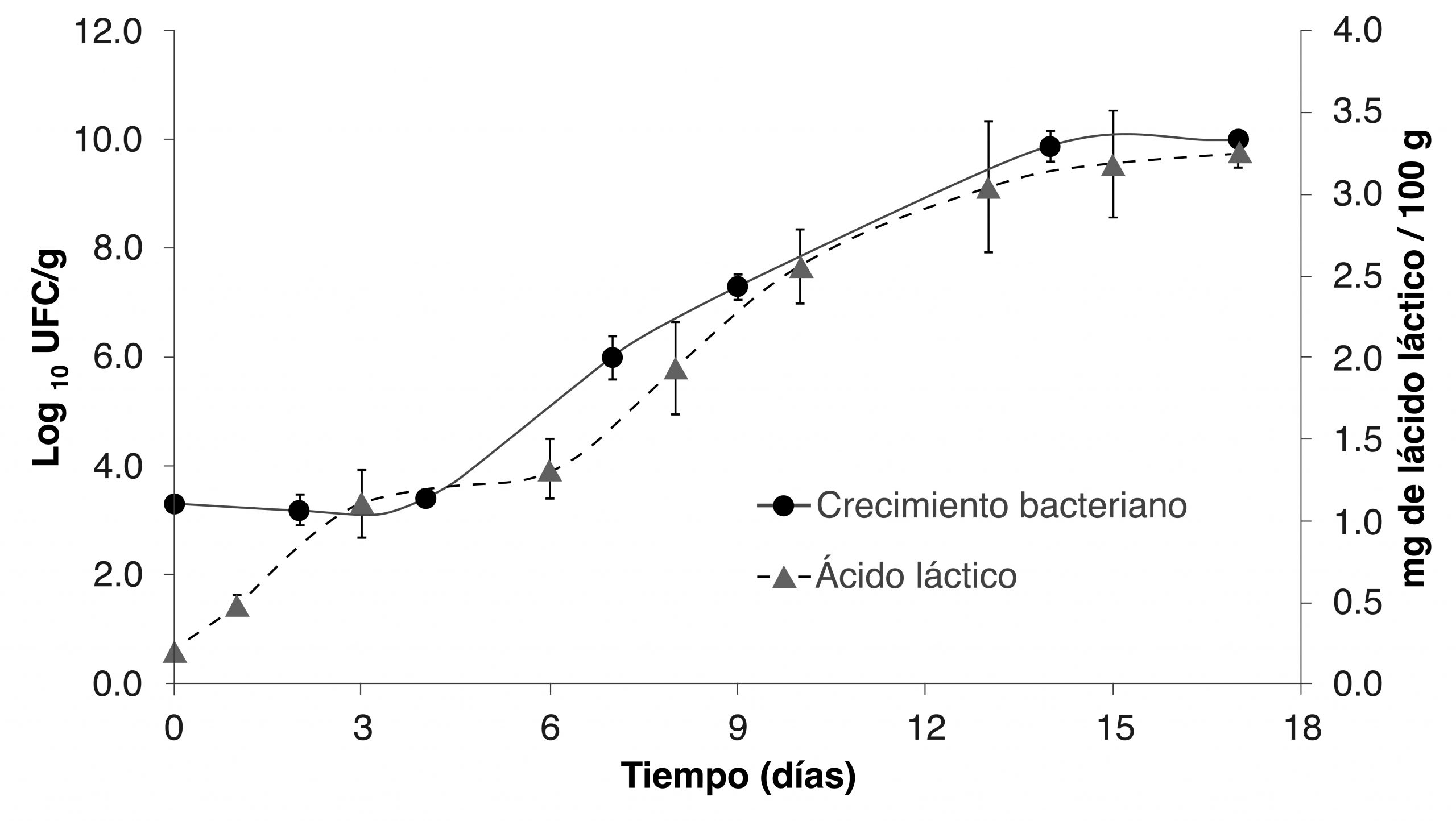
Durante la fermentación se originó una acelerada formación de ácido láctico con una reducción entre los días 3 y 6, para posteriormente aumentar el rendimiento hasta llegar a la fase estacionaria en el día 17 con una producción de 3.2 mg de ácido láctico por 100 g de cultivo (figura 3). En contraste a la generación de ácido láctico obtenido (3.25 mg/100g) a una temperatura de incubación de 20°C, un estudio realizado por Fadhil et al. (2019) obtuvo una concentración de 9.6 mg/100 g a 25°C, señalándose que dicha diferencia radicó en las distintas temperaturas de incubación utilizadas.
Cinética de crecimiento bacteriano
En el inicio de la fermentación (fase de adaptación) la concentración de Lactobacillus spp. autóctonos era de 1,000 UFC/g. Posteriormente, la fase exponencial se generó entre los días 5 a 15, presentándose la fase estacionaria al día 17 con un crecimiento de 10¹º UFC/g (figura 3), lo cual indica que la cepa predominante fue más resistente al ácido láctico. Cabe destacar que la concentración obtenida en el presente desarrollo (10¹º UFC/g) fue superior a lo reportado por Di Biase et al. (2022), quienes obtuvieron un crecimiento máximo de ![]() UFC/g.
UFC/g.
Viabilidad celular en el chucrut
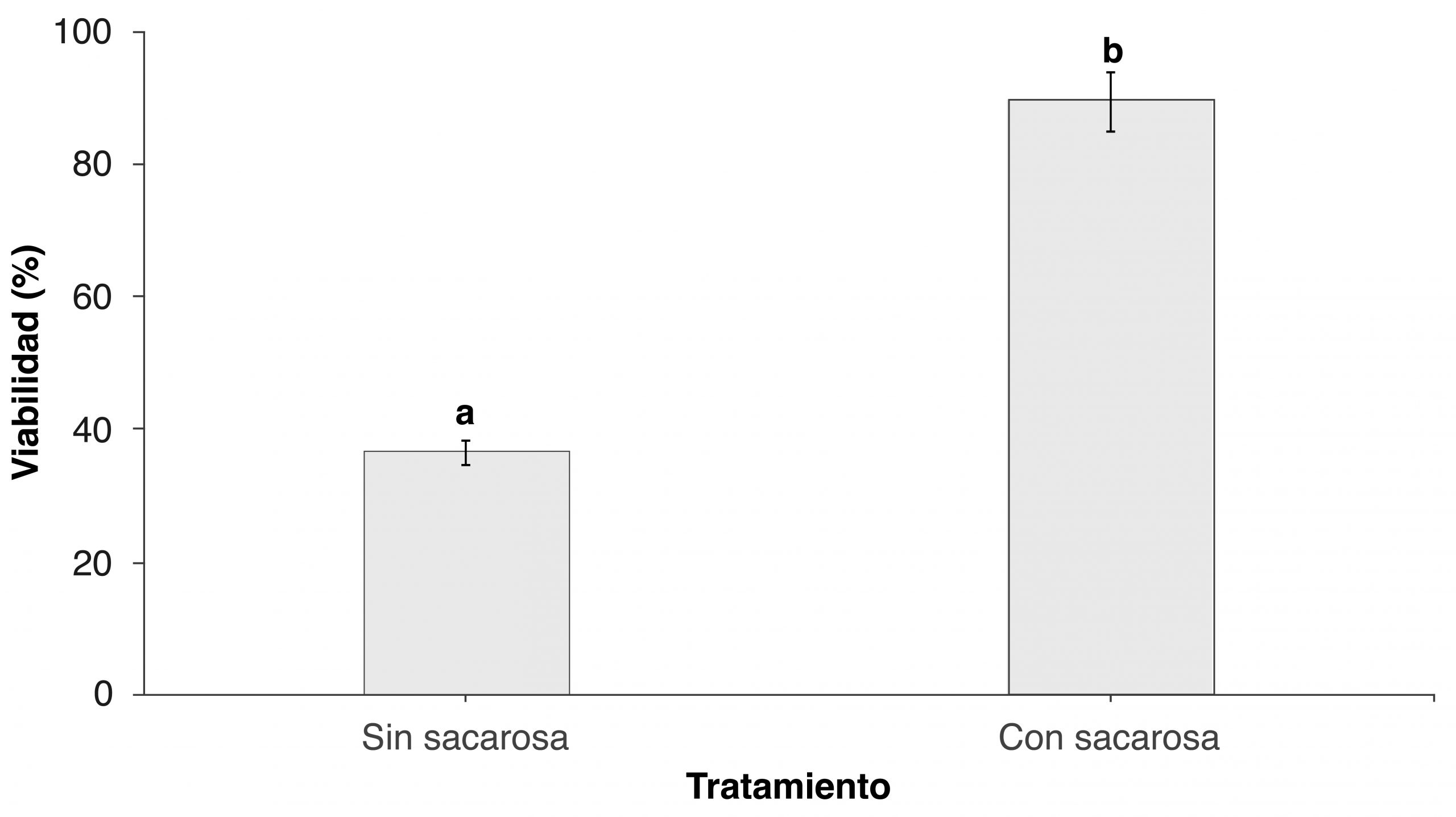
La col fermentada sin crioprotector presentó una viabilidad de Lactobacillus spp., después de la liofilización, de 36.5% ± 22.0; en cambio, el uso de sacarosa a 5% como crioprotector produjo una viabilidad de 89.3% ± 18.5 (figura 4). Este dato coincide con una investigación efectuada por Beganovic et al. (2014) en la que usó sacarosa a modo de crioprotector en distintas cepas de Lactobacillus y obtuvo una viabilidad que osciló entre 87.6 y 96%.
CONCLUSIONES
La mayor producción de ácido láctico y la finalización del proceso de fermentación en la elaboración de chucrut se definieron a los 17 días de cultivo, tiempo en el que se presentó la fase estacionaria. La sacarosa fue un aditivo de importancia debido a que al ser usado como crioprotector durante el liofilizado aumentó la viabilidad celular de los Lactobacillus spp. en el resultado final.
* Universidad Autónoma de Nuevo León, San Nicolás de los Garza, México.
** Hervar Fam., S.A. de C.V.
Contacto: rahim.foroughbakhchpr@uanl.edu.mx
REFERENCIAS
Agrawal, M.Y., Gaikwad, S., Srivastava, S., et al. (2022). Research Trend and Detailed Insights into the Molecular Mechanisms of Food Bioactive Compounds against Cancer: A Comprehensive Review with Special Emphasis on Probiotics, Cancers, 14 (22), 5482.
Beganović, J., Kos, B., Pavunc, A.L., et al. (2014). Traditionally produced sauerkraut as source of autochthonous functional starter cultures, Microbiological Research, 169, 7-8.
Di Biase, M., Le Marc, Y., Bavaro, A.R., et al. (2022). A Predictive Growth Model for Protech- nological and Probiotic Lacticaseibacillus paracasei Strains Fermenting White Cabbage, Frontiers in Microbiology, 13.
Fadhil, R., Hayati, R., y Agustina, R. (2019). Quality characteristics of sauerkraut from cabbage (Brassica oleracea) during fermentation and variation of salt concentration, International Journal of Scientific and Technology Research, 8 (10), 2906- 2909.
Organización de las Naciones Unidas para la Alimentación y la Agricultura, y Organización Mundial de la Salud. (2002). Guidelines for the Evaluation of Probiotics in Food. Joint FAO/WHO Working Group Report on Drafting Guidelines for the Evaluation of Probiotics in Food, London, Ontario, Canada, 11.
Nguyen, T.D.T., Kang, J.H., y Lee, M.S. (2007). Characterization of Lactobacillus plantarum PH04, a potential probiotic bacterium with cholesterol-lowering effects, International Journal of Food Microbiology, 113(3), 358-361.
Nielsen, E.S., Garnås, E., Jensen, K.J., et al. (2018). Lacto-fermented sauerkraut improves symptoms in IBS patients independent of product pasteurisation-a pilot study, Food and Function, 9 (10), 5323-5335.
Noppe, H., Le Bizec, B., Verheyden, K., et al. (2008). Novel analytical methods for the determination of steroid hormones in edible matrices, Analytica Chimica Acta, 611(1), 1-16.
Orla-Jensen, S. (1919). The lactic acid bacteria, Fred Hostand Son, 3(2).
Pierre-Nicolas, J., Pouliot, Y., Gauthier, S.F., et al. (2006). Hormones in bovine milk and milk products: A survey, International Dairy Journal, 16(11), 1408-1414.
Socas-Rodríguez, B., Lanková, D., Urbancová, K., et al. (2017). Multiclass analytical method for the determination of natural/synthetic steroid hormones, phytoestrogens, and mycoestrogens in milk and yogurt, Analytical and Bioanalytical Chemistry, 409(18), 4467-4477.
Vijaya Kumar, B., Vijayendra, S.V.N., y Reddy, O. V.S. (2015). Trends in dairy and non-dairy probiotic products-a review, Journal of Food Science and Technology, 52 (10), 6112-6124.
Zabat, M.A., Sano, W.H., Wurster, J.I., et al. (2018). Microbial community analysis of sauerkraut fermentation reveals a stable and rapidly established community, Foods, 7(5).
Zheng, J., Wittouck, S., Salvetti, E., et al. (2020). A taxonomic note on the genus Lactobacillus: Description of 23 novel genera, emended description of the genus Lactobacillus Beijerinck 1901, and union of Lactobacillaceae and Leuconostocaceae, International Journal of Systematic and Evolutionary Microbiology, 70(4), 2782-2858.
* Universidad Autónoma de Nuevo León, San Nicolás de los Garza, México.
** Hervar Fam., S.A. de C.V.
Contacto: rahim.foroughbakhchpr@uanl.edu.mx
Recibido: 30/09/2022
Aceptado: 23/11/2022