Amibas de vida libre: microorganismos patógenos potencialmente mortales para el humano
Paula Guzmán-Téllez * ORCID: 0000-0003-1608-7406
Nadia Flores-Huerta ** ORCID: 0000-0002-5780-1453
CIENCIA UANL / AÑO 27, No.124, marzo-abril 2024
DOI: https://doi.org/10.29105/cienciauanl27.124-9
AMIBAS DE VIDA LIBRE
Las amibas de vida libre (AVL) se definen como un grupo de organismos unicelulares que requieren oxígeno –protozoarios aeróbicos– y que están ampliamente distribuidos en la naturaleza: agua, aire y suelo de todos los continentes (Trabelsi et al., 2012). Éstas se encuentran clasificadas, según sus características, en los supergrupos: Amoebozoa: Acanthamoebidae (en el que se engloban la mayoría de las especies de AVL y que incluye a los géneros Acanthamoeba y Balamuthia), Excavata: Heterolobosia: Vahlkampfiidae (150 especies caracterizadas por su capacidad de enflagelación, siendo las más representativas las del género Naegleria), Amoebebozoa: Flabellinea: Thecamoebidae (que incluye a las amibas del género Sappinia), y los supergrupos Rhizaria (formado por cercozoos filosos y reticulosos) y Opisthokonta (que comprende a los géneros Nuclearia y Fonticula) (Trabelsi et al., 2012; Samba-Louaka et al., 2019). De acuerdo con datos obtenidos de estudios de secuenciación de la subunidad 16S del rRNA de estos tipos de AVL, se ha encontrado que las amibas Acanthamoeba y Balamuthia están estrechamente relacionadas filogenéticamente, a diferencia de Naegleria y Sappinia (Schuster y Visvesvara, 2004).
Los géneros y especies Acanthamoeba spp., Balamuthia mandrillaris, Naegleria fowleri y Sappinia pedata son de interés médico y veterinario por ser los causantes de enfermedades con una alta tasa de mortalidad; de manera que son considerados microorganismos con una pobre adaptación al parasitismo pues al infectar a un huésped consiguen llevarlo rápidamente a la muerte (desde días a pocos meses). Es importante mencionar que la diseminación y transmisión de las AVL de interés médico no depende de la intervención de un hospedero y son considerados microorganismos anfizoicos, es decir que aunque para cumplir su ciclo de vida no necesitan de otro organismo, cuentan con la capacidad de infestar a otras especies (Schuster y Visvesvara, 2004; Król-Turmińska y Olender, 2017).
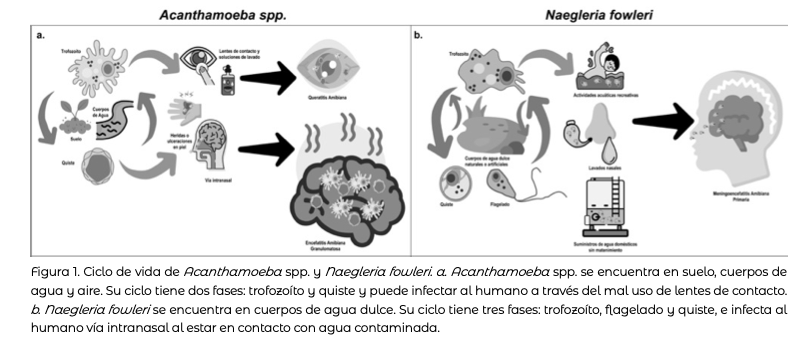
Este trabajo esta específicamente enfocado en los protozoarios patógenos Acanthamoeba spp. y Naegleria fowleri, los cuales pueden ocasionar trastornos graves o fatales en los ojos o en el sistema nervioso central (SNC) en humanos (figura 1). Acanthamoeba spp. causa encefalitis amibiana granulomatosa (EAG) y queratitis amibiana (QA) (figura 1a); Naegleria fowleri, meningoencefalitis amibiana primaria (MAP) (figura 1b). Son consideradas oportunistas en personas con debilitamiento del sistema inmunitario, aunque también afectan a individuos sanos. Los casos reportados se relacionan con exposición al agua salina, suelo o lentes de contacto contaminados (Acanthamoeba spp.), y cuerpos de agua dulce (Naegleria fowleri).
Es importante mencionar que algunas especies de Acanthamoeba spp. y Naegleria spp. son termotolerantes, es decir, soportan temperaturas de hasta 45°C. Esto no es determinante en su peligrosidad, pero favorece su presencia en el ambiente y el proceso de propagación en los meses con climas de templados a cálidos. También parecen mantener una relación endosimbiótica con algunas de las bacterias que consumen, al habitar dentro de ellas, las amibas sirven como “caballo de Troya” para otros microorganismos (Kofman y Guarner, 2022; Mungroo et al., 2022; Schuster y Visvesvara, 2004).
ACANTHAMOEBA SPP.
Acanthamoeba puede existir en dos formas: trofozoítos activos y quistes latentes (figura 1a). Los trofozoítos (15- 45 μm) son la fase metabólica y reproductivamente activa de la amiba. Tienen una forma irregular, dentro del núcleo presentan un gran nucléolo central característico, cuentan con pseudópodos (prolongación del citoplasma de algunos organismos unicelulares) que le permiten moverse; mientras que los acantópodos (forma de espinas) son responsables de la adhesión a superficies inertes-biológicas. La trasformación de trofozoítos a quistes (10-25 μm) se da bajo condiciones estresantes, como falta de alimento (inanición) o agua (desecación).
Los quistes son estructuras redondas rodeadas por una cápsula de celulosa (endoquiste interno y un ectoquiste externo) y representan la forma de resistencia e inmóvil de este microorganismo. Antes de las técnicas basadas en el material genético de las amibas, hasta principios de la década de 2000, los estudios basados en las diferencias de las formas de los trofozoítos o quistes permitieron la descripción de más de 30 especies en este género (Kong et al., 2000; Fuerst y Booton, 2020; Qvarnstrom et al., 2013).
Actualmente, la secuenciación del ADN del gen 18S rRNA de aislados de Acanthamoeba se convirtió en el estándar de oro para descifrar el código genético de cualquier cepa que hubiera sido aislada de fuentes clínicas o ambientales. Según estudios genómicos, el género Acanthamoeba es diverso, consta de al menos 22 genotipos (T1-T22), el T4 es el más encontrado en casos de infección (Mungroo et al., 2022).
De las especies identificadas y aisladas de infecciones en cerebro y ojos humanos se encuentran: A. castellanii, A. healyi, A culbertsoni, A. polyphaga y A. triangularis (González-Robles et al., 2017; Omaña-Molina et al., 2019; Rayamajhee et al., 2022; Damhorst et al., 2022). Puede contaminar el sistema nervioso, causando encefalitis (EAG), y a los ojos, produciendo queratitis (QA) (figura 1a).
Encefalitis amebiana granulomatosa (EAG)
Epidemiología: es difícil encontrar datos definitivos de ésta, debido a la falta de un seguimiento adecuado, deficiencias en sistemas de atención médica, experiencia diagnóstica limitada, etcétera. Se estima que la enfermedad ocurre principalmente en hombres de entre 20-40 años, con tasas de supervivencia de 2 a 3% (es decir, alta mortalidad). A nivel mundial, hasta 2019 se reportaron poco más de 200 casos. En México, recientemente se han presentado algunos, además, grupos de investigación muestrean zonas potencialmente contaminadas para la identificación de este microorganismo y la obtención de datos ecoepidemiológicos (Aparicio et al., 2021; Bonilla-Lemus et al., 2010; Mungroo et al., 2022; Ortíz Ortega et al., 2012; Rodríguez-Pérez et al., 2017).
Clínica: debido a la similitud de síntomas con las infecciones causadas por otros microorganismos patógenos del SNC (hongos, virus y bacterias), el diagnóstico es confuso y está vinculado a la experiencia y conocimiento del médico y el analista de laboratorio. Las principales señales incluyen fiebre, dolor de cabeza, hemiparesia, náuseas, convulsiones, parálisis de nervios craneales, tortícolis, cambios de personalidad, disminución del nivel de conciencia y coma (Kofman y Guarner, 2022; Mungroo et al., 2022).
Diagnóstico: se basa en la detección de lesiones cerebrales a través de resonancia magnética nuclear o tomografía computarizada, detección de pleocitosis con aumento de leucocitos polimorfonucleares y proteínas en líquido cefalorraquídeo (LCR), ensayos de inmunofluorescencia indirecta y tinciones (Wright, Giemsa y tricrómica). En su confirmación se observan, por microscopía óptica o confocal, los materiales de desbridamiento, biopsias y frotis de córnea, soluciones para lentes de contacto, lentes de contacto, LCR o biopsia cerebral. Además de técnicas moleculares, por ejemplo, la reacción en cadena de la polimerasa (PCR) y sus variantes, con una sensibilidad de hasta 94% (Kofman y Guarner, 2022; Mungroo et al., 2022). Es preciso mencionar que una exhaustiva entrevista médica (anamnesis) efectuada por el profesional médico –orienta el diagnóstico oportuno. La información recopilada al paciente o sus familiares es crucial para sopechar de este tipo de infección por AVL.
Tratamiento: las pocas recuperaciones han sido tratadas con un esquema que comprende una gran variedad de fármacos, por ejemplo, isetionato de pentamidina, cotrimoxazol, azitromicina, metronidazol, flucitosina, fluconazol, ketoconazol, clotrimazol, miconazol, voriconazol, amfotericina B, trimetoprima-sulfametoxazol y miltefosina durante 1-6 meses. Recientemente se ha demostrado que la eficacia de los compuestos contra Acanthamoeba spp. se mejoraría mediante la síntesis de nanopartículas de plata u oro conjugadas con fármacos (Kofman y Guarner, 2022; Mungroo et al., 2022).
Prevención: la mortalidad se acerca a 100%, con muy pocos sobrevivientes, por lo que se sugiere evitar aguas o ambientes terrestres potencialmente contaminados. Los pocos pacientes recuperados registrados se han asociado con un dictamen temprano y el inicio de la terapia combinada (Kofman y Guarner, 2022; Mungroo et al., 2022).
Vacunas: a la fecha no hay investigaciones enfocadas en estrategias de inmunización.
Queratitis amibiana (QA)
Epidemiología: es una afección rara y con datos epidemiológicos heterogéneos. Estudios demuestran tasas de incidencia variable en todo el mundo. Con inferencias de hasta 3.3 por 1,000 usuarios de lentes de contacto en Hong Kong, 0.5 por 1,000 en Holanda, 0.1 por 1,000 en Estados Unidos, 14.9 por 1,000 en Escocia y hasta 1.9 por 1,000 en Inglaterra. En México tampoco hay datos definitivos, sólo dos casos han sido recientemente reportados (Mungroo et al., 2022; Niederkorn, 2021; Omaña-Molina et al., 2019; Villa-Ramírez et al., 2015).
Clínica: incluye dolor ocular, enrojecimiento, visión borrosa, fotofobia, lagrimeo y sensación de cuerpo extraño. En el examen oftalmológico se observan signos como infiltrados epiteliales, estromales y anulares, y perineuritis. Las complicaciones varían en severidad: glaucoma secundario, atrofia del iris, cataratas y en un extremo la pérdida de la visión en el ojo. Raramente ocurre escleritis, uveítis anterior, coriorretinitis y vasculitis retiniana (Szentmary et al., 2019). Los factores de riesgo asociados con malos resultados incluyen un diagnóstico tardío o erróneo, un malestar no relacionado con la natación, mala agudeza visual preliminar, uso de lentes de contacto, presencia de un defecto epitelial y tratamiento inicial con corticosteroides (Niederkorn, 2021; Szentmary et al., 2019).
Diagnóstico: establecerlo es difícil, pues frecuentemente se confunde con infecciones por adenovirus y virus herpes simplex. La principal herramienta con la que se cuenta es el examen oftalmológico; además, cuando se utiliza microscopía confocal in vivo se puede apreciar la presencia de quistes que aparecen a modo de estructuras esféricas hiperreflectantes, mismas que manifiestan un nucléolo grande y denso característico de las AVL. La PCR y el examen histopatológico son otros métodos empleados (Szentmary et al., 2019).
Tratamiento: implica una combinación de agentes tópicos antimicrobianos que ataquen las formas de trofozoíto y quiste. Las biguanidas (polihexametileno biguanidan o clorhexidina) se consideran los agentes de primera línea más efectivos. También se prescriben diamidinas aromáticas: propamidina o neomicina. Por lo general, el tratamiento se administra durante seis a 12 meses (Szentmary et al., 2019).
Prevención: con los lentes de contacto: limpieza utilizando soluciones estériles, preferir desechables, llevar a cabo una exhaustiva rutina de lavado de manos previo a la colocación y retiro, evitar el uso por días completos sin retirarlos, no dormir con ellos puestos y realizar un recambio constante (no más de tres meses) (Anger y Lally, 2008).
Vacunas: se han desarrollado estrategias de inmunización en modelos animales (cerdo y hámster); sin embargo, no muestran evidencia de que se prevenga o mitigue la infección corneal (Niederkorn, 2021, Szentmary et al., 2019). Un único estudio ha demostrado que la inmunización con un antígeno amibiano promueve la elevación de la concentración de anticuerpos IgA en las lágrimas de los animales, lo que podría contribuir a reducir la severidad (Garate et al., 2006).
NAEGLERIA FOWLERI
Naegleria fowleri es un ameboflagelado del género Naegleria considerada la única de 47 especies que es peligrosa para el humano. Es resistente a altas temperaturas y se encuentra en aguas dulces templadas (lagos, ríos, albercas, termales, depósitos domésticos). Su ciclo de vida depende de las condiciones ambientales y nutricionales, consta de: trofozoíto (15 a 25 μm) es el estadio activo y proliferativo, cuenta con forma ameboide, un núcleo con un gran nucléolo electrodenso característico, y un metabolismo primordialmente aeróbico. Es en esta fase que la amiba es invasiva e infectiva. En condiciones de falta de nutrientes se transforma a flagelado piriforme (10 a 16 μm), el cual cuenta con al menos dos flagelos, es transitorio, no infectivo y no proliferativo. El quiste (fase de resistencia) aparece en condiciones de disminución de nutrientes o estrés. Es esférico (10 a 20 μm) y se sugiere que su pared es de celulosa y quitina. Recientemente se propuso que pudiera ser infectivo (Marciano-Cabral, 1988; Maciver et al., 2020) (figura 1b).
Meningoencefalitis amibiana primaria (MAP)
Es un padecimiento que genera inflamación en el cerebro y meninges, lo que podría conducir a la muerte de la persona entre 5-8 días postinfección. Se adquiere cuando los trofozoítos de N. fowleri son salpicados a la nariz o inhalados al realizar actividades en cuerpos de agua dulce, al practicar lavados nasales con soluciones contaminadas con la amiba, o debido a la mala calidad del suministro doméstico (Jahangeer et al., 2020) (figura 1b).
Epidemiología: se presenta con mayor frecuencia en verano, afecta principalmente a masculinos, infantes y jóvenes inmunológicamente sanos, y tiene una tasa de mortalidad de 95 a 97%. Los registros se consideran subestimados debido a la falta de pericia en el diagnóstico o por su atribución a meningitis de origen desconocido. Se han reportado 440 casos mundialmente, siendo Estados Unidos el país más afectado (Jahangeer et al., 2020). En México se han documentado y confirmado nueve, los últimos cinco ocurrieron en 2020 en el estado de Guerrero (tres hombres y dos mujeres) (DGE, 2021). De acuerdo con el Reporte de Vigilancia Epidemiológica del Sinave/DGE/Salud, para la semana 32 de 2023 (hasta el 12 de agosto), se produjo un probable caso MAP en una mujer en la Ciudad de México (DGE, 2023).
Clínica: la sintomatología es común a otros cuadros de meningitis (virales o bacterianas). Aparece desde las 24 horas y hasta cinco días después del contacto con la amiba, consiste en dolor intenso de cabeza que no responde a analgésicos, fiebre superior a 38°C, alteraciones del gusto, olfato y visión, náuseas, vómito en proyectil, anormalidades del comportamiento, anorexia, confusión, irritabilidad y somnolencia. En cuadros avanzados: rigidez de nuca y cuello, fotofobia, convulsiones y coma. La muerte del paciente ocurre aproximadamente en una semana (Heggie, 2010).
Diagnóstico: un historial médico que refiera una exposición directa a cuerpos de agua dulce templados y alteraciones del tracto respiratorio superior (rinitis o alergias) es sugestivo de la enfermedad. Un dictamen certero y expedito es crucial. Se realiza a partir de una muestra de LCR sometido a un examen físico, bioquímico y una observación al microscopio utilizando tinciones como Giemsa o Wright. Una prueba importante es la de enflagelación, la cual se realiza colocando el sedimento del LCR en una solución salina isotónica por 2 h a 37°C; si se observan al microscopio flagelados, se confirma. Además, se realizan ensayos de ELISA, Western blot, PCR, tomografía computarizada y resonancia magnética (da Rocha-Azevedo et al., 2009; Król-Turmińska y Olender, 2017). Es importante mencionar que los trofozoítos de N. fowleri pueden ser confundidos con leucocitos en las muestras de LCR, por lo que el diagnóstico de MAP sería erróneo o retrasado, llevando a que la mayoría de los casos (63.7%) sean confirmados a través de biopsias posmortem empleando técnicas de tinción con hematoxilina-eosina o por establecimiento de cultivos amibianos (Schuster y Visvesvara, 2004; Zhang y Cheng, 2021).
Tratamiento: no se cuenta con un medicamento específico. La amfotericina B es la única que ha demostrado eficacia clínica por sí sola (tasa de recuperación: 2 a 5%), o bien en combinación con antibióticos, otros antifúngicos, antiinflamatorios y medidas no farmacológicas: drenaje del LCR, hiperventilación moderada e inducción de hipotermia (Grace et al., 2015).
Prevención: limitar la cantidad de agua en contacto directo con la nariz: uso de pinzas nasales en actividades acuáticas, manejo de soluciones estériles para lavado nasal, nadar en albercas adecuadamente cloradas y procurar un mantenimiento regular a los depósitos domésticos (CDC, 2020).
Vacunas: actualmente se encuentran en investigación. Utilizando el modelo murino y administrando vía intranasal lisados de N. fowleri se demostró una respuesta inmune tipo Th2 (Carrasco-Yépez et al., 2014). En otro enfoque, la inmunización con la proteína recombinante Nfa1 de N. fowleri demostró un incremento en las respuestas tipo Th1 y Th2 (Lee et al., 2015). Los resultados de estas aproximaciones sugieren que podrían ser eficientes en la protección contra la infección por dicha amiba.
PERSPECTIVAS EN AVL
La búsqueda de los mecanismos de patogenicidad y factores de virulencia de estos microorganismos son áreas de gran interés. Es importante la identificación de fármacos específicos contra las infecciones causadas por AVL para realizar un manejo y tratamiento adecuado de los pacientes, así como el desarrollo de vacunas enfocadas en la prevención de las enfermedades causadas por estos patógenos.
CONCLUSIONES
La divulgación del conocimiento sobre la importancia del estudio de las AVL es crucial, aun cuando hay pocos casos reportados a nivel mundial y nacional, la mortalidad asociada a ellos es muy alta, lo que lo convierte en un tema relevante de estudio.
* Instituto Politécnico Nacional, Unidad Zacatenco, Ciudad de México, México.
** Asociación para Evitar la Ceguera en México, I. A. P., Ciudad de México, México. Contacto: pauguzte@gmail.com, fnadia3121@gmail.com
REFERENCIAS
Anger, C. y Lally, J.M. (2008). Acanthamoeba: a review of its potential to cause keratitis, current lens care solution disinfection standards y methodologies, y strategies to reduce patient risk, Eye Contact Lens, 34, 247-53.
Aparicio, D.V., Bejarano, J.I.C., De los Santos, A.M., et al. (2021). Case Report: Granulomatous Amebic Encephalitis due to Acanthamoeba spp. in an Immunocompetent Pediatric Patient, Am J Trop Med Hyg, 105, 167-170.
Bonilla-Lemus, P., Ramírez-Bautista, G. A., Zamora-Muñoz, C., et al. (2010). Acanthamoeba spp. in domestic tap water in houses of contact lens wearers in the metropolitan area of México City, Exp Parasitol, 126, 54-8.
Carrasco-Yépez, M., Campos-Rodríguez, R., López-Reyes, I., et al. (2014). Intranasal coadministration of Cholera toxin with amoeba lysates modulates the secretion of IgA y IgG antibodies, production of cytokines y expression of pIgR in the nasal cavity of mice in the model of Naegleria fowleri meningoencephalitis, Exp Parasitol, 145 (Suppl.), S84-92.
Centro para el Control y Prevención de Enfermedades. (2020). Naegleria. Hoja Informativa, Estados Unidos de América: Departamento de Salud y Servios Humanos. Gobierno USA.gov, https://www.cdc.gov/parasites/naegleria/esp/general-information.html
Da Rocha-Azevedo, B., Tanowitz, H.B. y Marciano-Cabral, F. (2009). Diagnosis of infections caused by pathogenic free-living amoebae, Interdiscip Perspect Infect Dis, 2009, 251406.
Damhorst, G.L., Watts, A., Hernández-Romieu, A., et al. (2022). Acanthamoeba castellanii encephalitis in a patient with AIDS: a case report y literature review, Lancet Infect Dis, 22, e59-e65.
Dirección General de Epidemiología. (2021). Boletín epidemiológico del Sistema Nacional de Vigilancia Epidemiológica. Sistema único de información, México: Dirección General de Epidemiología, https://www.gob.mx/cms/uploads/attachment/file/614743/sem53.pdf
Dirección General de Epidemiología. (2023). Boletín epidemiológico del Sistema Nacional de Vigilancia Epidemiológica. Sistema único de información, México: Dirección General de Epidemiología, https://www.gob.mx/cms/uploads/attachment/file/851030/sem32.pdf
Fuerst, P. A. y Booton, G.C. (2020). Species, Sequence Types y Alleles: Dissecting Genetic Variation in Acanthamoeba, Pathogens, 9.
Garate, M., Alizadeh, H., Neelam, S., et al. (2006). Oral immunization with Acanthamoeba castellanii mannose-binding protein ameliorates amoebic keratitis, Infect Immun, 74, 7032-4.
González-Robles, A., Omaña-Molina, M., Salazar-Villatoro, L., et al. (2017). Acanthamoeba culbertsoni isolated from a clinical case with intraocular dissemination: Structure y in vitro analysis of the interaction with hamster cornea y MDCK epithelial cell monolayers, Exp Parasitol, 183, 245-253.
Grace, E., Asbill, S. y Virga, K. (2015). Naegleria fowleri: pathogenesis, diagnosis, y treatment options, Antimicrob Agents Chemother, 59, 6677-81.
Heggie, T.W. (2010). Swimming with death: Naegleria fowleri infections in recreational waters, Travel Med Infect Dis, 8, 201-6.
Jahangeer, M., Mahmood, Z., Munir, N., et al. (2020). Naegleria fowleri: Sources of infection, pathophysiology, diagnosis, y management; a review, Clin Exp Pharmacol Physiol, 47, 199-212.
Kofman, A. y Guarner, J. (2022). Infections Caused by Free-Living Amoebae, J Clin Microbiol, 60, e0022821.
Kong, H.H., Kim, T.H. y Chung, D.I. (2000). Purification y characterization of a secretory serine proteinase of Acanthamoeba healyi isolated from GAE, J Parasitol, 86, 12-7.
Król-Turmińska, K. y Olender, A. (2017). Human infections caused by free-living amoebae, Ann Agric Environ Med, 24, 254-260.
Lee, J., Yoo, J.K., Sohn, H.J., et al. (2015). Protective immunity against Naegleria fowleri infection on mice immunized with the rNfa1 protein using mucosal adjuvants, Parasitol Res, 114, 1377-85.
Maciver, S.K., Piñero, J.E. y Lorenzo-Morales, J. (2020). Is Naegleria fowleri an Emerging Parasite?, Trends Parasitol, 36, 19-28.
Marciano-Cabral, F. (1988). Biology of Naegleria spp., Microbiol Rev, 52, 114-33.
Mungroo, M.R., Khan, N.A., Maciver, S., et al. (2022). Opportunistic free-living amoebal pathogens, Pathog Glob Health, 116, 70-84.
Niederkorn, J.Y. (2021). The biology of Acanthamoeba keratitis, Exp Eye Res, 202, 108365.
Omaña-Molina, M., Vanzzini-Zago, V., Hernández-Martínez, et al. (2019). Acanthamoeba keratitis in Mexico: Report of a clinical case y importance of sensitivity assays for a better outcome, Exp Parasitol, 196, 22-27.
Ortíz Ortega, R., Bonilla Lemus, P., Monsalvo Reyes, A., et al. (2012). Detección de amibas patógenas del género Acanthamoeba por PCR en cuerpos de agua recreativos en el Estado de San Luis Potosí, México, BIOCYT Biología Ciencia y Tecnología, 5.
Qvarnstrom, Y., Nerad, T.A. y Visvesvara, G.S. (2013). Characterization of a new pathogenic Acanthamoeba Species, A. byersi n. sp., isolated from a human with fatal amoebic encephalitis, J Eukaryot Microbiol, 60, 626-33.
Rayamajhee, B., Sharma, S., Willcox, M., et al. (2022). Assessment of genotypes, endosymbionts y clinical characteristics of Acanthamoeba recovered from ocular infection, BMC Infect Dis, 22, 757.
Rodríguez-Pérez, E.G., Escandón-Vargas, K. y Ancer, A. (2017). Granulomatous amebic encephalitis caused by Acanthamoeba sp. in an immunocompetent Mexican adult, Rev Soc Bras Med Trop, 50, 432.
Samba-Louaka, A., Delafont, V., Rodier, et al. (2019). Free-living amoebae y squatters in the wild: ecological y molecular features, FEMS Microbiol Rev, 43, 415-434.
Schuster, F.L. y Visvesvara, G.S. (2004). Free-living amoebae as opportunistic y non-opportunistic pathogens of humans y animals, Int J Parasitol, 34, 1001-27.
Szentmary, N., Daas, L., Shi, L., et al. (2019). Acanthamoeba keratitis-Clinical signs, differential diagnosis y treatment, J Curr Ophthalmol, 31, 16-23.
Trabelsi, H., Dendana, F., Sellami, A., et al. (2012). Pathogenic free-living amoebae: epidemiology y clinical review, Pathol Biol (Paris), 60, 399-405.
Villa-Ramírez, S. A., Vanzzini-Rosano, V., Hernández-Martínez, et al. (2015). Acanthamoeba griffini aislada de un caso de queratitis amibiana en México, XII Encuentro Participación de la Mujer en la Ciencia, https://congresos.cio.mx/memorias_congreso_mujer/archivos/extensos/ sesion3/S3-MCS22.pdf
Zhang, H. y Cheng, X. (2021). Various brain-eating amoebae: the protozoa, the pathogenesis, y the disease, Front Med, 15, 842-866.
Recibido: 03/12/2022.
Aceptado: 29/08/2023.