Evaluación espectroscópica de la interacción entre la avenantramida-C presente en la avena y la albúmina sérica bovina
Azucena González-Horta* ORCID: 0000-0002-8222-2111
María Guadalupe Quiroz Vázquez* ORCID: 0000-0002-8036-7739
CIENCIA UANL / AÑO 27, No.124, marzo-abril 2024
DOI: https://doi.org/10.29105/cienciauanl27.124-4
RESUMEN
Las avenantramidas son compuestos únicos presentes en la avena, han demostrado tener características antioxidantes, antiinflamatorias, anticancerígenas y neuroprotectoras. Sus propiedades benéficas se atribuyen a la interacción con biomoléculas presentes en el organismo como lípidos y proteínas por lo que, el objetivo de este trabajo fue evaluar la interacción entre el principal compuesto fenólico en la avena, la avenantramida-C (Avn-C) y la albúmina sérica bovina (BSA) mediante espectroscopía de fluorescencia. Los resultados demuestran una disminución gradual en la intensidad de fluorescencia de la BSA conforme aumenta la concentración de Avn-C indicando la interacción y formación de un complejo Avn-C/BSA
Palabras clave: Avenantramida-C, BSA, apagamiento de fluorescencia, polifenol, triptófano, avena.
ABSTRACT
Avenanthramides have been highlighted as unique bioactive compounds present in oats with antioxidant, anti-inflammatory, anticancer and neuroprotective activity features. These beneficial properties are ascribed to the interaction with other biomolecules present in the body such as lipids and proteins, so the objective of this work was to evaluate the interaction between the main phenolic compound in oats, the avenanthramide-C (Avn-C), and bovine serum albumin (BSA) by fluorescence spectroscopy. The results shows a gradual decrease in the protein’s tryptophan fluorescence emission intensity with the addition of Avn-C indicating interaction between molecules and confirming the formation of a complex between Avn-C and BSA.
Key words: Avenanthramide-C, BSA, fluorescence quenching, polyphenol, tryptophan, oat.
Las avenantramidas (Avns) son fitoquímicos encontrados exclusivamente en la avena en intervalos de 5-120 mg/kg en las hojas y 2-289 mg/kg en el grano. La avenantramida-C (Avn-C) es la que se encuentra en mayor cantidad, de 36.5 a 61.77 mg/ kg masa fresca (Wu et al., 2018). El estudio de las Avns se ha intensificado recientemente debido a los efectos benéficos en la salud que estos compuestos otorgan, entre los que destacan: capacidad antioxidante (Bratt et al., 2003), antiinflamatoria (Wang et al., 2020), antiaterogénica (Sang et al., 2017), anticancerígena (Rasane et al., 2013) y antiamiloide (Quiroz-Vázquez, 2020). Esta última propone a la Avn-C como una molécula con potencial terapéutico en el tratamiento de enfermedades como el Alzheimer o el Parkinson, cuyo origen es la agregación proteica de tipo amiloide.
La conexión de algunos polifenoles de origen vegetal con la albúmina sérica bovina se ha analizado extensivamente, ya que las seroalbúminas desempeñan un papel primordial en el transporte, disposición y eficacia de los polifenoles en células y tejidos (Bose, 2016; Bourassa et al., 2010). Sin embargo, a la fecha no se han encontrado reportes que demuestren la interacción de la BSA con las fenolamidas, por lo que el objetivo de este trabajo fue evaluar la correlación de la avenantramida C, principal fenolamida en la avena, con la BSA mediante espectroscopía de fluorescencia.
METODOLOGÍA
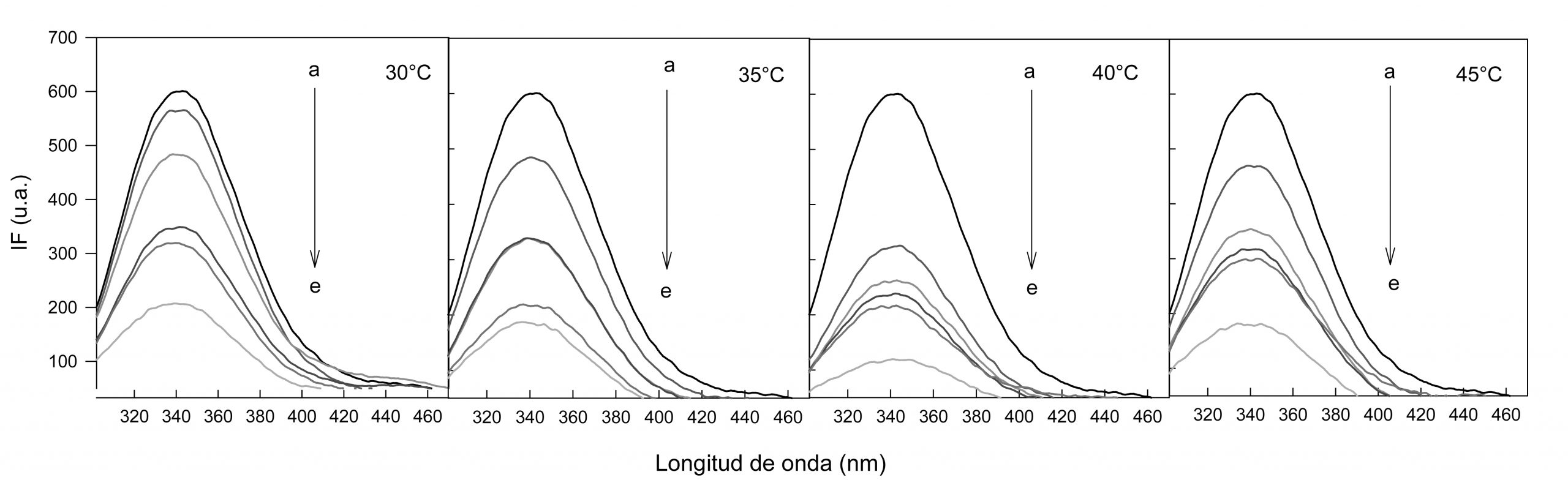
Los experimentos de extinción de la fluorescencia del triptófano se llevaron a cabo a 30, 35, 40 y 45oC en una celda de cuarzo de 1.5 ml usando un espectrofluorímetro LS-45 (Perkin Elmer) a partir de una solución de BSA a una concentración de 6 μM en regulador PBS 20mM pH 7.4, a la cual se le añadió Avn-C (4, 6, 9, 12 y 18μM). Se recogieron los espectros de emisión empleando una lexc 280nm. Todos los experimentos se realizaron por triplicado.
El apagamiento de la fluorescencia es descrito por la ecuación de Stern-Volmer (Lakowicz, 2006):
F0/F = 1 + kqƮ 0 [Q] = 1 + KSV [Q]
Donde F0 y F son las intensidades de fluorescencia antes y después de la adición del apagador (Avn-C), respectivamente, [Q] es la concentración del apagador y KSV es la constante de apagamiento Stern-Volmer. Siendo kq la constante de apagamiento bimolecular, Ʈ0 es el tiempo de vida promedio del fluoróforo (en este caso de los residuos aromáticos dentro de la albúmina) en ausencia del apagador. Con ella se determinaron los valores de KSV por regresión lineal a través de una gráfica F0/F contra [Q].
La formación de un complejo se confirmó mediante los valores de la constante de apagamiento (kq) calculada con la ecuación 2:
kq= KSV / Ʈ 0
asumiendo un tiempo de vida de fluorescencia del biopolímero BSA de 10-8 (Suryawanshi et al., 2015). Para el docking molecular se empleó el programa AutodockVina de código abierto, el cual fue diseñado con el fin de realizar de forma precisa la simulación de acoplamiento molecular proteína-ligando mediante cálculos computacionales (Eberhardt et al., 2021). Se utilizó el código PDB:4OR0 para la BSA y la herramienta bioinformática USFC Chimera en la visualización y el análisis de estructuras moleculares de forma interactiva.
La comunicación entre la Avn-C y la BSA se evaluó mediante el cambio en los espectros de emisión de fluorescencia de la proteína en ausencia y presencia de la fenolamida. La BSA tiene dos residuos de triptófano (Trp134, localizado en la superficie de la proteína, y Trp213, dentro del dominio hidrofóbico de la BSA) que muestran fluorescencia intrínseca, por lo que un cambio en el espectro de emisión de fluorescencia de la BSA ocurrirá sólo en respuesta a la interacción con la Avn-C.
Un cambio en la lmax de 340nm hacia longitudes de onda mayores (red shift) indicaría que el Trp213 está en un entorno más polar, mientras que un desplazamiento hacia menores longitudes de onda (blue shift) indicaría que el Trp213 se encuentra en un entorno menos polar, reflejando así una interconexión directa o indirecta del polifenol con la región hidrofóbica e hidrofílica localizadas alrededor del Trp213 y sugeriría ciertos cambios conformacionales.
En la figura 1 se muestran los cambios en los espectros de emisión de fluorescencia de triptófano en función del aumento en la concentración de Avn-C a diferentes temperaturas. Como puede observarse, la emisión de fluorescencia de la BSA disminuye gradualmente con la adición sucesiva de Avn-C, indicando que la Avn-C puede apagar la fluorescencia intrínseca de la proteína, lo que concuerda con lo reportado para otros polifenoles (Bourassa et al., 2010) y biomoléculas (Ma et al., 2018). Este apagamiento no va acompañado de un desplazamiento de los espectros a menores o mayores longitudes de onda, lo que indica que el Trp213 no ha sido expuesto a ningún cambio de polaridad, sugiriendo que la Avn-C se está uniendo al fluoróforo a través de intercambios hidrofóbicos.
El docking molecular de ambas moléculas se muestra en la figura 2; como puede observarse, la avenantramida-C se une a la cavidad hidrofóbica de la proteína tal y como lo sugiere el experimento de fluorescencia intrínseca.
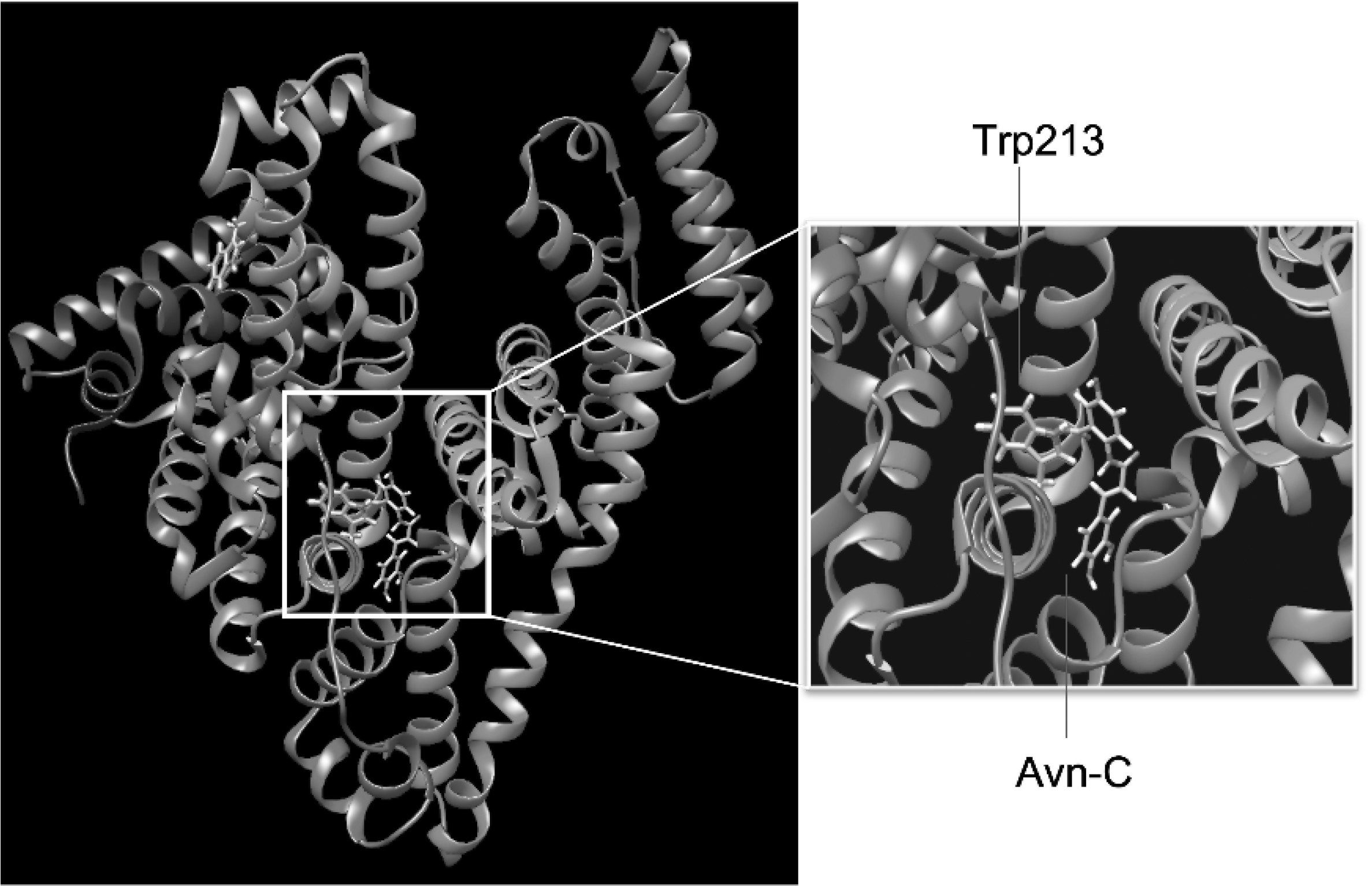
Figura 2. Docking molecular de la BSA y la Avn-C. Se muestra el anillo indol del Trp213 y la estructura de la avenantramida C.
La intensidad máxima en la emisión de fluorescencia de la BSA, medida a 340nm en función de concentraciones crecientes de Avn-C, se utilizó para elaborar perfiles de unión molecular, ya que el apagamiento de fluorescencia se debe a la disminución en el rendimiento cuántico inducido por una variedad de interacciones moleculares con la molécula apagadora.
Dicho fenómeno puede dividirse en dos grupos: “colisional o dinámico”, cuando la desactivación de fluorescencia es el resultado de los choques entre moléculas (molécula fluorescente y apagador) y “apagameinto estático”, cuando es resultado de la formación de un complejo (Lakowicz, 2016). Ambos tipos de desactivación requieren el contacto molecular del fluoróforo y el apagador, sin embargo, el comportamiento distinto frente a la temperatura permite distinguir el estático del dinámico.
En el segundo, un incremento en la temperatura origina que la difusión y el apagamiento colisional incrementen y ocurre lo opuesto en el primero. En la tabla I se resumen los valores obtenidos para las constantes de Stern-Volmer (KSV) y la de apagamiento bimolecular (kq). El decremento en KSV, conforme aumenta la temperatura, es indicativo de un apagamiento de tipo estático, es decir que existe la formación de un complejo entre la BSA y la Avn-C.
Se ha demostrado que los compuestos polifenólicos se relacionan con los residuos de proteínas principalmente a través de los grupos hidroxilo presentes en los anillos de su estructura y forman puentes de hidrógeno que estabilizan la interacción. Reinke y Gestwicki (2007) propusieron, además, otras características importantes que deben poseer las moléculas para dicha comunicación: a) la existencia de dos grupos aromáticos terminales, b) la presencia de grupos hidroxilo y c) un linker con una longitud de 6 a 19 Ǻ que conecte los dos grupos aromáticos presentes en la estructura del polifenol. La Avn-C cumple con todos estos criterios, lo que la hace una molécula capaz de conectarse con el interior de las proteínas de manera eficiente.
CONCLUSIONES
En este trabajo se demuestra la interacción de la Avn-C y la BSA por espectroscopía de fluorescencia. Los resultados indican que la Avn-C es un fuerte apagador de la fluorescencia intrínseca de la BSA y que se une con gran afinidad a la proteína formando un complejo BSA/Avn-C bajo las condiciones ensayadas. Esto propone a la Avn-C como una molécula con potencial terapéutico en el área médica y farmacológica, principalmente en enfermedades relacionadas con agregación proteica.
* Universidad Autónoma de Nuevo León, San Nicolás de los Garza, México.
Contacto: azucena.gonzalezhr@uanl.edu.mx, maría.quirozvz@uanl.edu.mx;
REFERENCIAS
Bose, A. (2016). Interaction of tea polyphenols with serum albumins: A fluorescence spectroscopic analysis, Journal of Luminescence, 169, 220-226. https://doi.org/10.1016/j.jlumin.2015.09.018
Bourassa, P., et al. (2010). Resveratrol, genistein, and curcumin bind bovine serum albumin, The Journal of Physical Chemistry B, 114(9), 3348-3354. https://doi. org/10.1021/jp9115996
Bratt, K., et al. (2003). Avenanthramides in oats (Avena sativa L.) and structure-antioxidant activity relationships, Journal of Agricultural and Food Chemistry, 51(3), 594-600. https://doi.org/10.1021/jf020544f
Eberhardt, J., Santos-Martins, D., Tillack, A. F., et al. (2021). AutoDock Vina 1.2.0: New Docking Methods, Expanded Force Field, and Python Bindings, Journal of Chemical Information and Modeling, 61, 8, 3891-3898, https://doi.org/10.1021/acs.jcim.1c00203
Lakowicz, J.R. (2016) Principles of fluorescence spectroscopy. 3rd edn. New York: Springer. p. 954.
Ma, L., Maragos, C.M., y Zhang, Y. (2018). Interaction of zearalenone with bovine serum albumin as determined by fluorescence quenching, Mycotoxin Research, 34(1), 39-48, https://doi.org/10.1007/s12550-017-0297-7
Quiroz-Vázquez, M.G., et al. (2020). Avenanthramide-C prevents amyloid formation of bovine serum albumin, Biophysical Chemistry, 263, 106391. https://doi.org/10.1016/j.bpc.2020.106391
Rasane, P, et al., (2013). Nutritional advantages of oats and opportunities for its processing as value added foods – a review, Journal of Food Science and Technology, 52(2), 662- 675, https://doi.org/10.1007/s13197-013-1072-1
Reinke, A.A., y Gestwicki, J.E. (2007). Structure-activity relationships of amyloid beta-aggregation inhibitors based on curcumin: Influence of linker length and flexibility, Chemical Biology and Drug Design, 70(3), 206-215, https://doi.org/10.1111/j.1747-0285.2007.00557.x
Sang, S., y Chu, Y.F. (2017). Whole grain oats, more than just a fiber: role of unique phytochemicals, Molecular Nutrition & Food Research, 61(7), 1600715, https://doi.org/10.1002/mnfr.201600715
Suryawanshi, V.D., et al. (2016). Spectroscopic analysis on the binding interaction of biologically active pyrimidine derivative with bovine serum albumin, Journal of Pharmaceutical Analysis, 6(1), 56-63, https://doi.org/10.1016/j.jpha.2015.07.001
Wang, W., Snooks, H.D., y Sang, S. (2020). The chemistry and health benefits of dietary phenolamides, Journal of Agricultural and Food Chemistry, 1-57, https://doi.org/10.1021/acs.jafc.0c02605
Wu, W., et al. (2018). Avenanthramide aglycones and glucosides in oat bran: chemical profile, levels in commercial oat products, and cytotoxicity to human colon cancer cells, Journal of Agricultural and Food Chemistry, 66(30), 8005- 8014. https://doi.org/10.1021/acs.jafc.8b02767
Recibido: 29/11/2022.
Aceptado: 05/06/2023.