Tuberculosis resistente al tratamiento
Ana L. Granados-Tristán ORCID: 0000-0002-8383-8436
Laura A. González-Escalante ORCID: 0000-0001-8268-8205
Katia Peñuelas-Urquides ORCID: 0000-0002-9220-2421
CIENCIA UANL / AÑO 27, No.123, enero-febrero 2024
DOI: https://doi.org/10.29105/cienciauanl27.123-6
La tuberculosis (TB) es una enfermedad infecciosa originada principalmente por una bacteria denominada Mycobacterium tuberculosis, aunque existen otras especies del mismo género que también pueden ocasionarla (Brosch et al., 2002) (figura 1). A lo largo de la historia ha generado incontables muertes en todo el mundo, incluso se ha encontrado evidencia arqueológica de ésta en momias egipcias que datan del año 2300 A.C. (Cave y Demonstrator, 1939). En la actualidad, la Organización Mundial de la Salud (OMS) reporta que en 2021 fue causa de muerte en 1.6 millones de personas (WHO, 2022a).
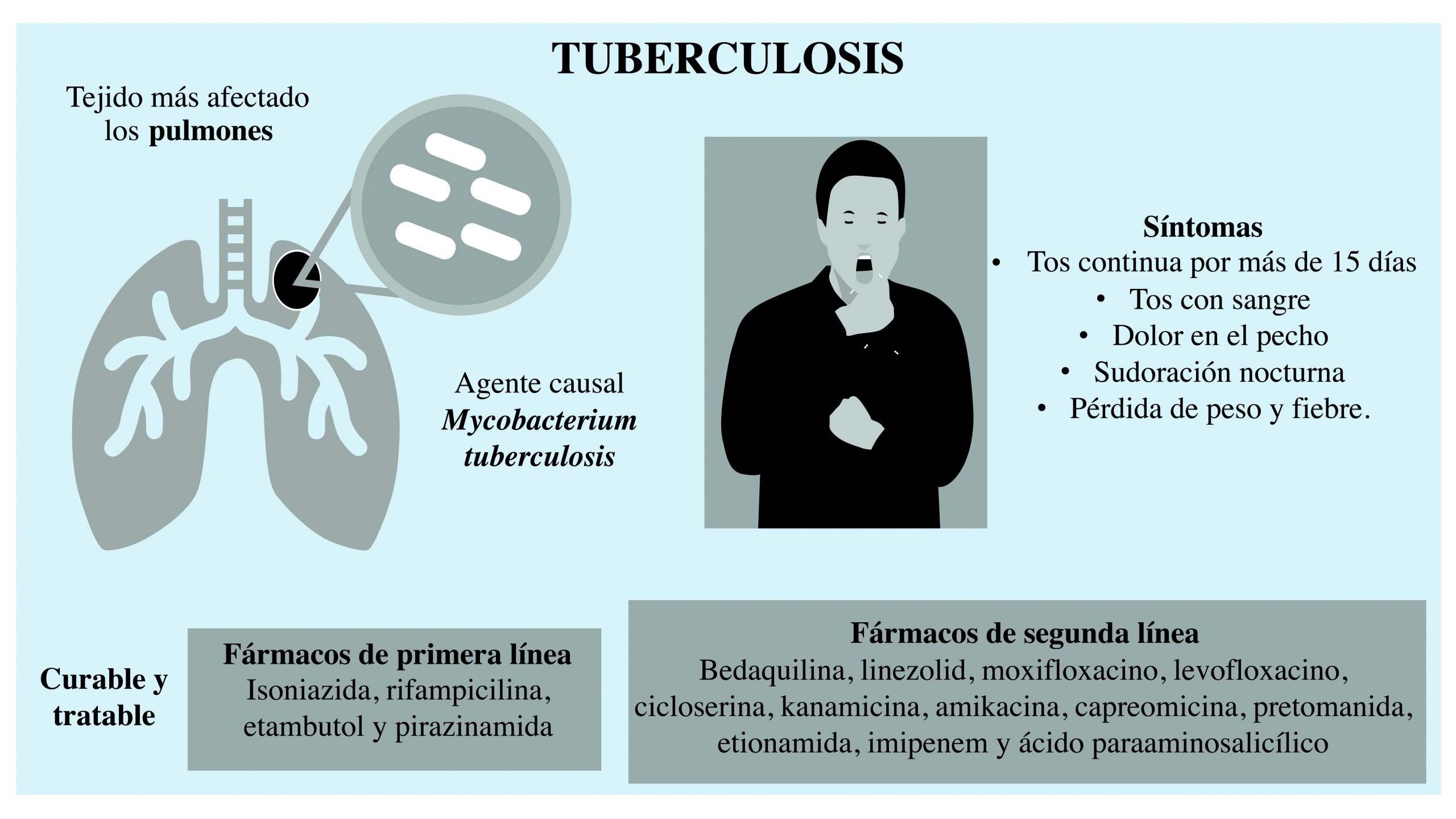
En la mayoría de los casos, la TB perjudica principalmente los pulmones (TB pulmonar). Sin embargo, puede afectar diferentes tejidos como el cerebro, corazón, riñones o varios órganos a la vez (Golden y Vikram, 2005).
Los síntomas más frecuentes en la TB pulmonar son: tos continua por más de 15 días, tos con sangre, dolor en el pecho, sudoración nocturna, pérdida de peso y fiebre (WHO, 2022a) (figura 1). Cuando se manifiestan éstos, se considera TB pulmonar activa. En muchos pacientes, el sistema inmunológico sano puede contener la infección mediante una estructura llamada granuloma, donde M. tuberculosis se encuentra inactiva o en un estado de latencia, lo que se denomina TB latente, y el portador no presenta síntomas. Ésta puede permanecer así durante muchos años; sin embargo, una alteración en el sistema inmune podría desencadenar que el granuloma cambie su composición y provocar la diseminación de la bacteria y la manifestación sintomática (Pai et al., 2016).
Cuando alguien presenta infección activa de TB susceptible a fármacos, se considera curable.
El tratamiento básico tiene una duración de entre cuatro y seis meses, y consta de cuatro medicamentos de primera línea: isoniazida, rifampicina, etambutol y pirazinamida (WHO, 2022a). Cuando la infección no cede con éste, se considera resistente y se trata con fármacos de segunda línea, los cuales se clasifican en tres grupos: a) levofloxacino, moxifloxacino, bedaquilina y linezolid, b) clofazimina y cicloserina o terizidona, c) etambutol, delamida, pirazinamida, imipenem, amikacina, etionamida/ protionamida y ácido paraaminosalicílico (PAS; Falzon et al., 2017; WHO, 2022b) (figura 1).
¿QUÉ CAUSA LA RESISTENCIA A FÁRMACOS EN LA TUBERCULOSIS?
La TB resistente se puede clasificar en cinco categorías de acuerdo con la OMS: resistente sólo a isoniazida, sólo a rifampicina (TB-RR), multifarmacorresistente (TB-MFR) cuando lo es tanto a isoniazida como a rifampicina; preextendida (a rifampicina y a una fluoroquinolona), y extendida (XDR-TB) cuando es resistente a rifampicina, además de una fluoroquinolona y al menos a uno de bedaquilina o linezolid (WHO, 2022a). Asimismo, se ha identificado un tipo de infección invulnerable a todos los paliativos que existen para su cura: la TB totalmente resistente (Udwadia et al., 2012).
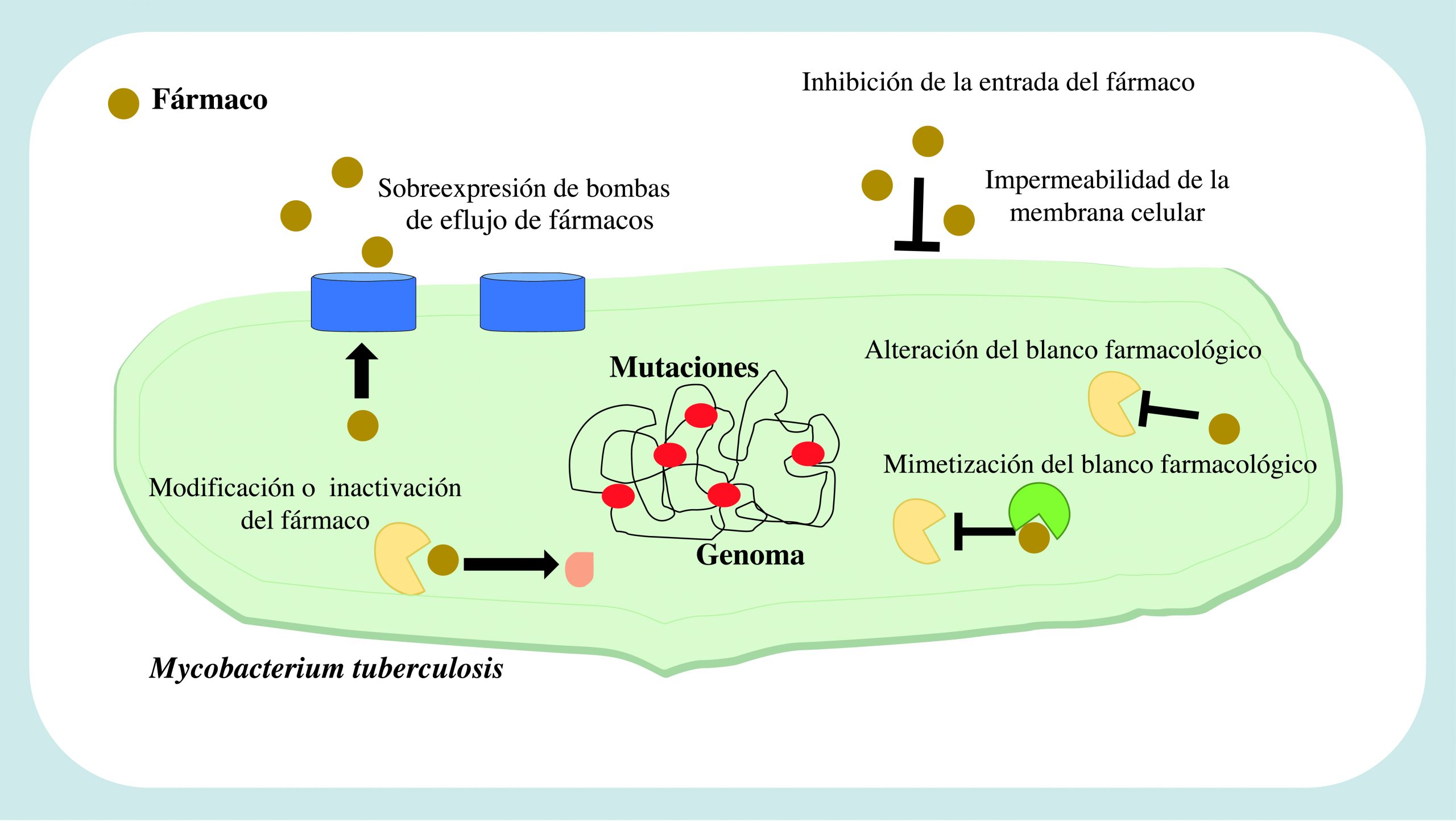
Los factores causantes de la resistencia en M. tuberculosis se pueden clasificar como intrínsecos y extrínsecos. Los intrínsecos son aquellos mecanismos relacionados a las características propias de la bacteria; mientras que los extrínsecos son adquiridos por fenómenos externos (Almeida Da Silva y Palomino, 2011; Palomino y Martin, 2014).
Dentro de los primeros se pueden mencionar la permeabilidad de la pared celular, que por su alto contenido de lípidos evita la penetración de moléculas hidrofílicas (Jankute et al., 2015); la modificación o mimetización del blanco de acción de los fármacos, la degradación de las moléculas activas y la expulsión de los medicamentos mediante bombas de eflujo (Singh et al., 2020) (figura 2).
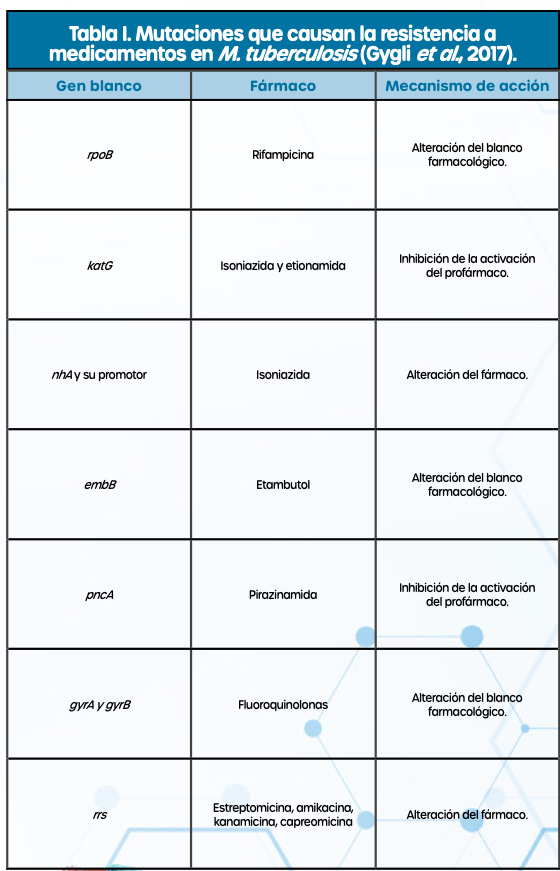
Los mecanismos extrínsecos se relacionan principalmente con la terapia contra la TB, sobre todo cuando no es llevado de forma correcta o completa. Las sustancias ejercen una presión selectiva sobre las bacterias y provocan que las variantes que adquieren mutaciones que les permiten sobrevivir al tratamiento se multipliquen en el hospedero y se propaguen a la población (Nimmo et al., 2022). En la tabla I se enlistan algunas mutaciones identificadas, las cuales se han reportado como presentes en genes que codifican proteínas blanco de las drogas antiTB o en proteínas encargadas de modificarlos a su forma activa (figura 2) (Gygli et al., 2017).
¿CÓMO SE COMBATE LA TUBERCULOSIS?
A lo largo de la historia se han creado estrategias con el objetivo de combatir la TB. La primera fue en 1905, cuando Edward Trudeau fundó la Sociedad Americana de Sanatorios (American Sanatorium Society), dedicada a tratar pacientes con TB (Murray, 2004). En 1920 surge la Unión Internacional Contra la TB (UICT), actual Unión Internacional Contra la Tuberculosis y Enfermedades Respiratorias (UICTER) (Caminero, 2003).
En 1921 Albert Calmette y Jean Camille Guérin produjeron la vacuna del bacilo Calmette y Guérin contra la TB, cuya utilización depende de la morbilidad del padecimiento en cada lugar. En países con una carga de morbilidad alta se recomienda vacunar a todos los lactantes, como prevención de meningitis tuberculosa o infecciones diseminadas; mientras que en naciones con morbilidad baja sólo se recomienda a aquellos lactantes o infantes que hayan estado expuestos a la infección (Fatima et al., 2020). En 1944 se reportó la utilización del primer antibiótico (estreptomicina) para curar a quien presenta este mal (Larkins-Ford et al., 2022). En 1952 se descubrió la isoniazida, un antibiótico que presenta la mayor actividad contra la TB, y en los siguientes años se reportaron pirazinamida, cicloserina, etambutol y rifampicina como opciones terapéuticas (Dooley et al., 2019).
A pesar de la aparición de diferentes drogas antiTB, ésta continuaba siendo una gran problemática mundial debido a que una tercera parte del orbe se encontraba infectada con el agente causal en 1993, y no existían estrategias definitivas que la disminuyeran. Por
lo tanto, en 1994 la OMS empezó a promover la estrategia DOTS (por sus siglas en inglés, Directly Observed Therapy-Short Course, o en español tratamiento acortado estrictamente supervisado), que consta de cinco elementos: 1) compromiso político, 2) detección de casos utilizando la microscopía para analizar muestras de expectoración en personas con tos prolongada, 3) quimioterapia de corta duración y directamente observada por el personal de salud, 4) suministro regular de los fármacos, y 5) un sistema que permita evaluar individualmente a los pacientes. Desde la implementación de la DOTS se logró observar un progreso en el control de la TB (Davies, 2003). Además, al utilizarla en tratamiento de enfermos con TB resistente decrece la transmisión de cepas farmacorresistentes y reduce este problema de salud (Moonan et al., 2011).
En 2000, la OMS creó la Alianza Fin de la TB y en 2001 se emite el plan mundial para el fin de la TB (End TB strategy). Cada año se establece la estrategia enfocada en tres principios: integrar centros de cuidado y prevención, generar políticas y sistemas adecuados y promover la investigación e innovación. Además, se han creado diversos programas enfocados en la lucha contra el SIDA/ TB y la TB tolerante a fármacos basados en políticas y enfoques adecuados a cada uno de estos retos (WHO, 2006).
CONCLUSIONES
La TB ha sido un gran problema de salud a lo largo de la historia de la humanidad y la aparición de drogas antituberculosas fue un gran avance para tratarla. Sin embargo, la resistencia a éstas representa el principal reto para su control, ya que ésta se presenta más rápido que el desarrollo de nuevas alternativas terapéuticas. Por lo tanto, para poner fin a la TB se requiere desarrollar más investigación que permita continuar dilucidando mecanismos de farmacorresistencia como primer paso para el control de la TB resistente al tratamiento.
* Universidad Autónoma de Nuevo León, San Nicolás de los Garza, México.
Contacto: ana.granadostrs@uanl.edu.mx
** Instituto Mexicano del Seguro Social, Monterrey, México.
Contacto: laura.gonzaleze@imss.gob.mx, katia.penuelasu@imss.gob.mx
REFERENCIAS
Almeida Da Silva, P.E., y Palomino, J.C. (2011). Molecular basis and mechanisms of drug resistance in Mycobacterium tuberculosis: classical and new drugs. J Antimicrob Chemother. 66:1417-30.
Brosch, R., Gordon, S.V., Marmiesse, M., et al. (2002). A new evolutionary scenario for the Mycobacterium tuberculosis complex. Proceedings of the National Academy of Sciences. 99: 3684-3689.
Caminero, J. (2003). Guía de la tuberculosis para médicos especialistas. Ed. Unión Internacional Contra la Tuberculosis y Enfermedades Respiratorias (UICTER): París. Francia.
Cave, A., y Demonstrator, A. (1939). The evidence for the incidence of tuberculosis in ancient Egypt. British Journal of Tuberculosis. 33:142-152.
Davies, P.D. (2003). The role of DOTS in tuberculosis treatment and control. American Journal of Respiratory Medicine. 2:203-209.
Dooley, K.E., Hanna, D., Mave, V., et al. (2019). Advancing the development of new tuberculosis treatment regimens: the essential role of translational and clinical pharmacology and microbiology. PLoS Medicine. 16:e1002842.
Falzon, D., Schünemann, H.J., Harausz, E., et al. (2017). World Health Organization treatment guidelines for drug-resistant tuberculosis, 2016 update. European Respiratory Journal. 49.
Fatima, S., Kumari, A., Das, G., et al. (2020). Tuberculosis vaccine: A journey from BCG to present. Life Sciences. 252:117594.
Golden, M.P., y Vikram, H.R. (2005). Extrapulmonary tuberculosis: an overview. American Family Physician. 72:1761-1768.
Gygli, S.M., Borrell, S., Trauner, A., et al. (2017). Antimicrobial resistance in Mycobacterium tuberculosis: mechanistic and evolutionary perspectives. FEMS Microbiology Reviews. 41:354-373.
Jankute, M., Cox, J.A., Harrison, J., et al. (2015). Assembly of the mycobacterial cell wall. Annual Review of Microbiology. 69:405-423.
Palomino, J.C., y Martin, A. (2014). Drug resistance mechanisms in Mycobacterium tuberculosis. Antibiotics. 3:317-340.
Singh, R., Dwivedi, S.P., Gaharwar, U.S., et al. (2020). Recent updates on drug resistance in Mycobacterium tuberculosis. Journal of Applied Microbiology. 128:1547-1567.
Udwadia, Z.F., Amale, R.A., Ajbani, K.K., et al. (2012). Totally drug-resistant tuberculosis in India. Clinical Infectious Diseases. 54:579-581.
World Health Organization. (2006). The global plan to stop TB, 2006-2015. World Health Organization.
World Health Organization. (2022a). Global Tuberculosis Report 2022. World Health Organization. 68.
World Health Organization. (2022b). WHO consolidated guidelines on tuberculosis. Module 4: treatment-drug-resistant tuberculosis treatment, 2022 update. World Health Organization.