Necrosis hepatopancreática aguda en camarón: prevención y alternativa terapéutica
Karla Alejandra Soto Marfileño*, Lucio Galaviz Silva*
CIENCIA UANL / AÑO 26, No.120, julio-agosto 2023
DOI: https://doi.org/10.29105/cienciauanl26.120-3
Hoy en día el camarón, tanto de captura como de criadero, es uno de los más importantes productos pesqueros comercializados internacionalmente. Se trata de uno de los crustáceos más consumidos a nivel mundial en todas sus presentaciones, desde cócteles o aguachiles hasta elegantes banquetes.
En México, debido a su alta demanda y consumo, se ha optado por el cultivo, en lugar de la captura. Esta práctica se ha convertido en una opción para pescadores tradicionales, quienes han puesto en marcha capacitaciones, tecnificación, utilización de centros de acopio y construcción y equipamiento de laboratorios (Conapesca, 2018). Seguro se preguntarán… ¿cómo es el cultivo del camarón? Se crían en grandes estanques de por lo menos un metro de profundidad (figura 1). El sitio suele estar en un estuario o cerca de la costa, para asegurar una fuente cercana de agua salobre o salada. Cuando se cría lejos de la costa se utilizan estanques artificiales, como una clase de “alberca” salada en la que son colocados bajo condiciones controladas para que puedan vivir.
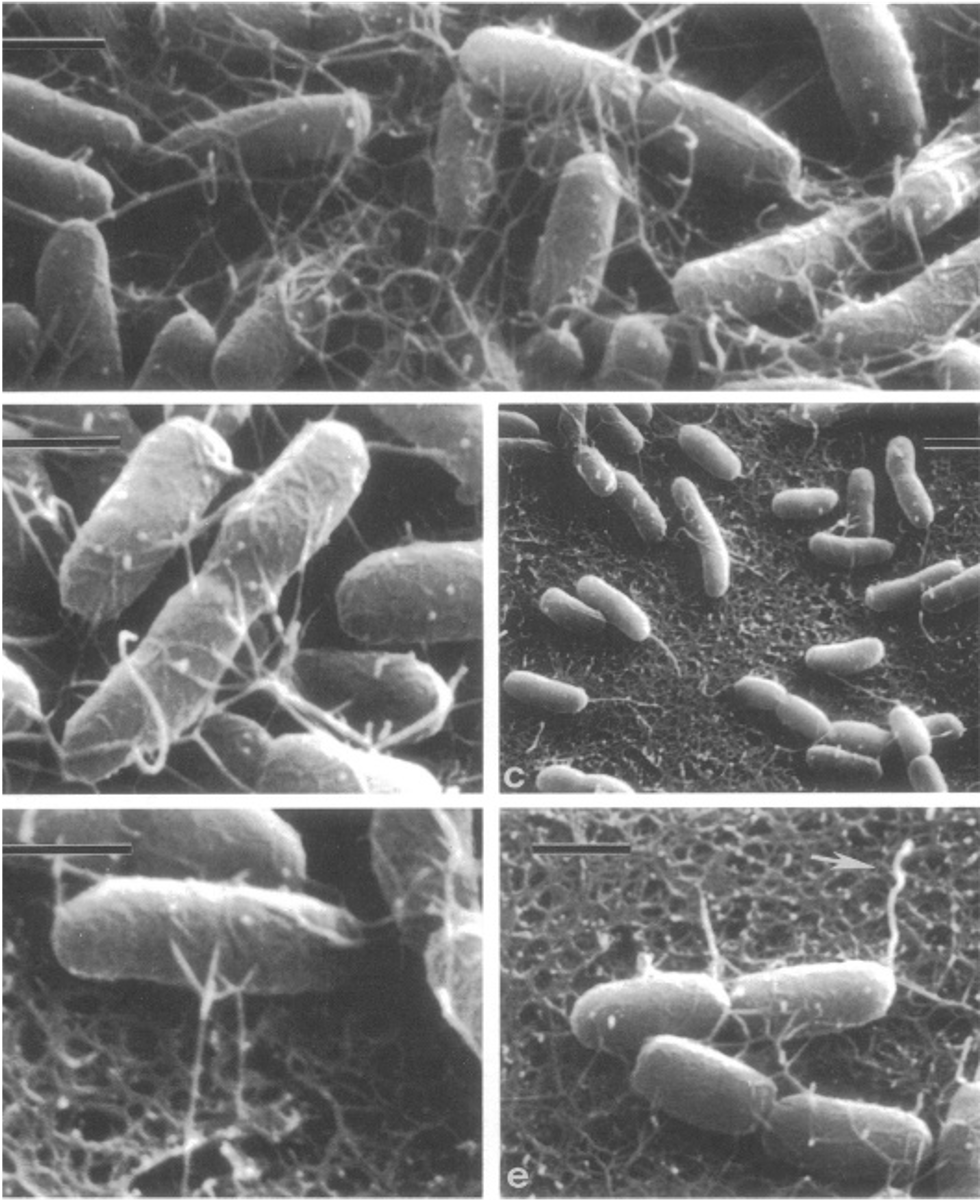
Aunque la producción en el país ha aumentado y se obtienen grandes rendimientos respecto a su producción, el cultivo se ve afectado por diversos agentes infecciosos, como la enfermedad de necrosis hepatopancreática aguda, causada por la bacteria Vibrio parahaemolyticus (figura 2). Cabe destacar que el hepatopáncreas es un órgano de vital importancia en el sistema digestivo del camarón, ya que se encarga de funciones del metabolismo como la secreción y formación de enzimas que le ayudan a digerir y absorber carbohidratos, grasas y nutrientes provenientes del alimento que este crustáceo consume.
Algunos síntomas que se pueden observar en un camarón afectado por esta enfermedad son nado errático (en espiral), así como crecimiento reducido, el hepatopáncreas del animal se ve pálido o de color blanquecino (figura 3), además se puede observar un tamaño menor en comparación con ejemplares sanos; los camarones enfermos se van hasta el fondo del estanque. Este padecimiento resulta ser grave, en la mayoría de los casos 100% de los afectados muere en los primeros 30 días de cultivo (FAO, 2020).
La necrosis hepatopancreática aguda se presentó por primera vez en México en 2013, causando pérdidas económicas por encima de los 118 millones de dólares; aunado a esto, también se observó una falta de respuesta a los antibióticos utilizados comúnmente para combatir enfermedades en granjas camaroneras, afectando profundamente a la industria del país, bajando la producción de 80 a 14 mil toneladas (Conapesca, 2018).
Teniendo en cuenta lo anterior, la pronta detección y el tratamiento oportuno es importante para evitar pérdidas económicas, por lo que se han buscado alternativas y estrategias para poder inhibir el crecimiento y establecimiento del patógeno en los estanques de cultivo.
De forma tradicional, para tratar esta enfermedad se utilizan antibióticos, sin embargo, los encargados de las granjas camaroneras han observado que la respuesta a los medicamentos administrados era poca o, en algunos casos, nula, por lo que los camarones tratados terminaban muriendo. Debido a esto, los acuicultores y científicos del ámbito comenzaron a preguntarse el porqué esta falta de respuesta, y realizaron diversos experimentos para resolver esta incógnita.
Una de las técnicas que resolvió la duda fue el ya famoso antibiograma (figura 4), que consiste en sembrar, en una caja de Petri (un recipiente donde se colocan las bacterias en un medio de cultivo para su apto crecimiento), Vibrio parahaemolyticus con discos de papel impregnados con diferentes tipos de antibióticos. Pasando un tiempo, generalmente un día, se ven pequeños halos, zonas transparentes, si estas bacterias son sensibles al antibiótico, o bien, si no es así, hay ausencia de estas zonas. Después de realizar este estudio, los investigadores descubrieron que esta bacteria era resistente a varios de los antibióticos utilizados comúnmente como tratamiento para combatirla; cabe aclarar que lo más recomendable es minimizar el uso de éstos, considerándolo como último recurso en operaciones de cultivo de camarón, así como cualquier tratamiento con antibióticos treinta días antes de realizar la cosecha, por lo cual se comenzaron a buscar alternativas a su uso.
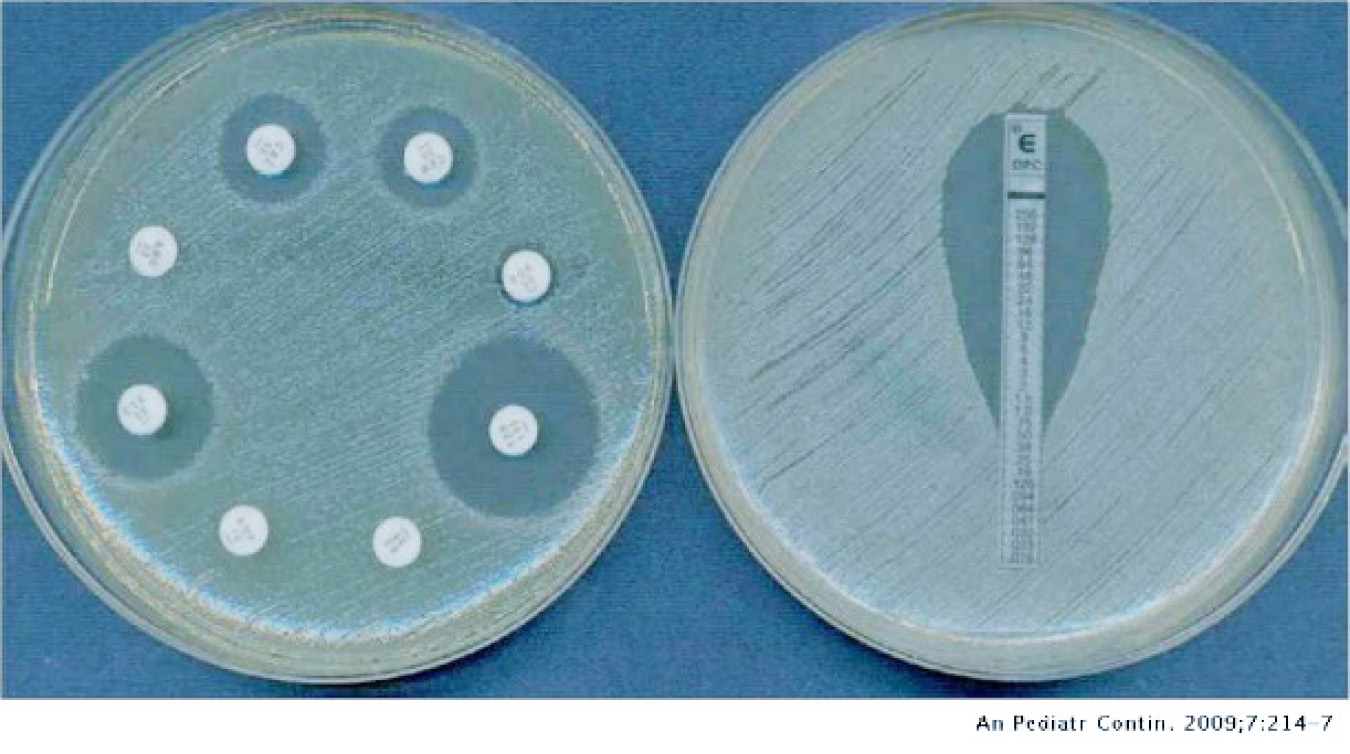
Figura 4. Antibiograma realizado para determinar la sensibilidad de bacterias hacía ciertos antibióticos (Cercenado y Saavedra-Lozano, 2009).
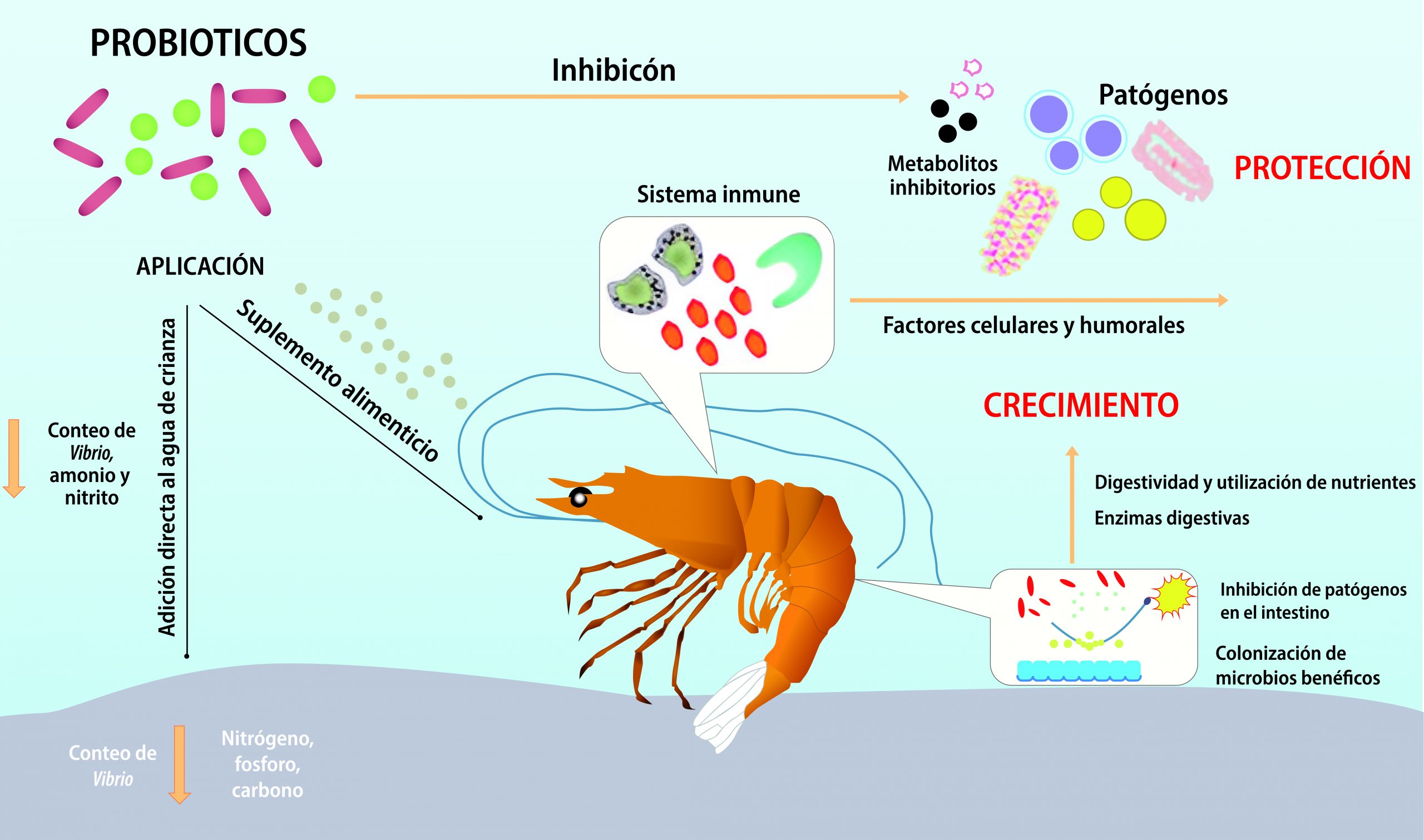
Una de las alternativas que los científicos postularon fue el uso de probióticos. Pero, ¿qué son los probióticos?… Es común que escuchemos esta palabra en la televisión, o la veamos en anuncios, o en productos que consumimos normalmente, como el yogurt. Los probióticos son microorganismos benéficos, es decir, que no hacen daño cuando se consumen, que tienen como misión ayudarnos a combatir enfermedades, a mejorar la absorción de nutrientes, a lograr un equilibrio microbiano en la ya famosa microflora intestinal, la cual debería en realidad ser conocida como microbiota intestinal, entre otros beneficios. El efecto que tienen en los camarones es similar al que tienen en nosotros, pero no sólo eso, también mejoran la calidad del agua donde se encuentran.
De los beneficios que brindan los probióticos a los camarones (figura 5) podemos mencionar que están relacionados con la modulación y estimulación del sistema inmune, es decir, los protegen de enfermedades por bacterias patogénicas induciéndolo a responder y “sacar su línea de defensa” contra estas bacterias. Por otro lado, compiten con patógenos por sitios de unión al sistema gastrointestinal del camarón, previniendo que se establezcan y así evitan que éste se enferme. Otras bacterias probióticas producen moléculas que ayudan a eliminar a las patógenas, como Lactobacillus sp., también consumido por nosotros, estas bacterias producen pequeñas moléculas que ayudan a combatir a patógenas, ácidos grasos y proteínas bactericidas, lo cual mejora la resistencia a enfermedades.
La competición por nutrientes es otro mecanismo utilizado por las bacterias probióticas. En este caso, hay bacterias que compiten contra patógenos por nutrientes esenciales para que puedan crecer y reproducirse, por ejemplo, el hierro, esencial para muchas funciones bacterianas, y lo que hacen los probióticos es crear un ambiente en el que no está disponible este elemento para las bacterias patogénicas, siendo letal para ellas.
Finalmente, otro mecanismo que vale la pena mencionar es que los probióticos producen enzimas (proteínas que catalizan reacciones químicas en los seres vivos) digestivas, mejorando la digestibilidad o disponibilidad de los nutrientes del alimento y aprovechamiento de éste.
CONCLUSIONES
Actualmente hay diversos estudios enfocados en la búsqueda y formulación de alimento adicionado con probióticos, para de esta manera disminuir el uso de antibióticos, combatir enfermedades y mejorar el cultivo de camarón; además, como se mencionó anteriormente, para prevenir el desarrollo de bacterias multirresistentes a antibióticos. Así que la próxima vez que los consumas en coctel, empanizados o en aguachile… piensa que éstos son objeto de estudio en el mundo, en lo que respecta a las medidas de sanidad e inocuidad alimentaria durante el cultivo y prevención de enfermedades.
*Universidad Autónonoma de Nuevo León, San Nicolás de los Garza, México.
Contacto: karla.sotomrfl@uanl.edu.mx
REFERENCIAS
Cercenado, E., y Saavedra-Lozano, J. (2009). El antibiograma. Interpretación del antibiograma: conceptos generales (I). Desde el Laboratorio a la Clínica. 7(4):214-217.
Conapesca. (2018). Cultivo de camarón, producción acuícola de calidad. Disponible en: https://www.gob.mx/conapesca/articulos/cultivo-de-camaron-produccion-acuicola-de-calidad?idiom=es
FAO. (2020). Shrimp acute hepatopancreatic necrosis disease strategy manual. Fisheries and Aquaculture Circular. Disponible en: https://www.fao.org/3/cb2119en/CB2119EN.pdf
Instituto Nacional de Pesca. (2018). Acuicultura del Camarón Blanco. Acuicultura Comercial. Disponible en: https://www.gob.mx/inapesca/acciones-y-programas/acuacultura-camaron-blanco-del-pacifico
Lazado, C.C., Lacsamana, J.I., y Caipang, C.M. (2015). Mechanisms of probiotic actions in shrimp: Implications to tropical aquaculture. In: Caipang, C.M.A., Bacano-Maningas, M.B.I., y Fagutao, F.F. (eds.). Biotechnological Advances in Shrimp Health Management in the Philippines. Kerala, India: Research Signpost.
Noriega-Orozco, L., Acedo-Félix, E., Higuera-Ciapara, I., et al. (2007). Pathogenic and non pathogenic Vibrio species in aquaculture shrimp ponds. Rev Latinoam Microbiol. 49(3- 4):60-67.
Parker, R. (1974). Probiotics, the other half of the antibiotic story. Anim. Nutr. Health. 29:4-8.
Belas, M.R., y Colwell, R.R. (1981). Scanning electron microscope observation of the swarming phenomenon of Vibrio parahaemolyticus. Journal of Bacteriology. 150(2):956-959.
Roque, A., Molina-Aja, A., Bolan-Mejía, C., et al. (2001). In vitro susceptibility to 15 antibiotics of vibrios isolated from penaeid shrimps in Northwestern Mexico. International Journal of Antimicrobial Agents. 17(2001):3833-87.
Sánchez-Ortiz, A.C., Angulo, C., Luna-González, A., et al. (2016). Effect of mixed-Bacillus spp isolated from pustulose ark Anadara tuberculosa on growth, survival, viral prevalence and immune-related gene expression in shrimp Litopenaeus vannamei. Fish Shellfish Immunol. 59:95-102.
Verschuere, L., Rombaut, G., Sorgeloos, P., et al. (2000). Probiotic bacteria as biological control agents in aquaculture. Microbiol. Mol. Biol. Rev. 6 4,655- 671.