Un vistazo al sistema de cannabinoides
Elda Josefina Robles Sierra* https://orcid.org/0000-0003-4870-1378
Brenda González Hernández* https://orcid.org/0000-0001- 5638-468
CIENCIA UANL / AÑO 26, No.120, julio-agosto 2023
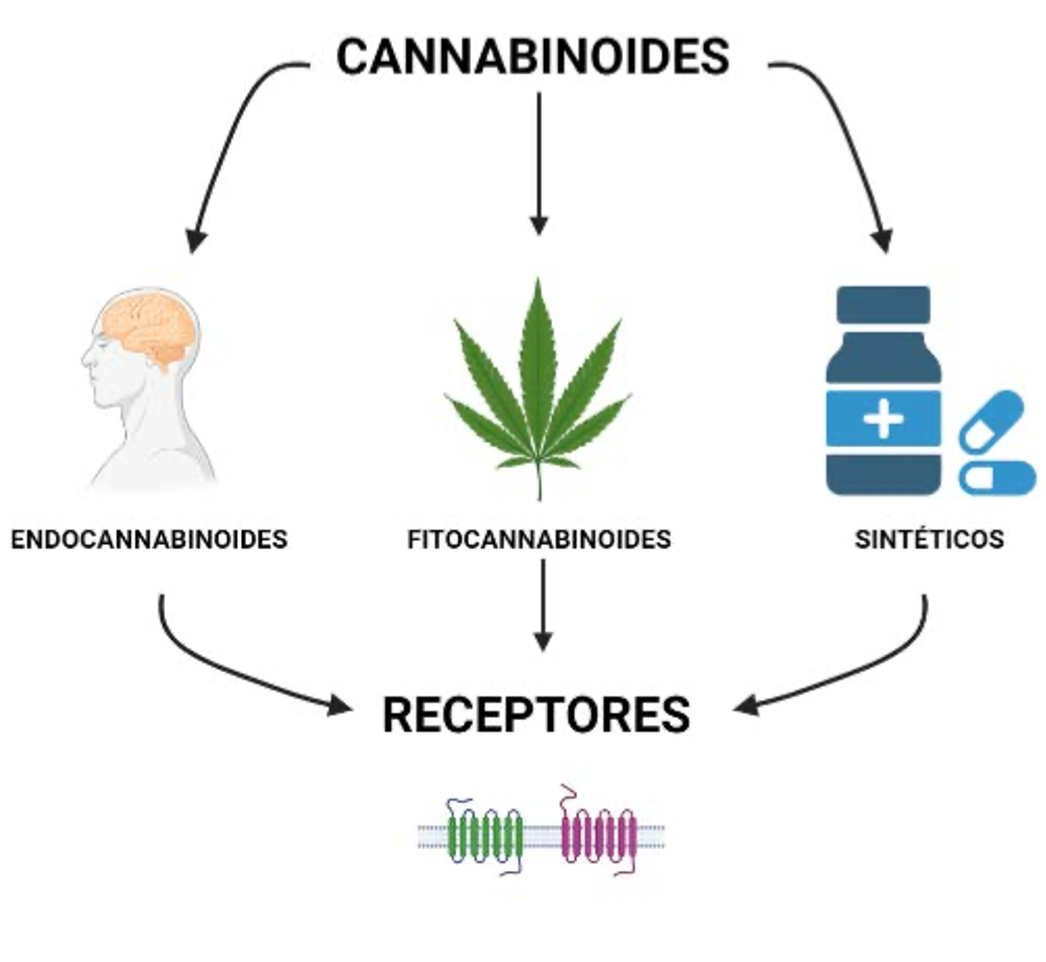
Existen tres tipos de cannabinoides, su estudio ha estado íntimamente relacionado entre sí, por lo que en ocasiones es difícil hablar de unos sin mencionar a los otros.
Los primeros en ser descubiertos fueron los fitocannabinoides, que vienen de la planta Cannabis spp. (Linneo, 1753).
Después de este descubrimiento se identificaron receptores que modulan la respuesta al uso del cannabis, lo cual fue apoyado con el diseño de lo que ahora conocemos como cannabinoides sintéticos.
Finalmente se encontraron los endocannabinoides, sustancias parecidas a las dos anteriores, pero producidas por el propio organismo (figura 1). La historia de estas sustancias es amplia y es un proceso que lleva por lo menos 60 años y continúa avanzando.
HISTORIA
El cannabis es una planta herbácea anual dioica, es decir, que nace y muere dentro de un mismo año y que tiene flores femeninas y masculinas, pertenece a la familia de las cannabáceas; es pariente directo del lúpulo, planta que provee a la cerveza su sabor y aromas característicos. Aunque es una planta polémica en épocas modernas, cuenta con una historia de domesticación tan antigua como el trigo o el maíz que data del 10,000 a.C. (Feitas, 2022). Su domesticación implica la selección de plantas con ciertas características deseables, en el caso de la cannabis fueron sus fibras; de acuerdo con estudios paleobotánicos, el proceso de domesticación comenzó en Asia (Li, 1978) y se ha cultivado durante milenios para la fabricación de textiles, cuerdas, redes de pesca y papel, además del aprovechamiento de sus semillas como alimento y para la obtención de aceite. Hasta la fecha se sigue aprovechando de esta manera, pero también se han sumado usos modernos como los bioplásticos y biocombustibles (Rehman et al., 2021).
Por otro lado, el uso medicinal también puede ser considerado milenario; la medicina tradicional china fue pionera en su uso de acuerdo con la farmacopea más antigua del mundo, la Pen-ts’ao ching, publicada en el primer siglo de nuestra era (Zuardi, 2006).
Su uso se extendió de manera global a lo largo de los siglos como analgésico, anticonvulsivante, tranquilizante, entre otras indicaciones (Hand et al. 2016), pero no fue sino hasta 1753 que se inició su estudio con rigor científico al ser descrita por Carlos Linneo en su libro Species plantarum, el punto de partida de la sistemática botánica actual.
Más de un siglo después, al final del XIX, en la Universidad de Cambridge se aisló el cannabinol (Wood et al., 1896), el primer cannabinoide en obtenerse de forma pura, y aunque al principio su estructura no se identificó de manera correcta y se creía que era altamente tóxico, fue el primer acercamiento al conocimiento de las moléculas activas de la planta que hasta la fecha siguen en investigación.
ENDOCANNABINOIDES
El sistema endocannabinoide (SEC) es un mecanismo regulador que se encuentra en el sistema nervioso central (figura 2) y tejidos periféricos de cordados, es decir, animales que tienen columna vertebral, como los reptiles, aves y mamíferos. Este sistema consta de ligandos endógenos o endocannabinoides y una serie de enzimas especializadas para la síntesis y degradación de estas moléculas. Desde sus diferentes componentes, este sistema se perfila como un prometedor blanco terapéutico para diversos padecimientos.
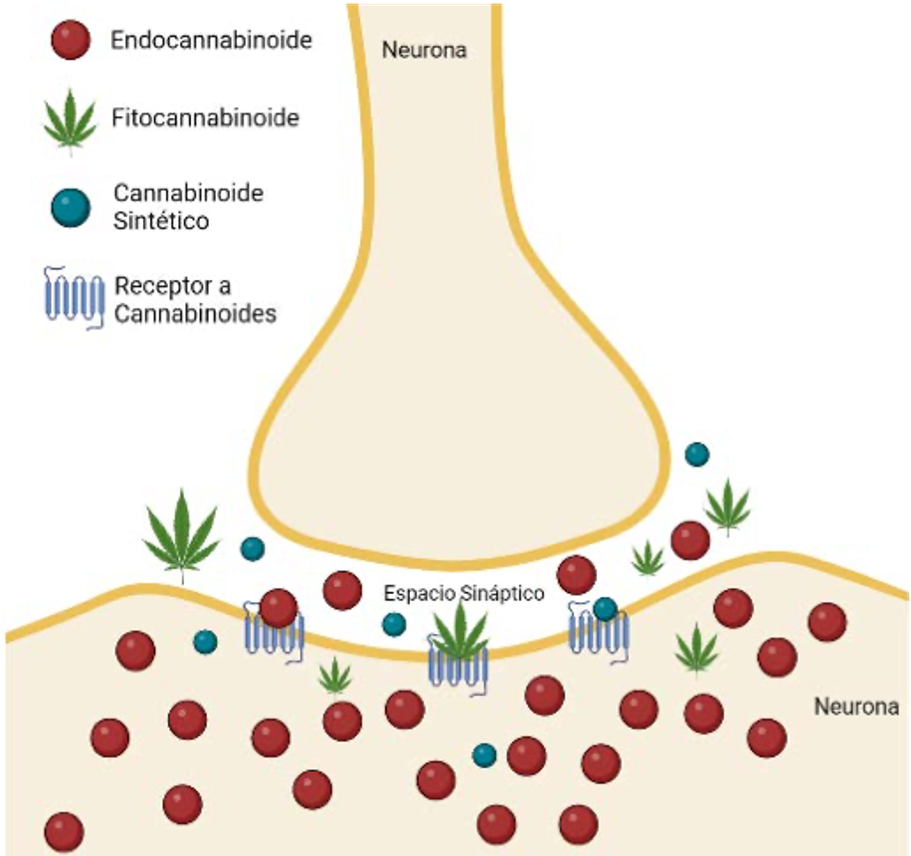
Figura 2. Esquematización del efecto de los diferentes tipos de cannabinoides en las neuronas (fuente: elaboración propia).
El sistema endocannabinoide (SEC) contribuye a la regulación del comportamiento motor, la memoria y el aprendizaje, las respuestas sensoriales, autonómicas y neuroendocrinas. Tiene funciones neuromoduladoras e inmunomoduladoras (Salzet et al., 2000). Los endocannabinoides más estudiados son la anandamida y el 2-araquidonoilglicerol (2-AG) (figura 3), sin embargo, se han descrito por lo menos 13 (Pertwee, 2017).
Para este sistema se reconocen dos receptores, el CB1 y CB2 (Grotenhermen, 2005), la enzima de degradación más conocida para éstos es la hidrolasa de amidas de ácidos grasos (FAAH), de importancia terapéutica porque puede ser inhibida por el fitocannabinoide cannabidiol, aumentando los niveles de endocannabinoides y potenciando sus funciones.
FITOCANNABINOIDES
Actualmente se reconocen como tal los compuestos terpenofenólicos de 21 carbonos mayormente presentes en las flores femeninas del cannabis, a la fecha se estima que existen 120 distintos (ElSohyl et al., 2017), de los cuales menos de 10% tienen la capacidad de actuar sobre el cuerpo humano.
El tetrahidrocannabinol (THC) es el más conocido (figura 3), sin duda tiene potencial terapéutico, pero es el que le confiere a la planta su naturaleza psicoactiva, por lo que su consumo puede resultar perjudicial para el usuario en diferentes formas.
Éste también es relevante debido a que las pruebas de dopaje que buscan detectar el uso de marihuana están diseñadas para identificar sus metabolitos. Las concentraciones de THC también se utilizan para clasificar las variedades de la planta dentro de la ley, la tolerancia en los niveles de esta molécula puede ser diferente dependiendo del país, pero, en general, cuando están debajo de 0.3% se considera cannabis no psicoactivo o cáñamo industrial, y cuando los niveles están por encima de este número se le considera cannabis psicoactivo o marihuana (Aguiar et al., 2022).
Después del THC, el más popular es el cannabidiol (CBD) (figura 3), dado que no es psicoactivo y ejerce efecto neuromodulador e inmunomodulador en el organismo (Peyravian et al., 2020; Singla et al., 2021), tiene un potencial terapéutico como analgésico, ansiolítico, anticonvulsivo, antidepresivo y antinflamatorio (Izzo, 2009; Silvestro et al., 2020).
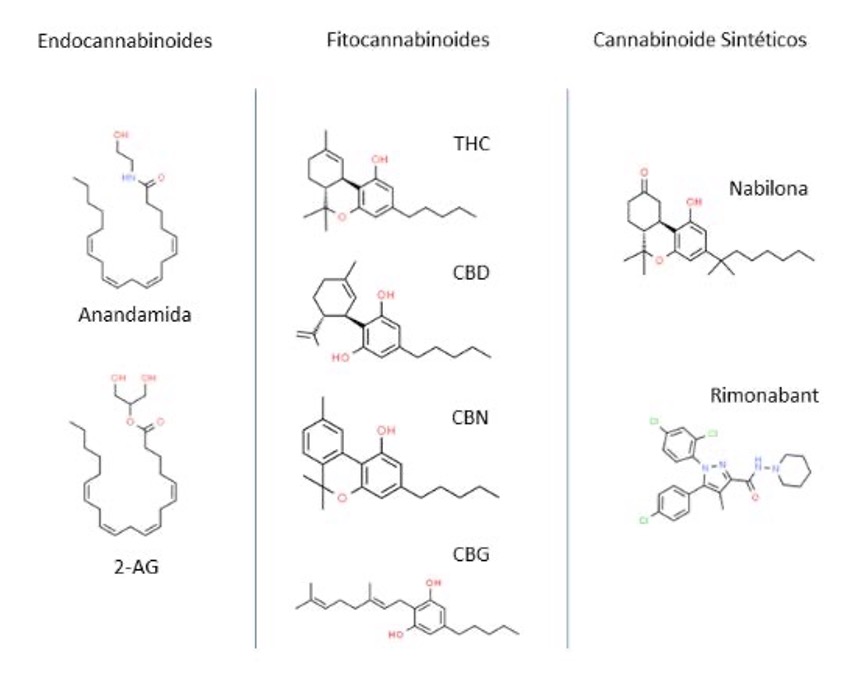
Fig. 3 Ejemplos de estructuras moleculares de los diferentes cannabinoides (fuente: elaboración propia).
El CBD también es el más aceptado. En 2017, la Organización Mundial de la Salud determinó que: “El cannabidiol, molécula no psicoactiva de la planta Cannabis sativa L, no es una sustancia peligrosa, por el contrario, cuenta con un alto potencial terapéutico”, esta declaración fue la conclusión de la Reunión del Comité de Expertos en Farmacodependencia (World Health Organization, 2018). Un año después, la FDA aprobó el fármaco Epidiolex®, un extracto botánico de CBD grado farmacéutico, para el tratamiento de epilepsias de difícil control.
Asimismo, dentro del espectro de cannabinoides con potencial terapéutico destacan el cannabigerol (CBG), cannabinol (CBN), cannabicromeno (CBC) (figura 3), tetrahidrocannabivarina (THCV), cannabidi- varin (CBDV) y ácidos como el tetrahidrocannabinolico (THCA) y el cannabidiólico (CBDA) (Turner, 2017), aunque no se profundizará en sus propiedades, es importante mencionar que también se están investigando y muestran resultados prometedores.
Algunos de éstos han sido poco estudiados por su baja concentración dentro de la planta, sin embargo, cuentan también con la capacidad de modular funciones fisiológicas.
 CANNABINOIDES SINTÉTICOS
CANNABINOIDES SINTÉTICOS
Las primeras investigaciones del sistema endocannabinoide estuvieron íntimamente ligadas con el descubrimiento de los fitocannabinoides y han sido posibles gracias al desarrollo de cannabinoides sintéticos (Ho, 2019) generados en laboratorios con fines médicos y de investigación, como mapear la ubicación de receptores y su función dentro del sistema.
En los usos terapéuticos se han desarrollado análogos de fitocannabinoides y moléculas totalmente nuevas, entre los medicamentos más importantes está la nabilona (figura 3), un análogo del THC, que se prescribe como analgésico y para controlar náuseas y vómito en personas con cáncer.
Otro medicamento importante es el Rimonabant®, un antagonista selectivo del receptor CB1 que se prescribía como supresor del apetito y que estuvo disponible de 2006 a 2008. Sin embargo, debido a que se registraron muchos reportes de depresión y pensamientos suicidas en sus consumidores, se retiró del mercado. Este acontecimiento se sumó a la evidencia que sustenta que el sistema endocannabinoide está implicado en la regulación del estado de ánimo.
El fracaso del Rimonabant® no ha sido el único desatino que se ha suscitado alrededor de los cannabinoides sintéticos, en los últimos años, su uso con fines recreativos se ha convertido en un problema de salud pública. De acuerdo con el Instituto Nacional sobre el Abuso de Drogas de los Estados Unidos, éstos se rocían sobre materia seca y triturada de plantas para así poder fumarlos, se venden como “marihuana sintética” y pueden afectar el cerebro con mucha más potencia que la natural. Sus efectos reales pueden ser impredecibles y, en algunos casos, más peligrosos, llegando poner en peligro la vida de una persona (NIDA, 2011).
CONCLUSIÓN
El cannabis y el ser humano se han acompañado por miles de años, por lo que es importante continuar realizando investigación científica multidisciplinaria para favorecer la correcta toma de decisiones de los usuarios, los profesionales de la salud y los legisladores. La investigación preclínica establece las bases para conocer los usos potenciales de esta planta y las reacciones del sistema endocannabinoide como blanco terapéutico; es necesario escalar hacia los estudios clínicos para poder utilizar estas sustancias en dosis adecuadas y así contribuir en el tratamiento como coadyuvante en padecimientos dentro de un contexto de medicina basada en evidencias.
* Universidad Autónoma de Nuevo León, San Nicolás de los Garza, México.
Contacto: brenda.gonzalezhn@uanl.edu.mx
REFERENCIAS
Aguiar, F.C.D.S.P., y Rocha, E.D. (2022). Facing the Forensic Challenge of Cannabis Regulation: A Methodology for the Differentiation between Hemp and Marijuana Samples. Brazilian Journal of Analytical Chemistry. 9(34):162-176. Doi: 10.30744/brjac.2179-3425.AR-42-2021
ElSohly, M.A., Radwan, M.M., Gul, W., et al. (2017). Phytochemistry of Cannabis sativa L. Prog. Chem. Org. Nat. Prod. 103:136. Doi: 10.1007/978-3-319-45541-9_1
Freitas, H. (2022). Medical Cannabis-A Historical Perspective. Preprints, 2022040054. Doi: 10.20944/preprints202204.0054.v1
Grotenhermen, F. (2005). Cannabinoids. Current Drug Targets-CNS & Neurological Disorders. 4(5):5075- 30. Doi: 10.2174/156800705774322111
Hand, A., Blake, A., Kerrigan, P., et al. (2016). History of medical Cannabis. J Pain Manage. 9:387-394.
Ho, T.C., y Tius, M.A. (2019). Synthesis of Classical/Nonclassical Hybrid Cannabinoids and Related Compounds. In Cutting-Edge Organic Synthesis and Chemical Biology of Bioactive Molecules, Chapter 11. Springer, Singapore.
Izzo, A., Borrelli, F., Capasso, R., et al. (2009). Non-psychotropic plant cannabinoids: new therapeutic opportunities from an ancient herb. Trends Pharmacol. Sci. 30(10):515- 27. Doi: 10.1016/j.tips.2009.07.006
Linnaeus, C. (1793). Species Plantarum. Vol. 1. London.
Li, H.-L. (1974). An Archaeological and Historical Account of Cannabis in China. Economic Botany. 28(4):437-448.
NIDA. (2011). Febrero 1. Cannabinoides sintéticos (K2/Spice)-DrugFacts. Disponible en: https://nida.nih.gov/es/publicaciones/drugfacts/cannabinoides-sinteticos-k2spice en 2022, September 20
Pertwee, R.G. (2015). Endocannabinoids and their pharmacological actions. Endocannabinoids, 13- 7. Handbook of Experimental Pharmacology. Vol. 231. Springer, Cham. Doi: 10.1007/9783319-20825-1_1
Peyravian, N., Deo, S., Daunert, S., et al. (2020). Cannabidiol as a novel therapeutic for immune modulation. ImmunoTargets and Therapy. 9:131-140. Doi: 10.2147/ITT.S263690
Rehman, M., Fahad, S., Du, G., et al. (2021). Evaluation of hemp (Cannabis sativa L.) as an industrial crop: A review. Environmental Science and Pollution Research. 28(38):528325-2843. Doi: 10.1007/s11356-021-162645
Salzet, M., Breton, C., Bisogno, T., et al. (2000). Comparative biology of the endocannabinoid system: possible role in the immunea response. European Journal of Biochemistry. 267(16): 4917-4927. Doi: 10.1046/j.1432-1327.2000.01550.x
Silvestro, S., Schepici, G., Bramanti, P., et al. (2020). Molecular targets of cannabidiol in experimental models of neurological disease. Molecules. 25(21):5186.
Singla, R.K., Guimarães, A.G., y Zengin, G. (2021). Application of plant secondary metabolites to pain neuromodulation. Frontiers in Pharmacology. 11:623399.
Turner, S.E., Williams, C.M., Iversen, L., et al. (2017). Molecular Pharmacology of Phytocannabinoids. Progress in the Chemistry of Organic Natural Products. Vol 103. Springer, Cham. Doi: 10.1007/9783319-45541-9_3
World Health Organization. (2018). Cannabidiol (CBD) Critical review report, expert committee on drug dependence. Expert Committee on Drug Dependence Fortieth Meeting. Disponible en: https://www.who.int/docs/default-source/controlled-substances/whocbdreportmay2018-2.pdf?sfvrsn=f78db177_2
Wood, T.B., Spivey, W.N., y Easterfield, T.H. (1896). XL.-Charas. The resin of Indian hemp. Journal of the Chemical Society, Transactions.69:5395-46.
Zuardi, A.W. (2006). History of Cannabis as a medicine: a review. Braz J Psiquiatria. 28(2):153-7. Doi: 10.1590/s1516-44462006000200015.