Persistencia de microorganismos en el ambiente hospitalario
Adrián Martínez-Meléndez*, Francisca Espiricueta-Candelaria*, Flora Cruz-López*
CIENCIA UANL / AÑO 26, No.119, mayo-junio 2023
Los microorganismos nos rodean en todo momento, incluso interactuamos con muchos de ellos en armonía y obtenemos beneficios de este proceso (Peterson et al., 2009). Sin embargo, pueden comportarse como patógenos, es decir, como causantes de infecciones en circunstancias especiales (Pendleton et al., 2013). Hay algunas características que favorecen su persistencia en superficies de alto contacto, a pesar de realizar desinfección y limpieza. Esta cuestión es de particular relevancia en hospitales, donde pueden persistir durante lapsos prolongados y son difíciles de eliminar del ambiente, lo que puede contribuir a su propagación entre pacientes (Jung et al., 2019).
DIFERENCIAS ENTRE COLONIZACIÓN, INFECCIÓN Y ENFERMEDAD
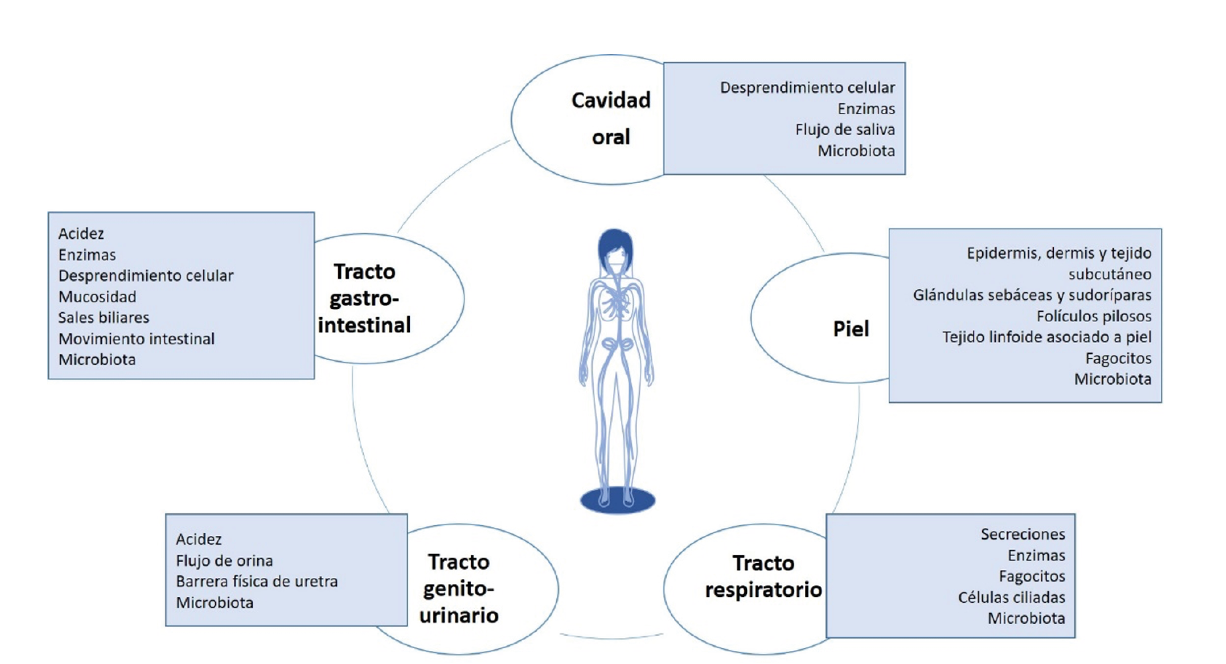
El concepto de “colonización” se refiere al hecho de que los microbios pueden sobrevivir de manera persistente en una superficie corporal, lo cual no necesariamente implica que haya una infección (Pendleton et al., 2013). Por otro lado, la infección implica un crecimiento y replicación de éstos tal que sobrepasan las barreras de defensa del individuo (figura 1) y provocan daños a los tejidos del hospedero, mientras que la enfermedad surge por alteraciones del estado fisiológico debido a los daños causados, ocasionando signos y síntomas asociados (Hall, 2013). La colonización puede ser el primer paso requerido para el desarrollo de una infección o enfermedad (Magill et al., 2014).
De manera similar, hay microorganismos que sobreviven y forman parte del ambiente hospitalario (superficies inanimadas) por periodos prolongados, y debido a esto tienen la oportunidad de colonizar a pacientes vulnerables (con catéteres, bajo tratamiento con antibióticos, con cirugías recientes, inmunosuprimidos, etcétera), lo cual eleva la probabilidad de desarrollar una infección (Jung et al., 2019). En una investigación reciente por nuestro grupo de trabajo se observó la recuperación constante de aislamientos de Klebsiella pneumoniae, Acinetobacter baumannii, Enterobacter cloacae, Enterococcus faecium y otras especies patógenas durante 45 días, a partir de mesas, barandales de cama, catéteres, tubos de ventilación mecánica y otras superficie (Cruz-López et al., 2021).
TRANSMISIÓN DE PATÓGENOS
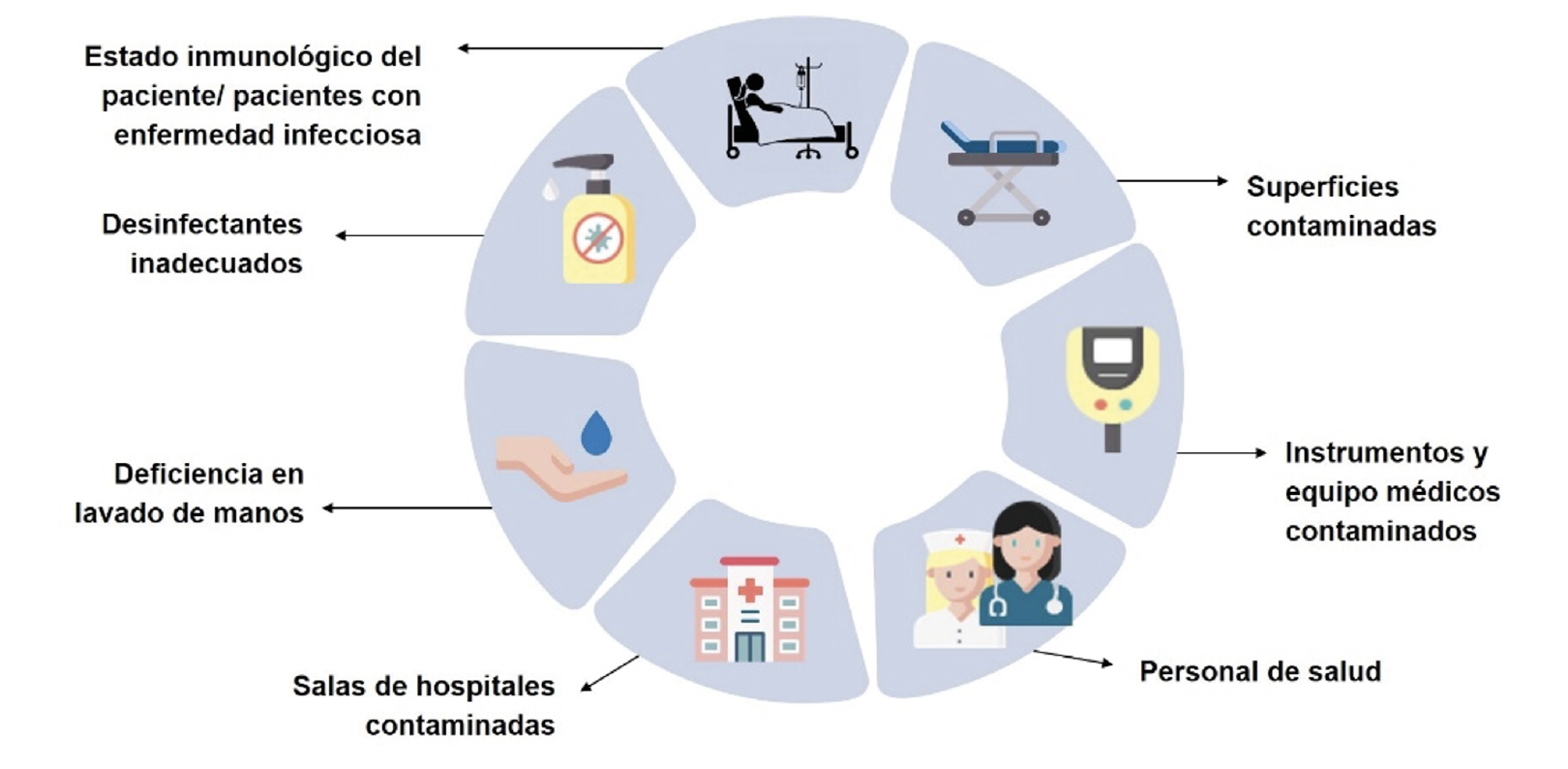
El personal de salud y de limpieza juega un rol importante en la transmisión y propagación, ya que día a día interactúan con superficies contaminadas y tienen contacto directo con pacientes (tras exploraciones físicas, baños húmedos, inserción de catéteres, etcétera) o con los dispositivos y equipos médicos (termómetros, estetoscopios), así como ropa de cama (Omololu, 2017). Lo anterior, aunado a un deficiente lavado de manos, el uso de desinfectantes inadecuados o la mala ejecución en las técnicas de desinfección de superficies y equipo médico, propician la propagación hacia otras superficies y salas, convirtiendo al centro de salud en el lugar adecuado para que diversos microorganismos pueden prevalecer y diseminarse (Jung et al., 2019) (figura 2).
En un trabajo sobre el proceso de colonización de pacientes infectados, observamos la recuperación de los agentes causales en manos y otras superficies corporales de enfermeros con estrecho contacto con los pacientes monitoreados (Cruz-López et al., 2020). Los pacientes infectados actúan como una fuente de diseminación de patógenos para otras personas hospitalizadas; en nuestro estudio de colonización de pacientes, observamos que aislamientos de K. pneumoniae y A. baumannii recuperados de muestras clínicas fueron posteriormente aislados de sitios ambientales cercanos a los enfermos infectados durante su estancia (Cruz-López et al., 2020). Asimismo, el estado del sistema inmune del paciente contribuye al desarrollo de infecciones y enfermedades (Jung et al., 2019) (figura 2).
LAS INFECCIONES ASOCIADAS A LA ATENCIÓN DE LA SALUD:
UN PROBLEMA UNIVERSAL DE SALUD PÚBLICA
Las infecciones asociadas a la atención de la salud (IAAS) se desarrollan en los pacientes hospitalizados o que se encuentran en unidades de atención médica, y son causadas por microbios que provienen del mismo ambiente hospitalario o de otras personas infectadas. Las IAAS aparecen después de 48 horas del ingreso al hospital, siendo las más comunes las de vías urinarias asociadas a catéter (IVU), las neumonías asociadas a ventilador (NAV), infecciones del torrente sanguíneo asociadas a catéter venoso central (BAC) e infecciones de heridas quirúrgicas (IHQ) (Klevens et al., 2008).
MICROORGANISMOS QUE CAUSAN INFECCIONES
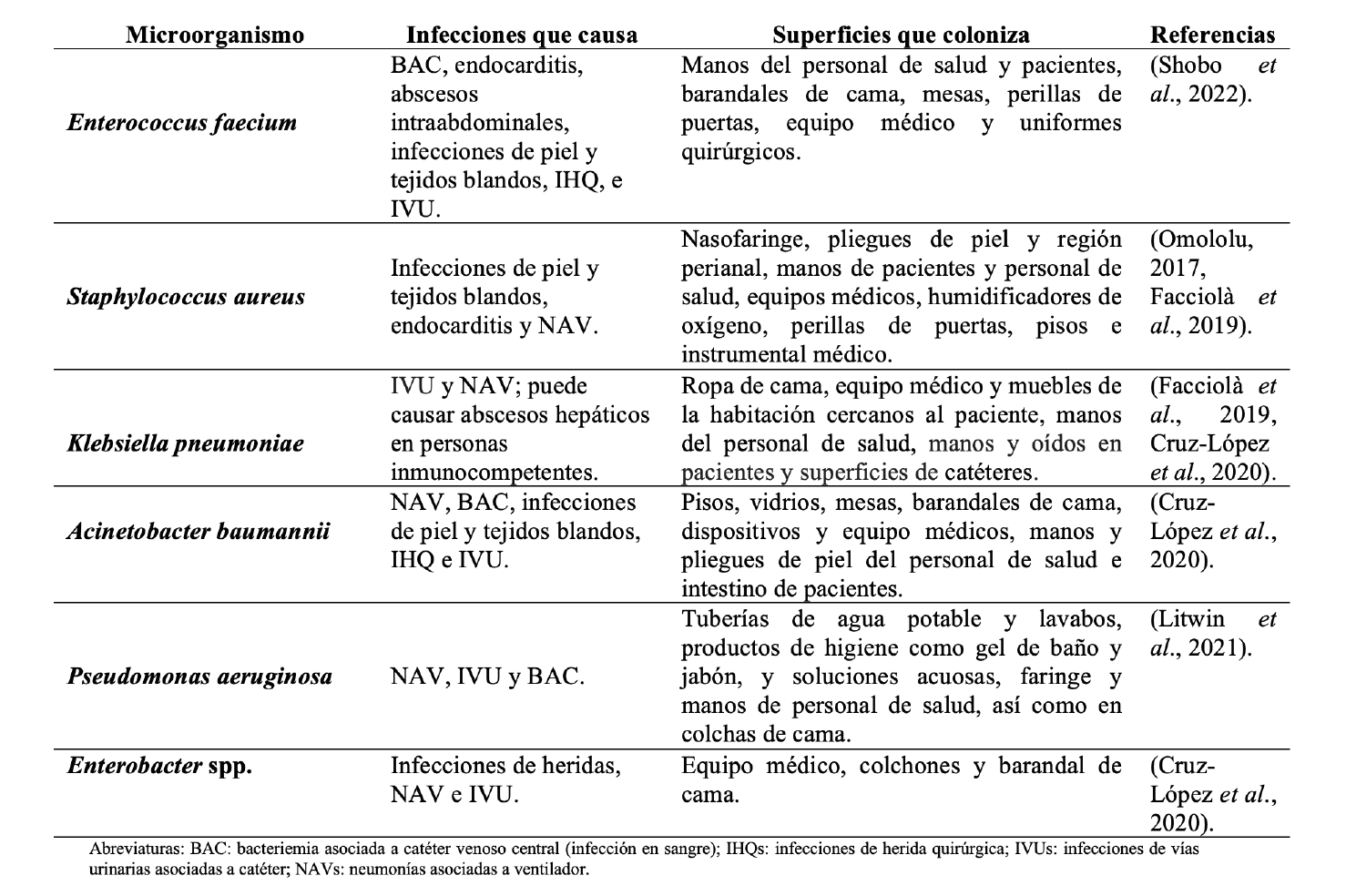
El grupo conformado por las bacterias E. faecium, Staphylococcus aureus, K. pneumoniae, A. baumannii, Pseudomonas aeruginosa y especies de Enterobacter, fue descrito por primera vez en 2008, y se le nombró «ESKAPE” (utilizando las iniciales de la notación científica), debido a su habilidad para “escapar” de la acción de los antibióticos. Las bacterias ESKAPE han cobrado importancia a nivel mundial en los hospitales, ya que con frecuencia son agentes causales de IAAS que se diseminan fácilmente en hospitales y presentan resistencia a los antibióticos (Pendleton et al., 2013). En la tabla I se enlistan algunas de las infecciones que se asocian con frecuencia a cada especie del grupo ESKAPE, así como los sitios del ambiente hospitalario donde se ha reportado su persistencia.
FACTORES QUE FAVORECEN LA PERSISTENCIA DE LOS MICROORGANISMOS
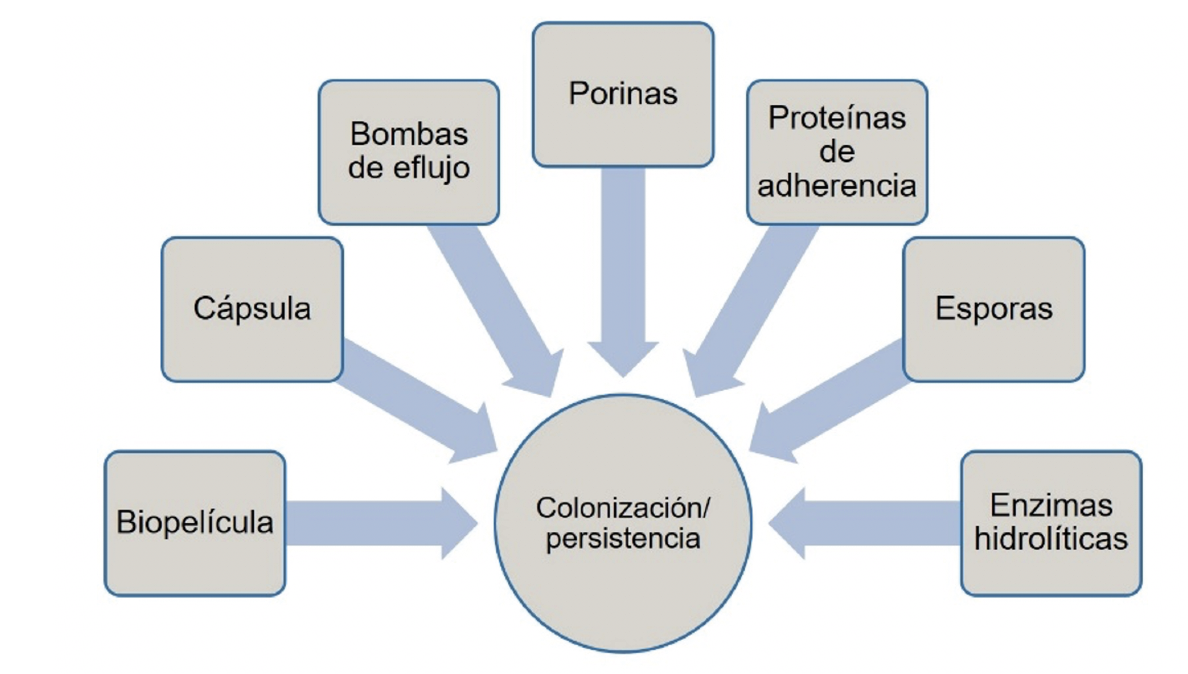
Las bacterias, incluyendo al grupo ESKAPE, cuentan con características o estructuras microbiológicas que les permiten permanecer en superficies diversas (Jung et al., 2019) (figura 3). Entre otras encontramos su capacidad de producir biopelícula tanto en superficies húmedas (por ejemplo, la pared de un catéter, superficies de prótesis insertados en pacientes, tubos de endoscopios y heridas) como en superficies secas (Otter et al., 2015). Las biopelículas son comunidades bacterianas conformadas por una o más especies diferentes, unidas entre sí por una sustancia producida por los mismos microorganismos denominada exopolisacáridos. Esta estructura les permite permanecer en comunicación y persistir por tiempos prolongados ante condiciones de estrés y desecación; además, se asocian al desarrollo de IAAS difíciles de tratar ya que muestran mayor resistencia a la actividad de los antibióticos (Otter et al., 2015).
Otra estructura bacteriana es la cápsula, que afecta la terapia antimicrobiana en pacientes infectados. La producción de cápsula se ha observado con mayor frecuencia en aislamientos ambientales, y favorece la adaptación de estos microbios a la desecación y a la colonización de los pacientes (Rendueles et al., 2017).
Las esporas producidas por bacterias como Clostridioides difficile, permiten la supervivencia en un estado metabólico inactivo cuando las condiciones ambientales no son favorables, por lo que es posible que persistan durante años en diferentes superficies. Estas estructuras se pueden diseminar fácilmente por el ambiente hospitalario y contaminar ropa de cama, tubos de endoscopios y otras superficies que entran en contacto directo con los pacientes. Las esporas, una vez que encuentran las condiciones ideales para mantenerse adecuadamente (por ejemplo, en mucosa intestinal en el caso de C. difficile), dan lugar a células vegetativas que pueden establecer una infección (Rendueles et al., 2017).
La persistencia de los microorganismos patógenos puede también atribuirse al fenómeno de resistencia a los antibióticos, la cual puede deberse a diferentes mecanismos, entre ellos podemos mencionar la producción de enzimas hidrolíticas que degradan las moléculas de los antibióticos y la producción de proteínas que conforman complejos denominados porinas y bombas de eflujo, los cuales permiten la entrada de sustancias diversas (incluyendo antibióticos y desinfectantes) a las células bacterianas y su expulsión inmediata, antes de que actúen en los microorganismos (Li y Nikaido, 2009, Jung et al., 2019).
Asimismo, las proteínas de adherencia, conocidas como adhesinas, contribuyen a la colonización bacteriana en superficies corporales, principalmente en aquéllas con exposición a fluidos o líquidos (por ejemplo, el tracto gastrointestinal y las vías urinarias). Entre las adhesinas encontramos las fimbrias o pilis, los cuales se unen a receptores específicos en células epiteliales; de esta forma, las bacterias permanecen unidas a los tejidos de piel y mucosas (Vila et al., 2008).
ESTRATEGIAS PARA EL CONTROL O ELIMINACIÓN DE BACTERIAS PATÓGENAS EN SUPERFICIES HOSPITALARIAS
Diversas estrategias se han propuesto para controlar la propagación de microorganismos en el ambiente hospitalario, entre ellas: 1) la implementación de programas para la prescripción controlada de antibióticos (Cheon et al., 2016), 2) la búsqueda de patógenos a través de cultivos de vigilancia microbiológica en pacientes, personal de salud y sitios ambientales (Thatrimontrichai y Apisarnthanarak, 2020), 3) el aislamiento de pacientes infectados (Perencevich et al., 2004), 4) la capacitación del personal de salud y limpieza para desinfección de superficies con soluciones de hipoclorito de sodio o con peróxido de hidrógeno aerolizado (Lerner et al., 2020), 5) la aplicación de baños antisépticos para pacientes con clorhexidina (Fan et al., 2019, Martínez-Reséndez et al., 2022), y 6) el apego a las técnicas de lavado de manos para personal de salud (Muscarella, 2014).
CONCLUSIÓN
Las IAAS son un problema de salud pública asociado a elevadas tasas de mortalidad y comorbilidades. Los microorganismos responsables de IAAS normalmente se encuentran sobre superficies de hospitales, dispositivos médicos y superficies corporales del personal de salud y de los pacientes internados. Dado que la colonización es un paso previo en el desarrollo de infecciones y enfermedades, es de importancia reconocer los sitios que actúan como fuente de patógenos para trazar estrategias que eviten su transmisión hacia otras superficies, salas o habitaciones contiguas, y a otros pacientes hospitalizados. Las medidas de higiene en los hospitales siguen siendo igual de importantes para evitar la contaminación de superficies y pacientes, y la comprensión del proceso de colonización en el ambiente ayudaría eficazmente a interrumpir el desarrollo de IAAS oportunamente.
* Universidad Autónoma de Nuevo León, San Nicolás de los Garza, México.
Contacto: flora.cruz@live.com
REFERENCIAS
Cheon, S., Kim, M.J., Yun, S.J., et al. (2016). Controlling endemic multidrug-resistant Acinetobacter baumannii in Intensive Care Units using antimicrobial stewardship and infection control. Korean J Intern Med. 31:367-74.
Cruz-López, F., Villarreal-Treviño, L., Morfin-Otero, R., et al. (2021). Microbial diversity and colonization patterns of two step-down care units from a tertiary care hospital. J Res Med Sci. 26:126.
Cruz-López, F., Villarreal-Treviño, L., Morfin-Otero, R., et al. (2020). Dynamics of colonization in patients with health care-associated infections at step-down care units from a tertiary care hospital in México. American Journal of Infection Control. 48(11):1329-1335. Doi: 10.1016/j.ajic.2020.04.016
Facciolà, A., Pellicanò, G.F., Visalli, G., et al. (2019). The role of the hospital environment in the healthcare-associated infections: a general review of the literature. Eur Rev Med Pharmacol Sci. 23:1266-1278.
Fan, C.Y., Lee, W.T., Hsu, T.C., et al. (2019). Effect of chlorhexidine bathing on colonization or infection with Acinetobacter baumannii: a systematic review and meta-analysis. J Hosp Infect. 103 : 284-292 .
Hall, G.S. (2013). Bailey & Scott’s Diagnostic Microbiology, 13th Edn. Laboratory Medicine. 4 4:e138-e139.
Jung, S.H., Ryu, C.M., y Kim, J.S. (2019). Bacterial persistence: Fundamentals and clinical importance. J Microbiol. 57:829-835.
Klevens, R.M., Edwards, J.R., y Gaynes, R.P. (2008). The impact of antimicrobial-resistant, health care-associated infections on mortality in the United States. Clin Infect Dis. 47:9273-0.
Lerner, A.O., Abu-Hanna, J., Carmeli, Y., et al. (2020). Environmental contamination by carbapenem-resistant Acinetobacter baumannii: The effects of room type and cleaning methods. Infect Control Hosp Epidemiol. 41:166-171.
Li, X.-Z., y Nikaido, H. (2009). Efflux-mediated drug resistance in bacteria: an update. Drugs. 69:1555-1623.
Litwin, A., Rojek, S., Gozdzik, W., et al. (2021). Pseudomonas aeruginosa device associated – healthcare associated infections and its multidrug resistance at intensive care unit of University Hospital: polish, 8.5-year, prospective, single-centre study. BMC Infect Dis. 21:180.
Magill, S.S., Edwards, J.R., Bamberg, W., et al. (2014). Multistate point-prevalence survey of health care-associated infections. N Engl J Med. 370:1198-208.
Martínez-Reséndez, M.F., Cruz-López, F., Gaona-Chávez, N., et al. (2022). The effect of chlorhexidine on Acinetobacter baumannii in intensive care units. Iran J Microbiol. 14:15-23.
Muscarella, L.F. (2014). Risk of transmission of carbapenem-resistant Enterobacteriaceae and related “superbugs” during gastrointestinal endoscopy. World J Gastrointest Endosc. 6:457-74.
Omololu, J. (2017). Staphylococcus aureus Surface Colonization of Medical Equipment and Environment, Implication in Hospital-Community Epidemiology. J Hosp Med Manage. 3.
Otter, J.A., Vickery, K., Walker, J.T., et al. (2015). Surface-attached cells, biofilms and biocide susceptibility: implications for hospital cleaning and disinfection. J Hosp Infect. 89:16-27.
Pendleton, J.N., Gorman, S.P., y Gilmore, B.F. (2013). Clinical relevance of the ESKAPE pathogens. Expert Rev Anti Infect Ther. 11:2973-08.
Perencevich, E.N., Fisman, D.N., Lipsitch, M., et al. (2004). Projected benefits of active surveillance for vancomycin-resistant enterococci in intensive care units. Clin Infect Dis. 38:1108-15.
Peterson, J., Garges, S., Giovanni, M., et al. 2009. The NIH Human Microbiome Project. Genome Res. 19:2317-23.
Rendueles, O., García-Garcerà, M., Néron, B., et al. (2017). Abundance and co-occurrence of extracellular capsules increase environmental breadth: Implications for the emergence of pathogens. PLoS Pathog. 13:e1006525.
Shobo, C.O., Essack, S.Y., y Bester, L.A. (2022). Enterococcal contamination of hospital environments in KwaZulu-Natal, South Africa. J Appl Microbiol. 132:654-664.
Thatrimontrichai, A., y Apisarnthanarak, A. (2020). Active surveillance culture program in asymptomatic patients as a strategy to control multidrug-resistant gram-negative organisms: What should be considered? J Formos Med Assoc. 119:1581-1585.
Vila, J., Soriano, A., y Mensa, J. (2008). Molecular basis of microbial adherence to prosthetic materials. Role of biofilms in prosthesis-associated infection. Enferm Infecc Microbiol Clin. 26:485-4; quiz 55.