LAS SERPINAS, ¿ALIADOS MOLECULARES O ENEMIGOS FURTIVOS?
CIENCIA UANL / AÑO 25, No.114, julio-agosto 2022
LUIS JESÚS CORTEZ-DE LA FUENTE*, JOSÉ PRISCO PALMA-NICOLÁS*
Serpina, un concepto que podría resultar lejano a nuestra concepción, pero demasiado cercano para el cuerpo humano. Resulta ser un acrónimo en inglés para designar a una de las familias más grandes de inhibidores de proteasas de serina, llamadas así ya que el aminoácido serina, junto con el aspartato y la histidina, forman una triada catalítica. Se encuentran prácticamente en todos los organismos, cerca de 1,500 secuencias se han identificado, de las cuales 36 tienen origen humano (Heit et al., 2013).
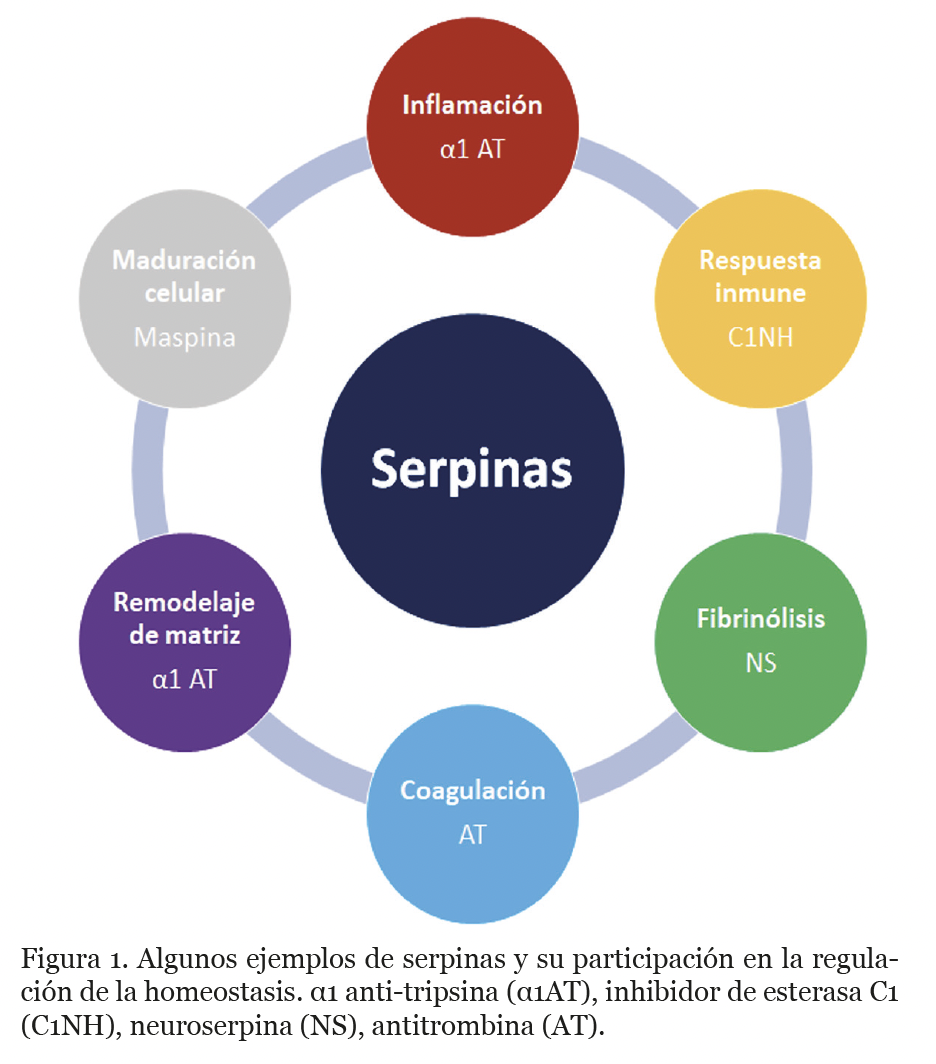
Son muy importantes porque participan en diferentes procesos fundamentales para la fisiología y homeostasis del cuerpo humano: coagulación, inflamación, fibrinólisis (prevención de trombos), respuesta inmune, condensación de cromatina (división celular), supresión de tumores y apoptosis (muerte celular) (Heit et al., 2013) (figura 1).
ESTRUCTURA Y MECANISMO DE INHIBICIÓN
Contrario a otros inhibidores, tienen un mecanismo de acción bastante complejo, el cual depende de la estabilidad y los diferentes tipos de interacción que se llevan a cabo entre la serpina y su molécula objetivo. Las serpinas son largas cadenas peptídicas constituidas por aproximadamente 400 aminoácidos; su peso molecular varía entre los 40 y 100 kilodaltons (kDa), debido a la diferencia en su perfil de glicosilaciones. Por otro lado, su estructura secundaria está integrada por siete a nueve hélices-alfa y tres láminas-beta (Gettins, 2002).
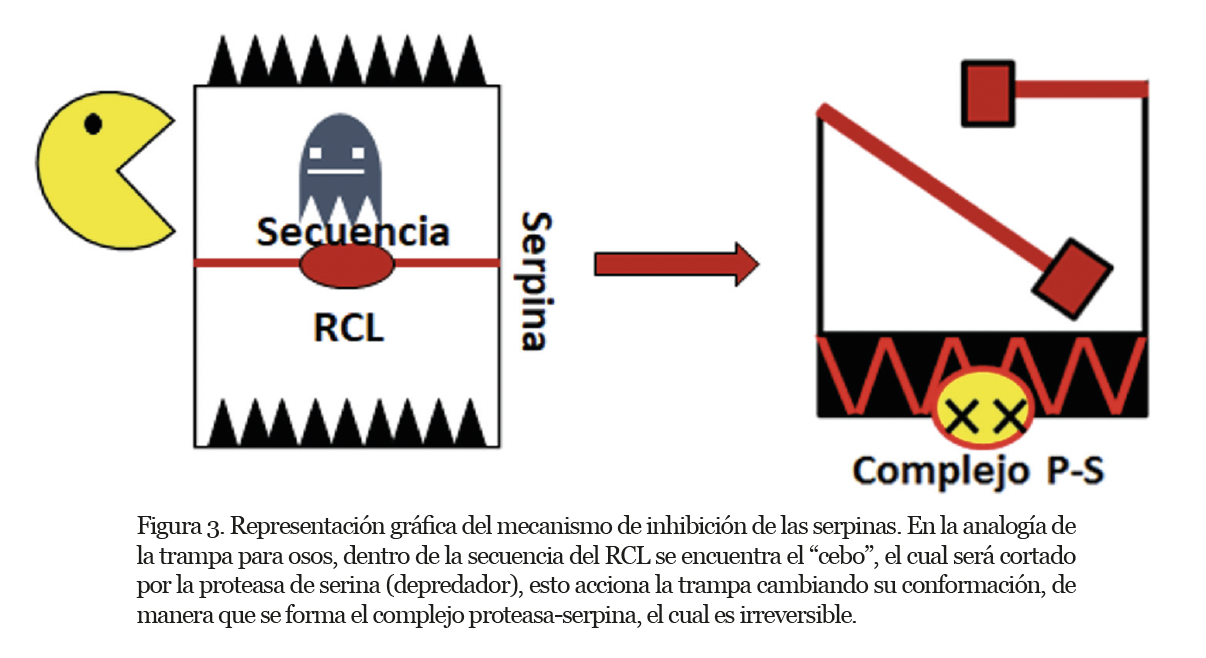
La conformación en la que encontramos a las serpinas en el organismo (nativa) no es del todo estable, por lo que se le suele denominar como estructura metaestable. Los principales motivos estructurales de una serpina son un dominio lámina beta A constituido de cinco hebras y un dominio flexible denominado lazo centro reactivo (RCL), los cuales se encuentran altamente conservados en esta familia. El RCL tiene un sitio que puede ser cortado (P1-P1’), el cual está localizado cerca del extremo C-terminal de la secuencia de aminoácidos. El mecanismo de inhibición requiere de un cambio en la conformación de la serpina nativa (metaestable) a una de mayor estabilidad (figura 2).
Para explicar el mecanismo de inhibición, se puede recurrir a una analogía, siendo la serpina una trampa para osos a nivel molecular. El RCL actúa como cebo y a la vez como un seguro, el dominio de láminas-beta como un cerrojo, mientras que la proteasa de serina representa una presa. Cuando la “presa” muerde el “cebo”, el “seguro” que mantenía la trampa abierta se libera y se introduce dentro del “cerrojo”, lo que desencadena que la “trampa para osos” se mantenga cerrada, atrapando a la “presa” y dejándola sin escapatoria (figura 3). Estos eventos culminan con la formación de un complejo serpina-proteasa de serina estable y una proteasa de serina imposibilitada, ya que es incapaz de disociarse de la trampa para osos.
FUNCIÓN BIOLÓGICA DE LAS SERPINAS
Como ya se mencionó, la familia de las serpinas es muy grande y bastante variada, tanto en estructura como en función. Dentro de las más importantes se encuentran la alfa-1 antitripsina y la neuroserpina, las cuales participan en los procesos de inflamación y axogénesis y sinaptogénesis (formación de red neuronal), respectivamente; cualquier anomalía en su estructura resultaría en serpinopatías muy graves.
Alfa-1 antitripsina (α1AT) es una glicoproteína de 52 kDa codificada por el gen SERPINA1 (Heit et al., 2013). Es producida por macrófagos, enterocitos, epitelio de la córnea, células alveolares e incluso células cancerígenas, pero principalmente en los hepatocitos (70-80%). En eventos infecciosos o inflamatorios, los niveles de α1AT pueden incrementarse en respuesta a citocinas inflamatorias sintetizadas por los macrófagos como IL-6, IL-1 o TNF-alfa (Knoell et al., 1998). Como inhibidor de proteasas de serina, α1AT tiene la facultad de suprimir la actividad de la elastasa, catepsina G y proteinasa G derivados de los gránulos de los neutrófilos; triptasa y quimasa de mastocitos, granzima B de linfocitos y matriptasa de las células epiteliales (Bergin et al., 2012).
Una de sus funciones biológicas más importantes es la protección que brinda contra el daño colateral ocasionado por la elastasa de los neutrófilos (NE). NE es una enzima proteolítica muy destructiva que degrada la matriz extracelular y modula la inflamación y el remodelado de los tejidos (Polverino et al., 2017). Si no es inhibida apropiadamente por la α1AT, podría tener consecuencias irreversibles en los tejidos, como el pulmonar, y afectar la capacidad aeróbica del individuo afectado.
La neuroserpina (NS) es una glicoproteína de 55 kDA codificada por el gen SERPINI1 y es sintetizada en el hígado y por las neuronas de los sistemas nervioso central y periférico (Heit et al., 2013; Caccia et al., 2010). Tiene un rol sumamente importante en el desarrollo del sistema nervioso, ya que participa en la generación de los axones, la formación de sinapsis (conexiones neuronales), así como la plasticidad sináptica. La NS es capaz de inhibir el activador plasminogénico tipo-tejido (tPA), una proteasa de serina muy importante en el proceso de fibrinólisis (degradación de trombos). También participa en la protección contra la isquemia cerebral, al prevenir la muerte de las células neuronales.
SERPINOPATÍAS
Las serpinas juegan un papel muy importante en diversos procesos fisiológicos, así como en la regulación de la homeostasis, por lo que cualquier disrupción en su estructura o alguna deficiencia en sus funciones podrían ser letales. Cualquier mutación en su secuencia aminoacídica puede resultar en un mal plegamiento de la proteína o en la formación de estructuras inestables con pobre o nula capacidad inhibitoria. La serpina producto de cualquier mutación puede presentar dos caminos: ser secretada como una enzima con actividad biológica limitada o, en su defecto, ser retenida en el retículo endoplásmico, formando polímeros de serpinas.
Existen muchos mecanismos moleculares involucrados en la formación de estos polímeros, pero lo más común es la formación de uniones-beta por medio de puentes de hidrógeno entre los lazos peptídicos y las láminas beta de dos serpinas.
La deficiencia de α1AT es definida como un desorden hereditario autosómico que ocasiona la producción de la serpina de forma poco eficiente. El gen SERPINA1 es susceptible a mutaciones que afectan la estabilidad conformacional de la estructura del dominio de las láminas-beta, lo que resulta en la polimerización de α1AT. Esto se traduce en una disminución de su actividad inhibitoria en el torrente sanguíneo y en la acumulación de polímeros de α1AT no funcionales en el hígado. Estos agregados se vuelven tóxicos para los hepatocitos, produciendo cirrosis hepática; y la pérdida del efecto antinflamatorio de ATT puede predisponer enfisema pulmonar en fumadores (Ekeowa et al., 2009). La enfermedad de la obstrucción pulmonar crónica (COPD) y la cirrosis hepática son las serpinopatías más asociadas con la deficiencia de α1AT, y en menormedida pancreatitis, paniculitis, glomerulonefritis y enfermedades vasculares diversas. La COPD se caracteriza por destrucción alveolar, sobreproducción de moco e inflamación crónica.
Las mutaciones en NS conducen a enfermedades severas degenerativas, resultando en muerte neuronal y demencia, un cuadro patológico conocido como encefalopatía familiar con cuerpos de inclusión (FENIB). Es interesante que los polimorfismos S49P y H338R en el gen SERPINI1 sean homólogos con los encontrados en α1AT (S53F y H338R) que ocasionan daño hepático, lo que sugiere un mecanismo molecular de acción similar (Roussel et al., 2011). La FENIB se caracteriza por inclusiones neuronales eosinofílicas de NS en la capa más profunda de la corteza cerebral y en la substancia nigra. Estos cuerpos de inclusión se forman por el entrecruzamiento de los polímeros de NS, los cuales comparten ciertas similitudes con las estructuras que se forman cuando hay deficiencia de α1AT.
CONCLUSIÓN
Las serpinas forman parte de una familia de inhibidores de proteasas de serina muy poco conocida. Su importancia radica en la participación que tienen en procesos fisiológicos como la inflamación, respuesta inmune, coagulación, entre otros. Dentro de las serpinas más estudiadas se encuentra la Alfa-1 antritripsina, que permite la regulación de los procesos inflamatorios, y la neuroserpina, la cual se encuentra involucrada en la generación de nuevas conexiones nerviosas. Es evidente la importancia de las serpinas, por lo que son aliadas moleculares que permiten el control de la homeostasis. Sin embargo, la otra cara de la moneda radica en las mutaciones que estos inhibidores pudieran presentar, como es el caso de una inflamación exacerbada en la α1AT, o demencia en el caso de NS. Si bien las serpinopatías son poco frecuentes, el estudio en este campo poco explorado podría mejorar el diagnóstico oportuno de este tipo de enfermedades y el desarrollo de tratamientos más eficaces contra estas anormalidades.
* Universidad Autónoma de Nuevo León, Monterrey, México.
Contacto: luisjcortezdlf88@hotmail.com
REFERENCIAS
Bergin, D.A., Hurley, K., Mcelvaney, N.G., et al. (2012). Alpha-1 antitrypsin: a potent antiinflammatory and potential novel therapeutic agent. Arch Immunol Ther Exp (Warsz). 60:81-97.
Caccia, S., Ricagno, S., y Bolognesi, M. (2010). Molecular bases of neuroserpin function and pathology. Biomol Concepts. 1:117-30.
Ekeowa, U.I., Gooptu, B., Belorgey, D., et al. (2009). Alpha1-Antitrypsin deficiency, chronic obstructive pulmonary disease and the serpinopathies. Clin Sci (Lond). 116:837-50.
Gettins, P.G. (2002). Serpin structure, mechanism, and function. Chem Rev. 102:4751-804.
Heit, C., Jackson, B.C., Mcandrews, M., et al. (2013). Update of the human and mouse SERPIN gene superfamily. Hum Genomics. 7(1):22.
Knoell, D.L., Ralston, D.R., Coulter, K.R., et al. (1998). Alpha 1-antitrypsin and protease complexation is induced by lipopolysaccharide, interleukin-1 β, and tumor necrosis factor-α in monocytes. American Journal of Respiratory and Critical Care Medicine. 157:246-255.
Polverino, E., Rosales-Mayor, E., Dale, G.E., et al. (2017). The Role of Neutrophil Elastase Inhibitors in Lung Diseases. Chest. 152:249-262.
Roussel, B.D., Irving, J.A., Ekeowa, U.I., et al. (2011). Unravelling the twists and turns of the serpinopathies. FEBS J. 278:3859-67.