¿qué se te perdió aquí? Metaloproteasas de matriz en el núcleo celular
CIENCIA UANL / AÑO 25, No.114, julio-agosto 2022
MARIEL MALDONADO*
Las enzimas capaces de cortar una proteína reciben el nombre de proteasas. Estas biomoléculas regulan una amplia variedad de procesos a nivel celular y de todo el organismo, ya sea por la degradación completa de su sustrato, por el procesamiento específico y limitado del mismo, o bien por el rasurado (shedding en inglés) de ectodominios y liberación de péptidos que pueden desempeñar una función diferente (Pardo et al., 2008). Las proteasas se encuentran en los tres dominios de la vida: archaea, eubacteria y eukarya. Dada su importancia, se ha denominado como “degradoma” al conjunto de proteasas que se expresan en un momento en parti- cular en una célula, tejido u organismo (López-Otín y Overall, 2002). Se clasifican de acuerdo con el aminoácido de su sitio activo en cisteínproteasas, aspartilproteasas, serínproteasas, treonínproteasas, glutamilproteasas y metaloproteasas (Ugalde et al., 2010).
Una de las mejores bases de datos en cuanto a este tipo de enzimas es MEROPS, la cual con frecuencia es actualizada (Rawlings et al., 2018). Por ejemplo, apenas el 11 de septiembre de 2020 agregaron tres familias más de glutamilproteasas, dos de las cuales se habían considerado metaloproteasas; sin embargo, estudios recientes indicaron que el ion metálico cumplía una función estructural y no catalítica (https://www.ebi.ac.uk/merops/index.shtml).
Usualmente, las metaloproteasas tienen un ion de zinc que permite la proteólisis al polarizar una molécula de agua; esta clase de proteasas es la más numerosa en muchos organismos, incluyendo a los mamíferos. El ion de zinc suele estar coordinado con el esqueleto polipeptídico a través de dos histidinas y un tercer residuo que puede ser aspártico, glutámico o una tercer histidina. De esta manera se subdividen en tres grupos: aspazincinas, gluzincinas y metzincinas, que no necesariamente corresponden con ese tercer residuo. La clasificación continúa y se complica en numerosos clanes y familias. Sin embargo, para los fines del presente escrito me centraré en una de las familias: la M10, que corresponde a las matrixinas o metaloproteasas de matriz (MMPs) (Pardo et al., 2008; Ugalde et al., 2010).
Las MMPs, al igual que otras proteasas, se sintetizan como zimógenos o precursores inactivos, esto significa que para tener a la enzima activa se le debe cortar un pequeño fragmento que deja al descubierto el sitio activo. En ocasiones, esa activación se facilita con un cambio conformacional inducido por un agente caotrópico, mercurial, especie reactiva de oxígeno, detergente, o se puede observar la activación alostérica en la que no necesariamente se elimina el prodominio, sino que se puede lograr una modificación en el plegamiento, debido a la interacción con otras moléculas, lo que permite que se exhiba el sitio activo (Hadler-Olsen et al., 2011).
Hay muchos niveles de regulación de las MMPs, desde la transcripción, que puede ser estimulada por factores de crecimiento, hormonas, interacción con otras células o con la matriz extracelular (MEC). La regulación postranscripcional incluye estabilidad del mRNA, eficiencia de traducción, regulación por microRNAs y, finalmente, después de la traducción, la ac- tivación del zimógeno pude ocurrir intracelularmente, en la membrana, o bien después de ser secretada en el espacio extracelular, donde puede ser inhibida por diversas proteínas y péptidos (Gaffney et al., 2015).
La estructura general de las MMPs comprende el prodominio que las mantiene como zimógenos, el dominio catalítico, una región tipo bisagra y un dominio C-terminal tipo hemopexina. Algunas pueden ser reconocidas por proprotein convertasas, como la furina, para su activación intracelular. La mayoría son de secreción extracelular, otras son conocidas como tipo-membrana, ya sea por contar con un dominio transmembranal o por estar ancladas a la membrana plasmática mediante glicosilfosfatidilinositol. En el extremo amino se encuentra una secuencia corta de aminoácidos que se conoce como péptido señal y las identifica como enzimas de secreción, por lo que se sintetizan en el retículo endoplásmico para posteriormente ser llevadas al aparato de Golgi y de ahí a la membrana o al espacio extracelular (Hadler-Olsen et al., 2011).
Tradicionalmente, las MMPs se consideraban enzimas que actuaban únicamente sobre elementos de la MEC o mediadores asociados a la MEC. Se sugirió que las enfermedades fibróticas son producto del de- sequilibrio en la degradación y el depósito de MEC. No obstante, algunas MMPs se han reportado altamente expresadas en enfermedades fibróticas, lo cual pareciera contradictorio, pero un punto fundamental es la localización y actividad de las enzimas. Para ahondar en este punto se pueden consultar revisiones que abordan el papel patofisiológico de las MMPs en enfermedades fibrosantes, en las que algunas enzimas participan evitando y otras promoviendo la acumulación de MEC (Pardo et al., 2016; Afratis et al., 2018). En otras enfermedades se ha visto que, dependiendo de la MMP, el órgano y la etapa del padecimiento, su función puede ser benéfica, perjudicial o presentar un efecto nulo. Estas enfermedades incluyen diversos tipos de cáncer, enfermedades neurodegenerativas y cardiovasculares, entre otras. Si se desea profundizar al respecto, se puede consultar la revisión de Raeeszadeh-Sarmazdeh, Do y Hritz, donde además discuten los estudios clínicos con inhibidores de MMPs (Raeeszadeh-Sarmazdeh et al., 2020).
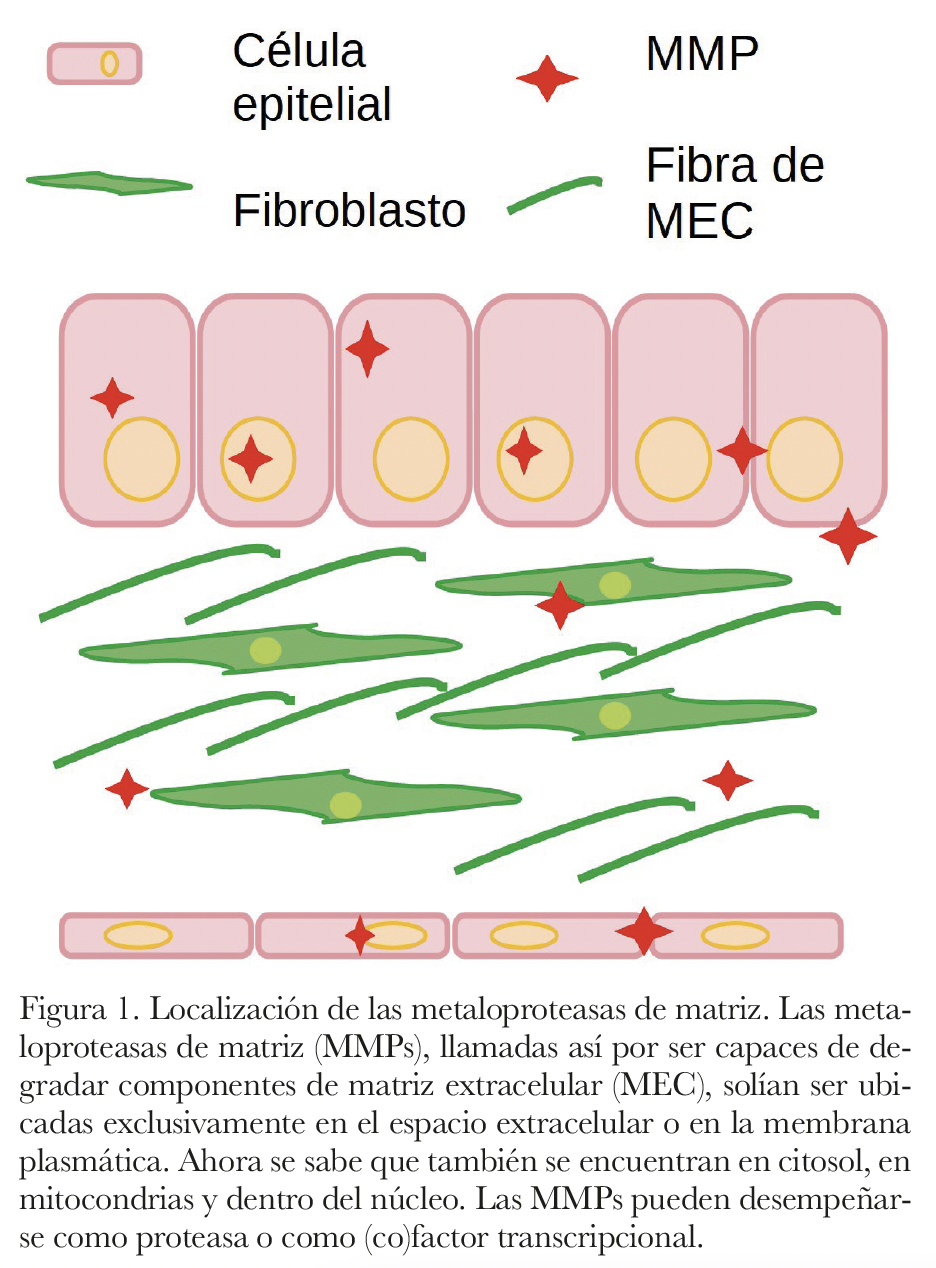
Con los años se encontró que las MMPs, además, son capaces de activar moléculas residentes de la MEC como factores de crecimiento y citocinas. Recientemente se ha demostrado que las MMPs, aparte de desempeñar diversas funciones extracelulares, se pueden encontrar activas dentro de la célula e incluso dentro del núcleo, si bien sus funciones intracelulares aún no están completamente comprendidas. En la figura 1 se presentan las distintas localizaciones que pueden presentar estas enzimas.
En el grupo de trabajo donde realizo investigación nos interesamos por una parte en las enfermedades intersticiales de pulmón y por otra en las metaloproteasas de matriz. En el contexto de la fibrosis pulmonar, hemos estudiado el papel de varias MMPs, por ejemplo: MMP-1 (Herrera et al, 2013), MMP-19 (Jara et al., 2015) y MMP14 o MT1-MMP (Plácido et al., 2021). En mi proyecto de doctorado encontramos a MMP-28 en el núcleo de algunas células de un tipo específico de fibrosis pulmonar, inicialmente fue una sorpresa por inmunohistoquímica, lo verificamos con seis anticuerpos diferentes tanto por inmunofluorescencia como por western blot y por citometría confocal (Maldonado et al., 2018), por ello nos llamó la atención investigar sobre este tema. A continuación presento algunos datos relevantes de MMPs dentro del núcleo celular.
MMP-2 puede encontrarse en el núcleo de cardiomiocitos humanos, donde es capaz de degradar una enzima reparadora de DNA, la poliADP ribosa polimerasa (PARP-1) in vitro (Kwan et al., 2004) e in vivo en neuronas, en las cuales también degrada al factor de reparación XRCC1 (X-ray cross-complementary factor 1) reclutado por PARP-1 durante la reparación por escisióndebases (Yang et al.,2010).MMP-2y-14colocalizaron en núcleo de hepatocitos neoplásicos, sugiriendo que estas enzimas juegan cierto papel en la tumorigénesis del carcinoma hepatocelular (Ip et al., 2007). Deigual forma, en hepatocitos y miofibroblastos en cáncer hepático, se descubrió una forma pequeña de MMP-3 a la cual se le atribuyen funciones proapoptóticas (que favorecen la muerte celular llamada apoptosis) dependientes de actividad catalítica (Si-Tayeb et al., 2006).
Algunas MMP se han localizado en núcleo posteriormente al daño inducido por isquemia y reperfusión (Kwan et al., 2004; Cuadrado et al., 2009; Yang et al., 2010). La isquemia es la disminución transitoria o permanente del flujo sanguíneo, lo cual significa fundamentalmente baja presión parcial de oxígeno (hipoxia), falta de nutrientes y acumulación de desechos. En el tipo de fibrosis donde se encontró MMP28 en el núcleo, se observan condiciones de hipoxia (Aquino-Gálvez y González-Ávila, 2010; Tzouvelekis et al., 2007); sin embargo, cultivar las células en hipoxia, en hipoxia y sin glucosa, o en normoxia y sin glucosa, no induce específicamente la traslocación nuclear de MMP28 (resultados no publicados).
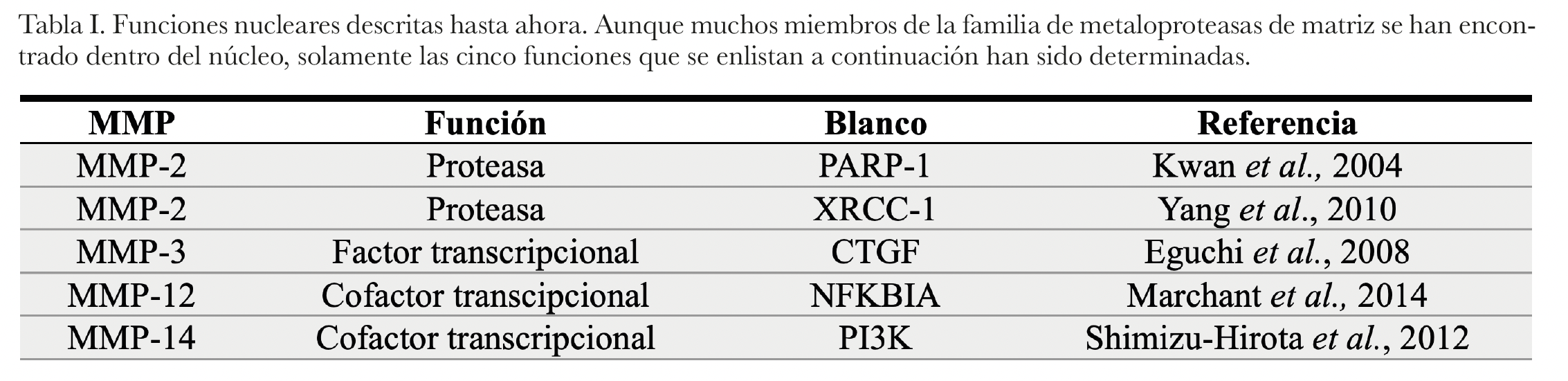
Dentro de lo más interesante, se sabe que además de tener la función ya conocida de proteasas, las MMPs pueden regular la transcripción: MMP-3 puede funcionar como factor transcripcional para el factor de crecimiento del tejido conjuntivo (CTGF), uniéndose directamente a una secuencia dentro del promotor del gen (Eguchi et al., 2008), MMP-12 favorece la transcripción de NFKBIA, un gen que a su vez se traduce en otro factor transcripcional (Marchant et al., 2014) y MMP-14 participa, probablemente como cofactor, en la regulación transcripcional de PI3K, una cinasa importante en señalización celular (Shimizu-Hirota et al., 2012). En la tabla I se resume la información sobre las funciones nucleares conocidas de MMPs.
Los factores transcripcionales son proteínas que se unen a regiones específicas del genoma y promueven o evitan el proceso de transcripción, esto es, el copiado del genoma (DNA) en RNA; un RNA mensajero que viajará al citoplasma para, con ayuda de los ribosomas, traducirse en aminoácidos y conformar una proteína. La activación de un factor transcripcional a veces es resultado de su unión específica a un ligando, otras es resultado de fosforilación, desfosforilación, o alguna otra modificación postraducctional. La mayoría de las ocasiones se unen a otro factor transcripcional o a un cofactor, una proteína que favorece la transcripción, sin unirse directamente al genoma.
Los primeros reportes de MMPs en núcleo terminaban de romper el paradigma que consideraba a estas enzimas como parte del nicho extracelular; sin embargo, una revisión se atreve a postular que probablemente esta familia de proteasas existió primero en el núcleo donde estaba relacionada con la apoptosis y posteriormente se ubicaron en la membrana plasmática donde permanecieron por selección natural (Xie et al., 2017).
CONCLUSIONES
En el caso de MMP-28, las posibilidades de funciones nucleares constituyen una ventana de oportunidad para continuar la investigación, puesto que podría tener la clásica actividad de proteasa, o bien, desempeñarse como algo completamente inesperado para la concepción original de metaloproteasa de matriz: un factor o cofactor transcripcional.
Sin duda, queda mucho por descubrir en el mundo de las MMPs, apenas empezamos la travesía de descifrar qué están haciendo en el núcleo celular. Cada paso que damos en la investigación nos resuelve una o dos preguntas y nos formula varias más. Es emocionante y apasionante descifrar las diversas actividades que llevan a cabo estas enzimas. Sigamos rompiendo paradigmas y descubriendo cada día más sobre las proteínas, cuyas funciones nos van mostrando nuevos caminos de conocimiento en la ciencia básica, al mismo tiempo que nos ofrecen posibilidades de aplicación en la calidad de vida de las personas.
* Instituto Nacional de Enfermedades Respiratorias
Ismael Cosío Villegas, Ciudad de México, México.
Contacto: marielmb@comunidad.unam.mx
REFERENCIAS
Afratis, N.A., Selman, M., Pardo, A., et al. (2018). Emerging insights into the role of matrix metalloproteases as therapeutic targets in fibrosis. Matrix Biol. 68-69:167-179.
Aquino-Gálvez, A., y González-Ávila, G. (2010). El papel del factor inducible por hipoxia 1 (HIF-1) en la fibrosis pulmonar idiopática. Neumol Cir Torax. 69(3):170-177.
Cuadrado, E., Rosell, A., y Borrell-Pages, M., (2009). Matrix metalloproteinase-13 is activated and is found in the nucleus of neural cells after cerebral ischemia. J Cereb Blood Flow Metab. 29:398-410.
Eguchi, T., Kubota, S., Kawata, K., et al. (2008). Novel transcription-factor-like function of human matrix metalloproteinase 3 regulating the CTGF⁄CCN2 gene. Mol Cell Biol. 28:2391-2413.
Gaffney, J., Solomonov, I., Zehorai, E., et al. (2015). Multilevel regulation of matrix metalloproteinases in tissue homeostasis indicates their molecular specificity in vivo. Matrix Biol. 44-46:191-9.
Hadler-Olsen, E., Fadnes, B., Sylte, I., et al. (2011). Regulation of matrix metalloproteinase activity in health and disease. FEBS Journal. 278: 28-45.
Herrera, I., Cisneros, J., Maldonado, M., et al. (2013). Matrix metalloproteinase (MMP)-1 induces lung alveolar epithelial cell migration and proliferation, protects from apoptosis, and represses mitochondrial oxygen consumption. J Biol Chem. 288:25964-25975.
Ip, Y.C., Cheung, S.T., y Fan, S.T. (2007). Atypical localization of membrane type 1-matrix metalloproteinase in the nucleus is associated with aggressive features of hepatocellular carcinoma. Mol Carcinog. 46:225–230.
Jara, P., Calyeca, J., Romero, Y., et al. (2015). Matrix metalloproteinase (MMP)-19-deficient fibroblasts display a profibrotic phenotype. Am J Physiol Lung Cell Mol Physiol. 308(6):L511-22.
Kwan, J.A., Schulze, C.J., Wang W., et al. (2004). Matrix metalloproteinase-2 (MMP-2) is present in the nucleus of cardiac myocytes and is capable of cleaving poly (ADP-ribose) polymerase (PARP) in vitro. The FASEB Journal. 1: 690-692.
López-Otín, C., y Overall, C.M. (2002). Protease degradomics: a new challenge for proteomics. Nat Rev Mol Cell Biol 3. 509-519.
Maldonado, M., Salgado-Aguayo, A., Herrera I., et al. (2018). Upregulation and Nuclear Location of MMP28 in Alveolar Epithelium of Idiopathic Pulmonary Fibrosis. Am J Respir Cell Mol Biol. 59(1):77-86.
Marchant, D.J., Bellac, C.L., Moraes, T.J., et al. (2014). A new transcriptional role for matrix metalloproteinase-12 in antiviral immunity. Nature Med. 20:493-502.
Pardo, A., Cabrera, S., Maldonado, M., et al. (2016). Role of matrix metalloproteinases in the pathogenesis of idiopathic pulmonary fibrosis. Respir Res. 17:23.
Pardo, A., Selman, M., y Kaminski, N. (2008). Approaching the degradome in idiopathic pulmonary fibrosis. Int. J. Biochem. Cell Biol. 40:1141-1155.
Plácido, L., Romero, Y., Maldonado, M., et al. (2021). Loss of MT1- MMP in alveolar epithelial cells exacerbates pulmonary fibrosis. Int. J. Mol. Sci. 22:Aceptado.
Raeeszadeh-Sarmazdeh, M., Do, L.D., y Hritz, B.G. (2020). Metalloproteinases and Their Inhibitors: Potential for the Development of New Therapeutics. Cells. 9(5):1313.
Rawlings, N.D., Barrett, A.J., Thomas, P.D., et al. (2018). The MEROPS database of proteolytic enzymes, their substrates and inhibitors in 2017 and a comparison with peptidases in the PANTHER database. Nucleic Acids Res. 46:D624-D632.
Shimizu-Hirota, R., Xiong, W., Baxter, B.T., et al. (2012). MT1-MMP regulates the PI3Kδ•Mi-2/NuRD-dependent control of macrophage immune function. Genes Dev. 26:395-413.
Si-Tayeb, K., Monvoisin, A., Mazzocco, C., et al. (2006). Matrix metalloproteinase 3 is present in the cell nucleus and is involved in apoptosis. Am J Pathol. 169(4):1390-1401.
Tzouvelekis, A., Harokopos, A., Paparountas, T., et al. (2007). Comparative Expression Profiling in Pulmonary Fibrosis Suggests a Role of Hypoxia-inducible Factor-1a in Disease Pathogenesis. Am J RespirCrit Care Med. 176:1108-1119.
Ugalde, A.P., Ordóñez, G.R., Quirós, P.M., et al. (2010). Metalloproteases and the Degradome. En: Clark I. (eds) Matrix Metalloproteinase Protocols. Methods in Molecular Biology (Methods and Protocols). Vol 622. Humana Press: Totowa, NJ. https://doi.org/10.1007/978-1-60327-299-5
Xie, Y., Mustafa, A., Yerzhan, A., et al. (2017). Nuclear matrix metalloproteinases: functions resemble the evolution from the intracellular to the extracellular compartment. Cell death discovery. 3:17036.
Yang, Y., Candelario-Jalil, E., Thompson, J.F., et al. (2010). Increased intranuclear matrix metalloproteinase activity in neurons interferes with oxidative DNA repair in focal cerebral ischemia. J Neurochem. 112:134-149.