Senescencia, las células caprichosas
JOSELYN SÁNCHEZ-OLIVARES*, MARIEL MALDONADO*
CIENCIA UANL / AÑO 25, No.112, marzo-abril 2022
Los seres vivos estamos formados por células. La célula es la mínima unidad estructural y funcional de los organismos. Los postulados de la teoría celular indican también que cada una surge a partir de otra célula preexistente, la cual se divide en dos (Alberts et al., 2016). En este artículo explicaremos a grandes rasgos el ciclo celular y la senescencia, que es una de las formas en que el ciclo se detiene.
CICLO CELULAR
El ciclo celular está constituido por una serie ordenada de acontecimientos en la cual la célula duplica su contenido y se divide en dos células hijas. La duración del ciclo varía según el tipo celular, siendo la duración media de 24 horas. El ciclo celular está compuesto por interfase y mitosis (o meiosis). La interfase representa 95% del ciclo, consta de tres etapas: G1, S y G2, así como una fase G0 para las células que dejan de dividirse y que coloquialmente se les refiere como en reposo; por ejemplo, las neuronas o las del músculo esquelético. Reposo porque dejan de proliferar, pero claro que su actividad continúa. Se les llama G por gap, intervalo en inglés (Lodish et al., 2015; Alberts et al., 2016).
La fase G1 es la primera del ciclo, en ella se observa crecimiento celular con síntesis de RNA y proteínas. Es el periodo que transcurre entre el fin de una mitosis y el inicio de la síntesis de DNA. Tiene una duración de entre 6 y 12 h, y en el transcurso de esta etapa la célula aumenta su tamaño y masa. En esta fase, la célula es diploide o 2n. Continúa con la fase S que es la de síntesis o replicación del DNA, tiene una duración promedio de 6 a 8 h. Después sigue la fase G2, la cual ocurre entre la duplicación del DNA y el inicio de la mitosis; en esta fase continúa la síntesis de RNA y proteínas, y el contenido de DNA es tetraploide o 4n, tiene una duración promedio de entre 3 y 4 h. Por último, separado de la interfase, se pasa a la mitosis, la cual puede durar desde pocas horas hasta varios días, dependiendo del tipo celular. Incluye la cariocinesis, que es la división del núcleo 4n en dos núcleos 2n (para células somáticas) y la división de la célula como tal en dos células hijas, proceso llamado citocinesis (Sánchez González et al., 2006).
Para regular el paso de una etapa a la siguiente existen proteínas llamadas ciclinas que aumentan o disminuyen su expresión de acuerdo con las características metabólicas de la célula; asimismo, se tienen enzimas cinasas que dependen de esas ciclinas. Precisamente se llaman cinasas dependientes de ciclina o CDK por las siglas en inglés. Las CDK fosforilan a la proteína del retinoblastoma (Rb), la cual regula la transición G1/S y forma parte de un mecanismo de transducción de señales que conecta el sistema de regulación del ciclo celular con la maquinaria transcripcional de la célula para dirigir el paso de una fase a la siguiente. Este punto es muy importante y se retomará más adelante (Echeverría-Machado et al., 2002; Lodish et al., 2015).
SENESCENCIA CELULAR
La senescencia es un estado celular caracterizado por la detención o arresto del ciclo celular con características secretoras específicas que se describirán más adelante, daño macromolecular como el observado en DNA y metabolismo alterado. La senescencia se considera irreversible porque ningún estímulo fisiológico conocido puede hacer que las células senescentes vuelvan a entrar en el ciclo celular, se quedan en fase G0. En condiciones fisiológicas normales, la senescencia contribuye a la remodelación tisular durante el desarrollo embrionario de los mamíferos, puesto que forma parte del proceso para eliminación de células que consta de a) inducción de senescencia, b) limpieza de células senescentes por parte de células fagocíticas, y c) regeneración.
No obstante, también está implicada en varias respuestas en el organismo adulto, debido a que se puede activar en caso de daño como en la reparación de heridas o en enfermedades fibróticas, entre otras. Usualmente, al inicio limita la expansión de las células dañadas (por ejemplo, con daño al DNA), pero en etapas avanzadas puede contribuir a agravar la patología en caso de que las células senescentes se acumulen. Diversos factores pueden conducir a senescencia celular en el organismo adulto: oncogenes, disfunción mitocondrial, acortamiento acelerado de telómeros, daño al DNA, o bien, estrés como la hiperoxia o el generado por patógenos (Muñoz Espín et al., 2013; Storer et al., 2013; Regulski, 2017; Hernández-Segura et al., 2018; Gorgoulis et al., 2019; Barnes et al. 2019).
En el arresto del ciclo celular suele observarse un aumento de la expresión de las proteínas llamadas inhibidores de las CDK: p21 (CDKN1A), p16 (CDKN2A), p15 (CDKN2B) y p27 (CDKN1B). Cuando se inhiben las CDK no se puede fosforilar Rb, lo cual resulta en una detención irreversible del ciclo en la fase G1 (figura 1). Otras características observables en las células senescentes son las marcas de daño al DNA que se muestran evidentes por microscopía de los focos de heterocromatina asociados a la senescencia (SAHF), tinción de algunas proteínas de reparación, fosforilación de la histona H2AX, o bien por el acortamiento acelerado de los telómeros.
Se considera acortamiento acelerado cuando el largo de los telómeros se encuentra abajo del percentil diez de la población a evaluar, esto es, dentro de 10% de los más cortos. Otras características de células arrestadas son la actividad de β-galactosidasa asociada a la senescencia (SAβGal), alteraciones citoesqueléticas y otros cambios fenotípicos como el aplanamiento celular. Sin embargo, ninguna de estas características es esencial para la senescencia ya que no hay un solo marcador específico de este proceso, es por eso que para decir que una célula es senescente es necesario identificar más de dos características (Echeverría-Machado et al., 2002; Lozano-Torres et al., 2019).
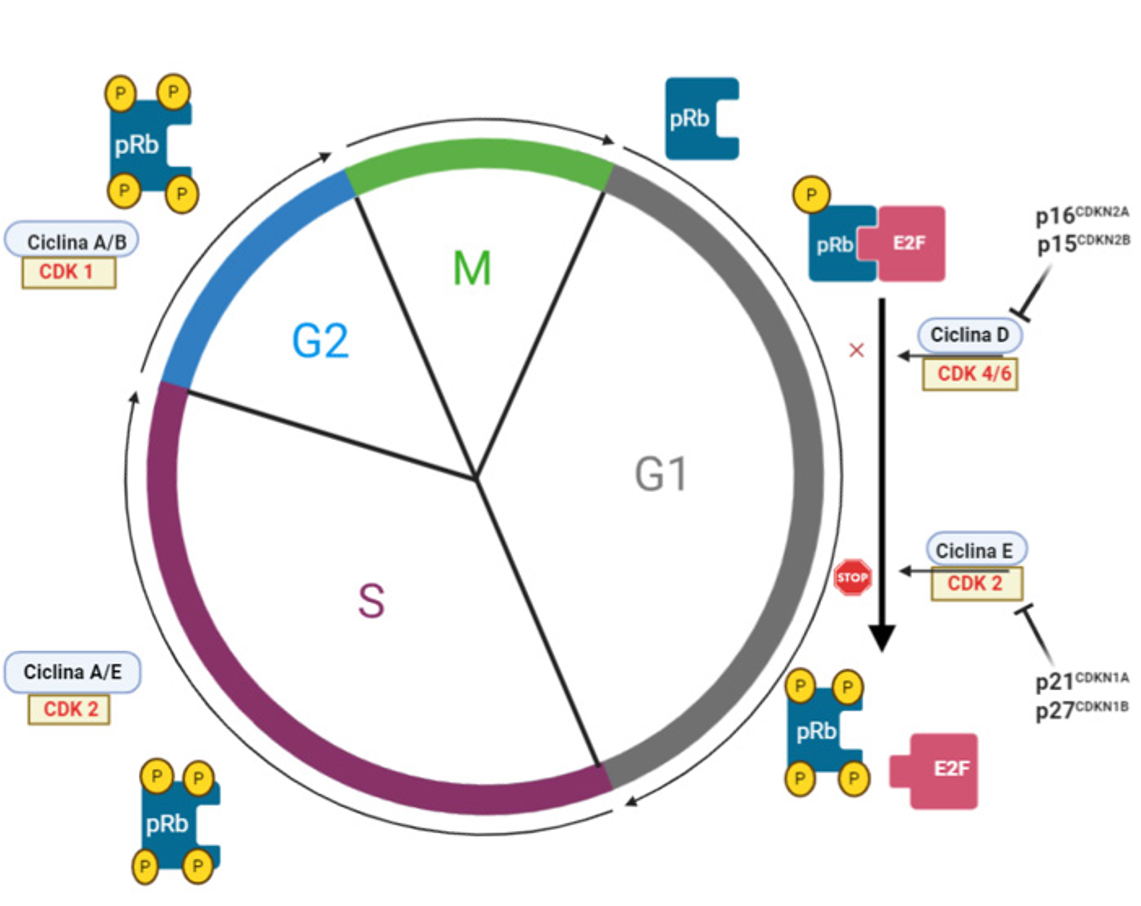
Figura 1. Ciclo celular y proteínas reguladoras. El ciclo celular avanza de G1, a S, a G2 y a M. En cada fase aumentan una o varias ciclinas. Durante la fase G1 la proteína Rb (pRb) es fosforilada por las cinasas dependientes de ciclina (CDK) 2, 4 y 6. Distintos tipos de estrés llevan al aumento de inhibidores de CDK como p15, p16, p21 y p27, en tales circunstancias, pRb permanece hipofosforilado y la célula se detiene en G1 (G0).
Las células senescentes secretan una gran cantidad de moléculas que incluyen citocinas y quimiocinas proinflamatorias, moduladores del crecimiento, factores angiogénicos y metaloproteasas de matriz (MMP), denominados colectivamente fenotipo secretor asociado a la senescencia (SASP), la mayoría de sus factores están regulados transcripcionalmente por el factor nuclear κB (NF-κB) y CCAAT/proteína de unión a potenciador β (CEBP‐β). A través de los factores del SASP se lleva a cabo una señalización parácrina, de manera que las células senescentes también pueden iniciar un mecanismo de retroalimentación positiva perjudicial, al promover la inducción de la senescencia a las células cercanas, ya sea por la secreción de los componentes del SASP al medio extracelular de manera libre, o bien, dentro de vesículas como los exosomas y las microvesículas. Asimismo, se ha visto que en este proceso resulta relevante la señalización yuxtácrina, que se refiere a aquélla en la que las células involucradas tienen contacto directo entre sí. Por ejemplo, en determinados contextos la inducción de la senescencia hacia las células contiguas depende de Notch (Casella et al., 2019; Gorgoulis et al., 2019; Misawa et al., 2020).
El contenido del SASP varía dependiendo del inductor de senescencia, tipo celular, edad del organismo, tiempo desde el inicio del estímulo, entre otros factores, indicando que no hay un único SASP, esto es, los fenotipos secretorios asociados a la senescencia son diferentes de acuerdo con las variables mencionadas; sin embargo, aunque se ha reportado que son distintos entre sí, las diferencias entre cada uno no están bien descritas (por ejemplo, SASP de hepatocitos senescentes por activación oncogénica versus SASP de células “naturalmente” senescentes de pituitaria). Esas diferencias incluyen el que en ciertos casos como en la senescencia observada en desarrollo embrionario, el mismo SASP atraiga a las células del sistema inmune que fagocitarán a las senescentes; sin embargo, en otros casos como en patologías, el SASP no llama a ninguna célula que pueda eliminar a las senescentes, al contrario, parece promover la senescencia en las demás células (Casella et al., 2019; Gorgoulis et al., 2019).
Los hallazgos recientes relacionados con rutas moleculares que afectan el SASP sugieren que es posible manipular los efectos parácrinos de la senescencia. Por ejemplo, la inhibición de ciertas cinasas o de NF-κB en células senescentes es suficiente para disminuir los efectos parácrinos perjudiciales regularmente asociados a este proceso. Manipular el SASP podría ser un blanco terapéutico prometedor, así como la eliminación directa de las células senescentes a través de las llamadas drogas senolíticas (Malaquin et al., 2016).
CONCLUSIÓN
Este es, grosso modo, el proceso mediante el cual las células senescentes detienen su ciclo celular, pareciera que “se ponen en huelga”, “se vuelven piki” o “se ponen exquisitas”, por eso nos atrevemos a decir que son “células caprichosas”, se detienen en fase G1 y aunque continúan con actividad metabólica, es diferente a la que suelen realizar pues no se dividen, no inician procesos de muerte celular y la maquinaria de reparación de daño al material genético no se da abasto, no es suficiente para regenerar el daño, no se puede regresar a condiciones fisiológicas normales y al mismo tiempo evita que se inicien procesos de muerte celular programada.
Aunque pareciera un tema bien conocido, en realidad es necesario seguir haciendo investigación experimental en el campo del ciclo celular y la senescencia. Por ejemplo, para describir a profundidad el contenido del SASP dependiendo del tipo celular, así como el alcance de sus efectos, o bien, cómo promover que el sistema inmune fagocite a las células senescentes.
La senescencia es un mecanismo importante en el desarrollo de diversas enfermedades crónicas de hígado y pulmón, por ejemplo. Nosotras en el laboratorio nos avocamos a intentar descifrar el papel de la senescencia en las células epiteliales y en los fibroblastos en el contexto de la fibrosis pulmonar idiopática. Nos interesa investigar cómo ocurren los fenómenos de senescencia y señalización lateral tanto parácrina como yuxtácrina entre células epiteliales alveolares y fibroblastos del pulmón. Si se conoce a detalle el proceso, entonces sería posible diseñar tratamientos dirigidos a un blanco en particular que evite esta comunicación parácrina y que quizá también evite la omnipresencia de células senescentes de una manera más eficiente. Con esas bases podrían plantearse nuevos modelos usando no sólo fármacos senolíticos, sino otro tipo de compuestos que alteren el proceso de comunicación de senescencia parácrina con el objetivo de evitar la progresión
Esperamos que las condiciones de la pandemia actual nos permitan regresar pronto a realizar los experimentos de laboratorio para seguir aportando con nuestro granito de arena al conocimiento de la senescencia, cuyo fin último es descifrar los mecanismos patogénicos, la etiología de las enfermedades y con ello mejorar la calidad de vida de los pacientes.
* Instituto Nacional de Enfermedades Respiratorias “Ismael Cosío Villegas”.
Contacto: marielmb@comunidad.unam.mx
REFERENCIAS
Alberts B., Johnson A., Lewis J., et al. (2016). Biología molecular de la célula. España:Editorial Omega. 969- 1026.
Barnes, P. J., Baker, J., y Donnelly, L.E. (2019). Cellular Senescence as a Mechanism and Target in Chronic Lung Diseases. American Journal of Respiratory and Critical Care Medicine. 200(5):556-564.
Casella, G., Munk, R., Kim, K.M., et al. (2019). Transcriptome signature of cellular senescence. Nucleic Acids Research. 47(21):11476.
Echevarría-Machado, I., Loyola-Vargas, V. M., y Hernández-Sotomayor, T. (2002). La proteína del retinoblastoma en las plantas. Revista de la Sociedad Química de México. 46(1):17- 22.
Gorgoulis, V., Adams, P.D., Alimonti, A., et al. (2019). Cellular Senescence: Defining a Path Forward. Cell. 179(4):813-827.
Hernandez-Segura, A., Nehme, J., y Demaria, M. (2018). Hallmarks of Cellular Senescence. Trends in cell biology. 28(6):436-453.
Lodish, H., Lodish, H., Berk, A., et al. (2015). Biología celular y molecular. México:Editorial Médica Panamericana. 873-922.
Lozano-Torres, B., Estepa-Fernández, A., Rovira, M., et al. (2019). The chemistry of senescence. Nature Reviews Chemistry. 3(7):426.
Malaquin, N., Martínez, A., Rodier, F. (2016). Keeping the senescence secretome under control: Molecular reins on the senescence-associated secretory phenotype. Experimental Gerontology. 82:39-49.
Misawa, T., Tanaka, Y., Okada, R., et al. (2020). Biology of extracellular vesicles secreted from senescent cells as senescence-associated secretory phenotype factors. Geriatrics & Gerontology international. 20(6):539- 546.
Muñoz-Espín, D., Cañamero, M., Maraver, A., et al. (2013). Programmed cell senescence during mammalian embryonic development. Cell. 155(5):1104-18.
Regulski, M.J. (2017). Cellular Senescence: What, Why, and How. Wounds: A Compendium of Clinical Research and Practice. 29(6):168-174.
Sánchez-González, D., Orjuela-Henry, D., Pérez-Astudillo L., et al. (2006). Nacimiento celular. Ciclo celular. En: Sánchez González, D., Trejo Bahena, N., Biología celular y molecular. México: Editorial Alfil. 139-192.
Storer, M., Mas, A., Robert-Moreno, A., et al. (2013). Senescence is a developmental mechanism that contributes to embryonic growth and patterning. Cell. 155(5):1119-30.