ACTUALIDADES SOBRE BRUCELOSIS
Dianelys Sotolongo Rodríguez*, Carlos Ramírez-Pfeiffer**,
Ricardo Gómez Flores*
CIENCIA UANL / AÑO 24, No.108, julio-agosto 2021
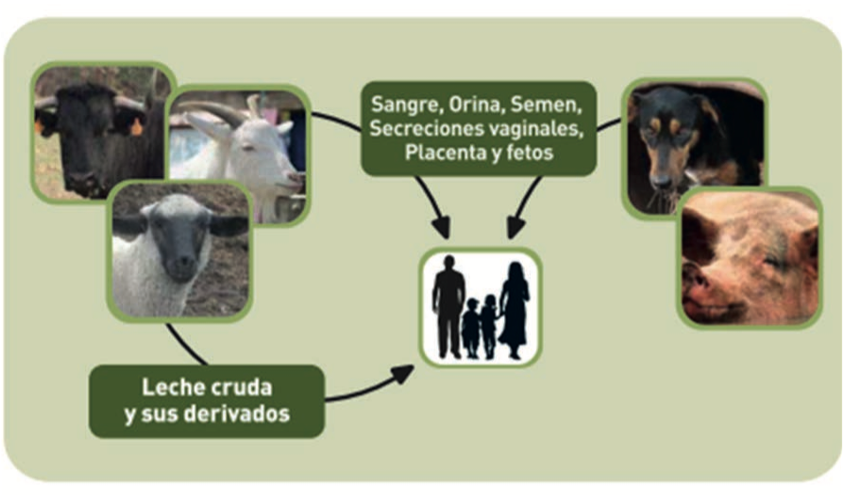
La brucelosis constituye un problema constante para los ganaderos a nivel mundial. Se le conoce como la enfermedad del aborto infeccioso y ocasiona grandes pérdidas económicas en la ganadería, principalmente en vacas, cerdos y cabras. Los humanos también pueden verse afectados por esta enfermedad manifestando síntomas como fiebres intermitentes. La infección se produce principalmente por la ingestión de productos lácteos provenientes de animales enfermos, así como por heridas abiertas (Seleem, Boyle y Sriranganathan, 2010) (figura 1).
Es importante destacar que esta enfermedad constituye un problema de salud pública en países en desarrollo y puede llegar a tener graves implicaciones sanitarias dado que es un riesgo ocupacional para trabajadores de laboratorio, veterinarios, trabajadores de mataderos, granjeros y cuidadores de animales. Existen animales positivos en Europa, el oeste asiático, África y en todo el continente americano, con importantes tasas de prevalencia que pueden llegar hasta 20.3% en ganaderías lecheras. Estudios realizados en algunos países sudamericanos reportan costos que sobrepasan los 20,000 dólares americanos diarios por concepto de prevención y tratamiento de la enfermedad en animales (El-Sayed y Awad, 2018). En países con extensas áreas rurales es donde mayor impacto socioeconómico tiene, especialmente si los ingresos de las comunidades dependen de la cría de animales de producción o si los estándares de higiene en la cría de estos animales son bajos.
¿QUÉ ES LA BRUCELOSIS Y QUÉ LA OCASIONA?
La brucelosis es una enfermedad infecciosa causada por bacterias del género Brucella spp. Estas bacterias infectan al ganado y se transmiten fácilmente entre individuos de especies diferentes incluyendo al hombre. La transmisión entre animales de granja se da principalmente por la ingestión de alimentos o agua contaminada, por descargas uterinas, fetos abortados o membranas fetales e incluso lamiendo los genitales de los animales enfermos (Elfaki, Alaidan y Al-Hokail, 2015). Además, los machos infectados también pueden propagar la infección entre las hembras a través del apareamiento natural y la inseminación artificial. El género de Brucella spp. se subdivide en seis especies principales: B. abortus, B. melitensis, B. suis, B. ovis, B. canis y B. neotomae que infectan a vacas, cabras, cerdos, ovejas, perros y roedores, respectivamente.
Estas bacterias son cocobacilos Gram negativos, generalmente dispuestos individualmente, aunque en ocasiones se agrupan en parejas o en grupos pequeños y son organismos parásitos que se hospedan dentro de las células y pueden sobrevivir en presencia o ausencia de oxígeno. Existen dos tipos de colonias obtenidas al sembrar en medio sólido las especies del género Brucella, las cuales se clasifican como lisas o rugosas (Samartino, Arregui y Martino, 2017). Dentro de éstas las cepas lisas son las más virulentas, este aspecto de las colonias se debe a la expresión de cierto tipo de estructuras llamadas lipopolisacáridos (LPS) en la superficie de la bacteria y durante su crecimiento pueden experimentar cambios o mutaciones que afecten su expresión pasando de rugosas a lisas o viceversa (Lapaque et al., 2005).
CONTROL Y PREVENCIÓN DE ESTA ENFERMEDAD
El control de esta enfermedad se fundamenta en dos pilares. El primero es la eliminación de los reservorios, para lo cual es necesario identificar y eliminar de los rebaños todos los animales reaccionantes a las pruebas de diagnóstico. Las pruebas serológicas se basan en reacciones de aglutinación en sangre, que permiten detectar anticuerpos específicos que se producen ante la presencia de este microorganismo, los anticuerpos se expresan ante la presencia de LPS o proteínas de la membrana de esta bacteria y esta interacción se puede observar en el suero al agregar diferentes colorantes a la reacción (Zhang et al, 2018).
Entre las pruebas serológicas más utilizadas se encuentran la prueba de rosa bengala (RBT), prueba de fijación del complemento (FCT), prueba de aglutinación lenta en tubo (SAT), rivanol y 2 mercaptoetanol (2-ME). También se estandarizan y validan nuevos métodos, como los moleculares (PCR y q PCR), así como ELISA y prueba de fluorescencia polarizada (FPA), en los cuales también se detecta la presencia de anticuerpos. Es importante destacar que la prueba de FPA detecta de una manera novedosa los anticuerpos presentes en el suero. En esta prueba se mide el cambio en el ángulo de difracción que ocurre cuando el antígeno se une al anticuerpo, lo que provoca una polarización cuantificable de la luz. La metodología es altamente sensible y específica aunque aún se trabaja en la estandarización de la misma para detectar anticuerpos en diferentes matrices (Ramírez-Pfeiffer et al., 2008a; 2008b).
El segundo pilar se basa en la vacunación, en las zonas donde la brucelosis es endémica suele utilizarse la vacunación para reducir la incidencia de la infección. Desde principios del siglo XX, comenzaron los trabajos de investigación sobre el desarrollo de vacunas contra la brucelosis. Durante su desarrollo se han formulado vacunas de cepas inactivadas, de cepas lisas vivas atenuadas y cepas rugosas. En la actualidad existe un grupo de vacunas comerciales que son utilizadas en los diferentes programas de erradicación de esta enfermedad a nivel mundial (Dorneles, Sriranganathan y Lage, 2015). Las cepas atenuadas más utilizadas son de B. abortus s19 para el ganado bovino y de B. melitensis Rev.1 para ovejas, que han disminuido la incidencia de brucelosis en ganado. En cuanto a las vacunas atenuadas rugosas aprobadas de manera oficial, la RB51 es la única que se encuentra actualmente en el mercado (Moriyón et al., 2004). Estas vacunas proporcionan la protección deseable porque tienen todos los componentes inmunogénicos de replicación e invasión celular y pueden inducir una gran respuesta inmunitaria en el huésped. Además, pueden prevenir el aborto y la transmisión de la enfermedad.
No obstante, las vacunas atenuadas, a pesar de su uso extendido, presentan ciertas desventajas: son infecciosas para los humanos y pueden ser abortivas cuando se usan en animales gestantes (Hou, Liu y Peng, 2019). Por otro lado, su uso induce una respuesta inmune no diferenciada, esto provoca que las pruebas serológicas no siempre aclaren si un animal determinado está infectado o muestra anticuerpos posvacunales, complicando el diagnóstico. Por estas razones se continúan los esfuerzos en el desarrollo de nuevas vacunas o la mejora de las disponibles actualmente, ya sea mejorando la inmunogenicidad o reduciendo la virulencia de las bacterias para cumplir con los requisitos de una vacuna viva.
NUEVA GENERACIÓN DE VACUNAS CONTRA BRUCELLA SPP.
El conocimiento y manipulación del genoma, así como las nuevas tecnologías, han permitido la creación de novedosos candidatos vacunales, que en un futuro puedan ser comercializables y no presenten las carencias de las vacunas actuales. Utilizando este nuevo conocimiento adquirido, se han implementado varias metodologías para crear nuevas vacunas, aunque no todas muestran un futuro prometedor. En este apartado se discutirán algunas de las nuevas estrategias con mayor perspectiva.
La recombinación homóloga es un proceso celular que ocurre de manera natural en las bacterias, este proceso se ha logrado manipular para el desarrollo de cepas atenuadas. Estas nuevas cepas tienen interrupción en genes implicados en la biosíntesis de la membrana celular y la capa LPS, dando como resultado mutantes rugosas, que no sólo son útiles para el diagnóstico serológico de rutina, sino también para mejorar la eficacia de la protección. Esta estrategia permitiría en un futuro contar con nuevas vacunas de cepas vivas rugosas que naturalmente disminuyan los efectos secundarios negativos de la vacunación (Lalsiamthara y Lee, 2017). La ingeniería genética ha permitido utilizar algunos microorganismos no patógenos como Salmonella spp., Lactococcus lactis, E. coli y Semliki Forest Virus, que se han empleado como vectores para administrar el antígeno de Brucella spp. en sitios importantes desde el punto de vista preventivo. Esto funcionaría como una alternativa al uso de una cepa atenuada o rugosa de Brucella spp., pero que al ser una célula completa podría elevar igualmente la respuesta inmunitaria, logrando una protección por inmunización (Gheibi et al., 2018).
Otra propuesta relevante no contempla el uso de células completas en ninguna de sus variantes, si no el uso de proteínas o ADN con capacidad inmunizante. Las vacunas de ADN han surgido como parte de esta iniciativa y se basan en la utilización de un plásmido que expresa un gen codificante del antígeno de interés. En la formulación de estas vacunas se incluyen los plásmidos que codifican para genes de Brucella spp., y aunque el uso de un adyuvante no es estrictamente necesario, sí es recomendable. Los péptidos sintéticos igualmente son capaces de estimular la producción de anticuerpo anti-Brucella y esta capacidad se ha observado en modelos in vitro (Lalsiamthara y Lee, 2017). Las proteínas recombinantes se han empleado en diferentes áreas médicas. Su uso permite la producción en masa de proteínas de interés con un alto rendimiento y pureza. La metodología de producción de estas proteínas es relativamente sencilla y segura, lo cual la convierte en una opción muy atractiva. Sin embargo, algunas de estas proteínas recombinantes tienden a tener un efecto pobre sobre el sistema inmunológico y no logran levantar una respuesta protectora a largo plazo (Costa-Oliveira et al., 2010).
La mejora en la eficiencia de este tipo de vacunas depende de la proteína utilizada, por lo que es fundamental la búsqueda de los mejores candidatos para la misma. Una de las vacunas más prometedoras son las vacunas con base en nanopartículas; éstas se fabrican a partir de la encapsulación de antígenos dentro de los nanoportadores o sobre la superficie de éstos (Hou, Liu y Peng, 2019). Los nanoportadores proporcionan una ruta adecuada de administración de antígenos y mejoran la absorción celular, lo que da como resultado respuestas inmunes más altas en comparación con los antígenos no conjugados, además de generar respuestas inmunes en los órganos linfoides, logrando una mayor eficiencia de la vacuna. No obstante, como en los casos anteriores, a pesar de los buenos resultados obtenidos en modelos in vitro y modelos murinos, no se han logrado implementar en otros modelos animales (Martins et al., 2012; Olsen, 2013).
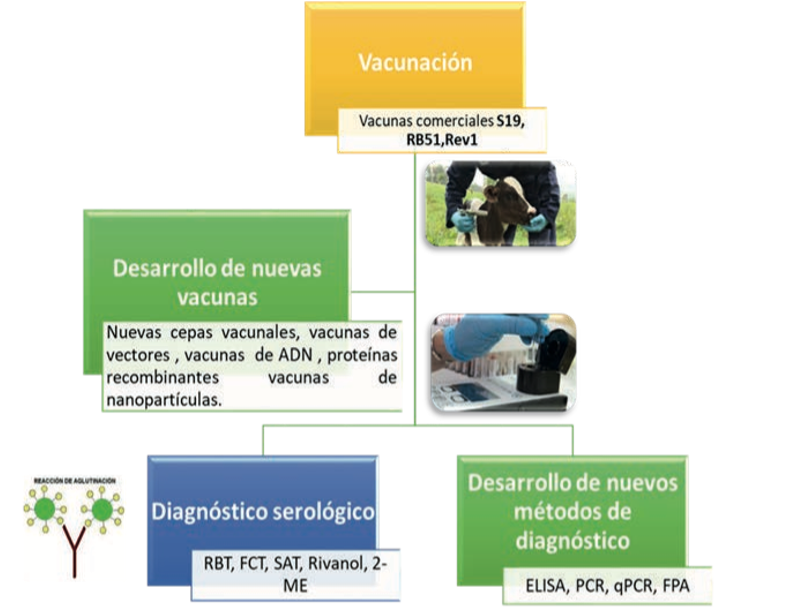
Figura 2. Esquematización de la campaña para la erradicación de Brucella. Vacunación del ganado con cepas comerciales (S19, RB51, Rev1) a la par que se desarrollan nuevos candidatos vacunales. Diagnóstico con los métodos serológicos aprobados y validados: prueba de rosa bengala (RBT), prueba de fijación del complemento (FCT), prueba de aglutinación lenta en tubo (SAT), rivanol y 2 mercaptoetanol (2-ME) a la par que se desarrollan y validan nuevos métodos de diagnóstico: ELISA,PCR, PCR en tiempo real (qPCR) y la prueba de fluorescencia polarizada (FPA).
CONCLUSIONES Y PERSPECTIVAS
La vacunación es una estrategia crítica para el control de la brucelosis y los programas de erradicación. Sin embargo, debido a algunos efectos secundarios mostrados por cepas tanto lisas como rugosas, continúan los esfuerzos en la búsqueda de nuevas vacunas. Teniendo en cuenta que el genoma de Brucella se ha secuenciado, además de los avances en la ingeniería genética y la bioinformática, las vacunas lisas y rugosas diseñadas tienen el potencial de ser, en un futuro no muy lejano, el control de la brucelosis en comparación con las vacunas de subunidades.
Es importante destacar que para todos los casos las vacunas aún están lejos de poder implementarse y comercializarse, debido a que éstos sólo se han evaluado en modelos in vitro o en ratones. Aún se necesitan estudios adicionales en términos de seguridad, eficacia y otras características deseables. Otra barrera es la presencia de agencias gubernamentales de regulación en países donde esta enfermedad es endémica, dado que muchas veces éstas se resisten a invertir y trabajar con nuevas vacunas. Aun así el auge en la investigación de cepas y candidatos vacunales más eficientes finalmente obligará a estas agencias a considerar nuevas opciones.
*Universidad Autónoma de Nuevo León.
** Universidad México Americana del Norte, A.C.
Contacto: dianesotolongo@gmail.com
REFERENCIAS
Costa-Oliveira, S., Costa-Macedo, G., De Almeida, L.A., et al. (2010). Recent advances in understanding immunity against brucellosis: application for vaccine development. The Open Veterinary Science Journal. 4:101-107.
Dorneles, E.M., Sriranganathan, N., y Lage, A.P. (2015). Recent advances in Brucella abortus vaccines. Veterinary research. 46(1):76.
Elfaki, M.G., Alaidan, A.A., y Al-Hokail, A.A. (2015). Host response to Brucella infection: review and future perspective. The Journal of Infection in Developing Countries. 9(07):697-701.
El-Sayed, A., y Awad, W. (2018). Brucellosis: Evolution and expected comeback. International Journal of Veterinary Science and Medicine. 6(sup1):S31-S35.
Gheibi, A., Khanahmad, H., Kashfi, K., et al. (2018). Development of new generation of vaccines for Brucella abortus. Heliyon. 4(12):p.e01079.
Hou, H., Liu, X., y Peng, Q. (2019). The advances in brucellosis vaccines. Vaccine. 37:3981-3988.
Lalsiamthara, J., y Lee, J.H. (2017). Development and trial of vaccines against Brucella. Journal of Veterinary Science.18(S1):281-290.
Lapaque, N., Moriyon, I., Moreno, E., et al. (2005). Brucella lipopolysaccharide acts as a virulence factor. Current opinion in microbiology. 8(1):60-66.
Martins, R.D.C., Gamazo, C., Sánchez-Martínez, M., et al. (2012). Conjunctival vaccination against Brucella ovis in mice with mannosylated nanoparticles. Journal of controlled reléase. 162(3):553- 560.
Moriyón, I., Grilló, M.J., Monreal, D., et al. (2004). Rough vaccines in animal brucellosis: structural and genetic basis and present status. Veterinary Research. 35(1):1-38.
Olsen, S.C. (2013). Recent developments in livestock and wildlife brucellosis vaccination. Rev Sci Tech. 32(1):207-17.
Ramírez-Pfeiffer, C., Díaz-Aparicio, E., Gómez-Flores, R., et al. (2008a). Use of the Brucellamelitensis native hapten to diagnose brucellosis in goats by a rapid, simple, and specific fluorescence polarization assay. Clinical and Vaccine Immunology. 15(6):911-915.
Ramírez-Pfeiffer, C., Díaz-Aparicio, E., Rodríguez-Padilla, C., et al. (2008b). Improvedperformance of B. melitensis nativehapten over B. abortus OPS tracer ongoat antibody detection by the fluorescence polarization assay. Veterinary Immunology and Immunopathology. 123:223-229.
Samartino, L., Arregui, M., y Martino, P. (2017). New Scenarios for Brucella suis and Brucella melitensis. Current Clinical Microbiology Reports. 4(1):11-18.
Seleem, M.N., Boyle, S.M., y Sriranganathan, N. (2010). Brucellosis: a re-emerging zoonosis. Veterinary Microbiology. 140(3- 4):392-398.
Zhang, N., Huang, D., Wu, W., et al. (2018). Animal brucellosis control or eradication programs worldwide: A systematic review of experiences and lessons learned. Preventive veterinary medicine. 160:105- 115.