DMITRI MENDELÉYEV Y SU ORDEN ELEMENTAL
Daniel Salgado Blanco*, Fabiola Jaimes-Miranda*
CIENCIA UANL / AÑO 24, No.107, mayo-junio 2021
DMITRI MENDELÉYEV
Mientras se elevaba por el aire, Dmitri volteó su mirada hacia el grupo de personas que desde Tierra lo observaban con asombro. Entre ellos estaba el oficial del ejército que debía haber piloteado el globo aerostático, y quien puso una mirada atónita al escuchar la petición de Dmitri para que bajara de la canastilla del globo. Dmitri no sentía ningún remordimiento, había sido necesario: con el peso del equipo que llevaban para hacer las mediciones meteorológicas, el globo no hubiera podido despegar si aquel oficial del ejército permanecía a bordo. Dmitri no estaba dispuesto a perderse un eclipse solar desde lo alto ni a cederle a un militar la oportunidad de realizar mediciones de este inusual fenómeno. Además, con el cielo nublado de ese día, era indispensable alcanzar esa posición pues era la única que le permitiría ver y hacer mediciones del eclipse. Al final había valido la pena, y sabía además que este pequeño incidente con el oficial del ejército no pasaría a mayores: a estas alturas de su vida, la profesión de Dmitri lo mantenía en una posición privilegiada dentro de la sociedad e incluso ante los ojos del gobierno del Zar. Pero no siempre fue así…
Desde que Dmitri nació, durante muchos años su futuro parecería ominoso: nacido como el último de trece hermanos, tuvo un padre quien, apenas un año después de haberlo visto nacer, perdería la vista por completo. Su madre se convirtió en el único sostén económico del hogar y tuvo que dedicarse a la administración de una fábrica de vidrios que pertenecía a su familia, desgraciadamente, un incendio consumió la fábrica cuando Dmitri tenía catorce años y la familia volvió a caer en desgracia…
El inicio de esta historia puede resultar tristemente familiar para muchos y, sin embargo, es poco probable que la mayoría esté relacionada con su desenlace. Probablemente si alguien hubiera conocido a Dmitri en esa etapa de su vida, no creería lo que este niño llegaría a ser: uno de los grandes científicos de su tiempo, cuyo principal legado, la tabla periódica, es una parte fundamental de la estructura que utilizamos para ordenar nuestro entendimiento de la naturaleza.
Dmitri Mendeléyev nació en 1834 en la ciudad siberiana Tobolsk, Rusia. Después de que la fábrica de vidrios de su familia se perdiera, su madre llevaría a Dmitri a San Petersburgo para que continuara con sus estudios. Allí empezaría a consolidar su gran interés por la ciencia en general y por la Química de forma muy particular. Su vocación lo llevaría a escalar peldaños dentro de la academia, primero con una maestría en San Petersburgo y luego un doctorado en Heidelberg, Alemania. El joven Mendeléyev regresaría en 1861 a San Petersburgo como la mayoría de los científicos recién egresados, con mucho ímpetu, pero desempleado y sin dinero. Esta situación económica lo llevaría a buscar trabajo escribiendo un libro de texto, el cual llevó a cabo con tal dedicación y cuidado que se convertiría en un libro de referencia en la enseñanza de la Química en Rusia.
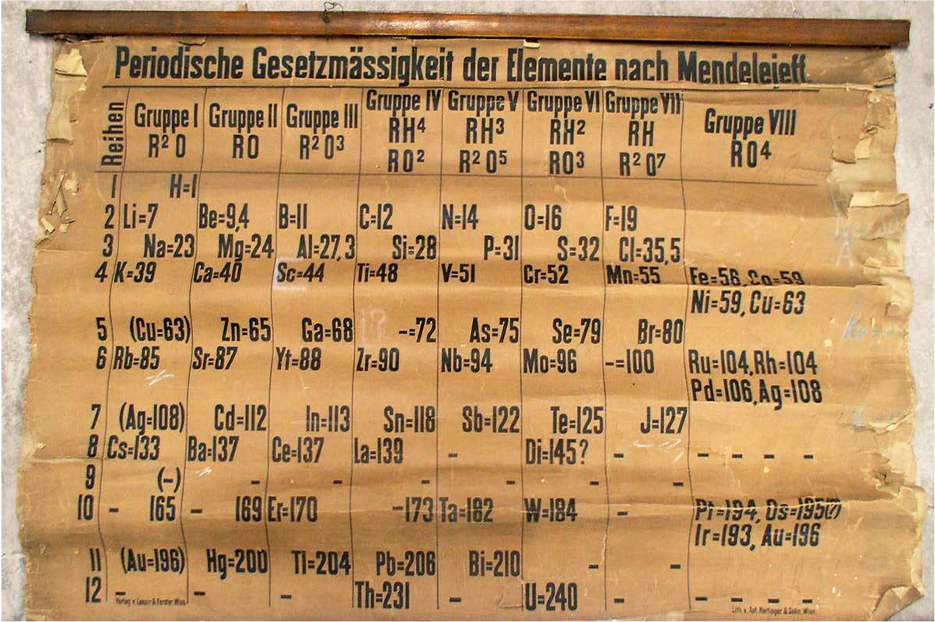
Para 1800, la Química pasaba por grandes cambios: conceptos como la valencia de un elemento o la importancia del peso atómico, apenas empezaban a discutirse con seriedad y a tomar la forma con que se conocen actualmente. Dada su formación, Mendeléyev conocía sobre estos avances y las discusiones que estaban teniendo lugar en el resto del mundo, y utilizó su primer libro como plataforma para llevar ideas novedosas a las aulas. Este trabajo no sólo significó un alivio económico para Mendeléyev, sino una exitosa aproximación hacia el proceso creativo de escribir libros de texto. En 1869, ocho años después de haber publicado su primer libro, se reencontraría con la misma tarea. En esta ocasión lo motivaría principalmente el deseo de desarrollar un texto de apoyo para impartir un curso de Química universitario. Tituló su libro de dos tomos: Principios de la Química. Dentro del segundo tomo, Mendeléyev plasmaría por primera vez un boceto de lo que lo convertiría en uno de los íconos de la ciencia: la tabla periódica de los elementos.
EL ORDENAMIENTO DE LOS ELEMENTOS Y SU PERIODICIDAD
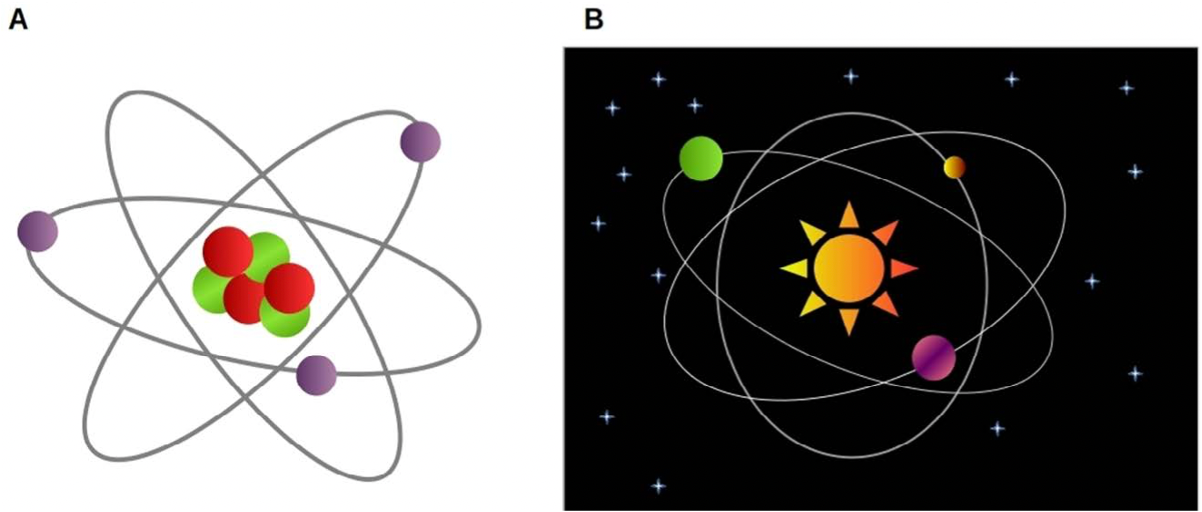
Un elemento químico es una sustancia pura, es decir, que todos los átomos que la conforman son iguales. A su vez, cada átomo está compuesto por tres partículas más pequeñas: neutrones, protones y electrones. La forma en que estas partículas conforman un átomo es similar a la disposición de nuestro sistema solar, en el que los planetas orbitan alrededor del sol. En esta analogía, el sol está representado por el núcleo del átomo, dentro del cual sólo hay neutrones y protones, y los planetas son los electrones que orbitan alrededor del núcleo atómico. En general, un átomo tiene el mismo número de electrones y protones, y como los electrones y protones tienen la misma carga eléctrica, pero con signo contrario, la carga total de un átomo suele ser cero. Hoy sabemos que la cantidad de protones (y por lo tanto de electrones) de cada átomo es determinante para las propiedades de los elementos químicos. En la época en la que Mendeléyev escribió su libro se sabía que cada elemento químico poseía características que lo distinguían, por ejemplo, su afinidad para combinarse con otros elementos o el color de la luz que emitían cuando se calentaban. Sin embargo, hasta antes de la tabla periódica de Mendeléyev, en realidad no se había encontrado una forma lógica de ordenar a todos y cada uno de estos elementos (si bien más de uno lo intentaba).
Aunque la propuesta original de Mendeléyev ha pasado por cambios a lo largo del tiempo (cambios que incluso él mismo propuso), lo esencial de su idea original se ha mantenido. La versión actual de la tabla periódica ordena los elementos químicos de acuerdo a su número atómico, es decir, a la cantidad total de protones que hay en cualquiera de sus átomos. Por ejemplo, el primer elemento de la tabla periódica es el hidrógeno, cuyos átomos sólo tienen un protón; el segundo es el helio, cuyos átomos tienen dos protones; le sigue el litio, con tres protones dentro de sus átomos, y así sucesivamente. Ordenando los elementos químicos sólo por su número atómico, acabaríamos con una lista muy larga de un elemento tras otro que sería difícil de manejar. Entonces, una manera más condensada de ordenarlos y que resulta sencilla, es considerar otra de sus características: el número de electrones. Al considerar el número de electrones se obtiene el característico arreglo bidimensional que conocemos, donde las casillas están acomodadas en renglones y columnas.
Cada átomo tiene una capacidad máxima de electrones que orbitan en capas o niveles de energía alrededor del núcleo. Cada capa puede albergar hasta cierto número de electrones. Dependiendo del número de electrones que cada átomo tenga será el número de capas alrededor del núcleo. Esta característica se ve reflejada en el número de renglones de la tabla periódica, por ejemplo, el hidrógeno tiene un electrón que cabe en la primera capa, por lo que en la tabla periódica está en el renglón 1, el helio tiene dos electrones que también caben en la primera capa, así que también está ubicado en el renglón 1. En la capa 1 ya no caben más electrones, entonces, el litio, que es el siguiente elemento y tiene tres electrones, tendrá dos capas ocupadas: dos electrones en la primera capa y un electrón en una segunda capa, y se ubicará en el renglón 2. Y así sucesivamente con todos los elementos de acuerdo al número de capas ocupadas por sus electrones. Cada vez que los orbitales de un átomo estén completos, terminará un renglón de la tabla y se comenzará otro hasta acomodar a todos los elementos.
Al terminar de ordenar con su sistema los 60 elementos químicos que se conocían en ese entonces, Mendeléyev se percató de que los elementos que se encontraban cercanos entre ellos tenían propiedades similares. Esto le hizo notar que debía haber otros elementos aún no descubiertos y dejó huecos en la tabla para ellos. Incluso se aventuró a predecir cuáles deberían ser las características de los elementos faltantes. Todo el proceso que Mendeléyev siguió para llegar a la construcción de la tabla periódica fa- cilitó en gran medida la comprensión de la complejidad de la estructura de los átomos.
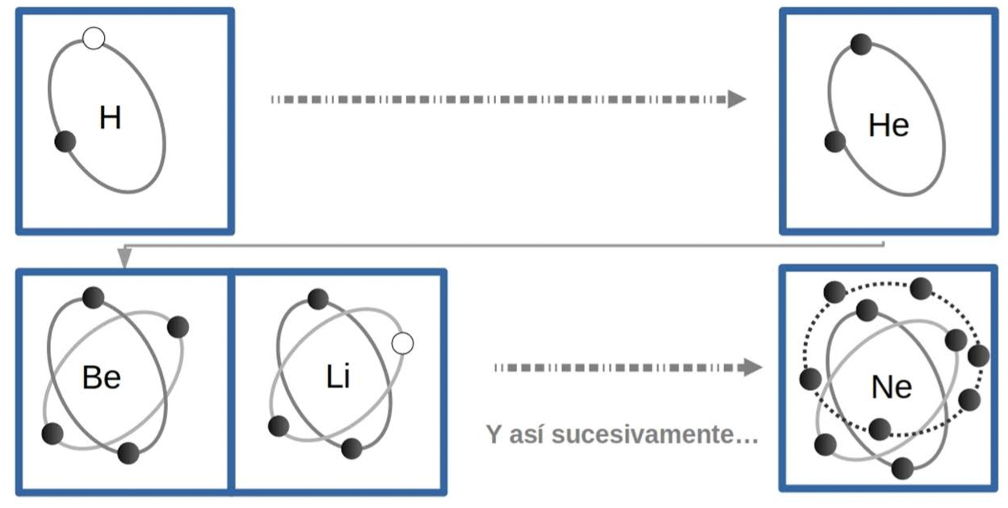
Figura 4. Representación esquemática del llenado de los orbitales atómicos de los átomos de hidrógeno (H), helio (He), litio (Li), berilio (Be) y neón (Ne).
CÓMO SE HA MODIFICADO LA TABLA PERIÓDICA EN EL TIEMPO. LA TABLA, HOY
Podemos ver la tabla periódica como un mapa en el que se ordenan los elementos de acuerdo a una serie de relaciones que involucran sus propiedades físicas y químicas. Este arreglo resulta muy útil ya que la posición que ocupan los elementos en la tabla nos dice algo sobre sus propiedades. Es algo fascinante la relación de las propiedades que los elementos guardan entre sí y que la ley de periodicidad pone de manifiesto. Ahora que conocemos que hay características compartidas entre elementos, podemos hacer clasificaciones diversas según unas u otras propiedades. Sin embargo, no debemos olvidar que cada elemento es diferente a los demás, y aunque compartan algunas características, cada uno es fundamentalmente distinto.
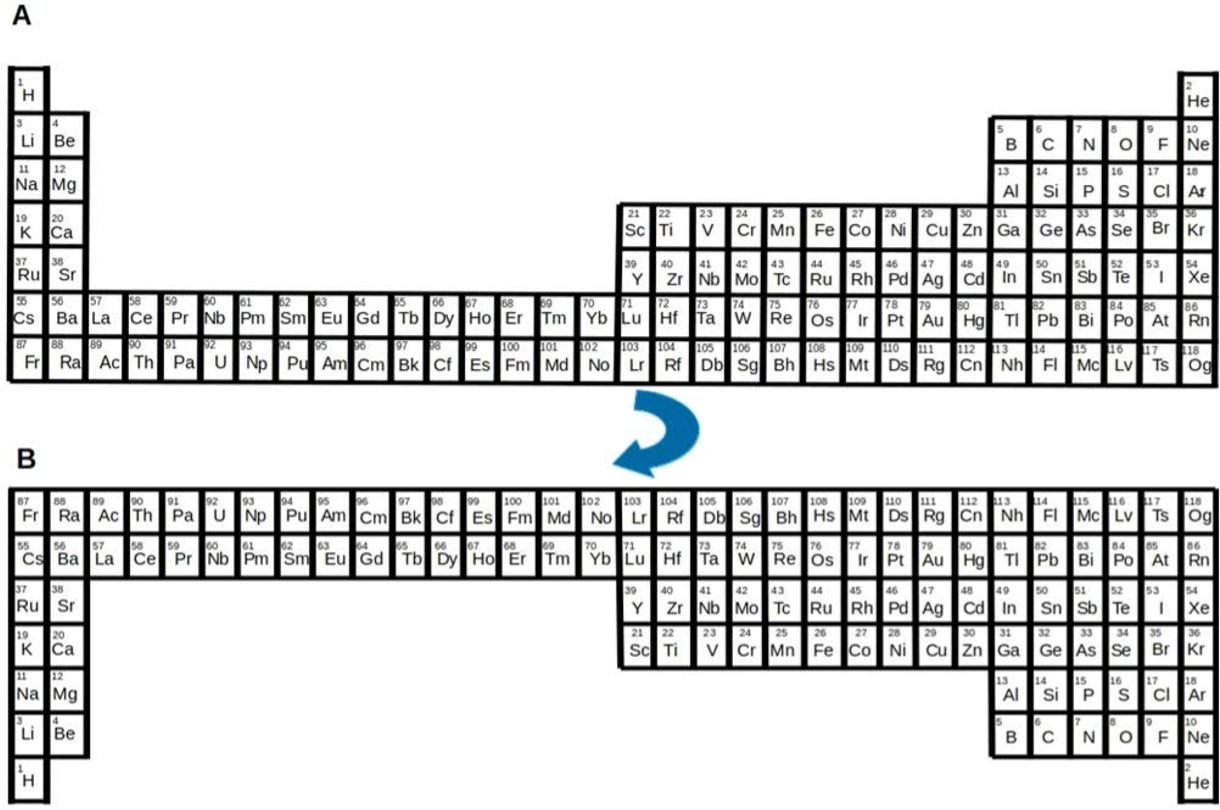
Figura 5. Una sección de la tabla periódica actual (arriba) comparada con la configuración obtenida al girarla 180° (abajo).
La manera de ordenar los elementos de Dmitri Mendeléyev ha sido la manera más práctica que se ha propuesto de acuerdo a su estructura atómica y sus propiedades físicas y químicas. Sin embargo, la tabla periódica de Mendeléyev no es un arreglo absoluto, no es la organización obligatoria que los elementos deben tener y el creer que existe una sola representación es como ver el cubo por una sola cara. Una tabla al final es un sistema que puede cambiar dependiendo del enfoque que se quiera obtener. Hoy en día, con las herramientas computacionales disponibles, podemos acceder a varias representaciones de la clasificación de los elementos al mismo tiempo. Esto permite entender mejor las propiedades y el comportamiento de cada elemento y nos proporciona la libertad de ver cada elemento desde varios ángulos. Esto nos da la posibilidad de ver el cubo completo.
Los esfuerzos por encontrar una representación gráfica continúan hasta hoy en día. Se tienen documentados más de 400 diferentes arreglos y se siguen proponiendo nuevas representaciones. Una propuesta de una nueva tabla periódica fue hecha en 2019, a propósito del Año Internacional de la Tabla Periódica, por un grupo de científicos ingleses liderados por un reconocido investigador de Química fundamental de la Universidad de Nottingham, en Reino Unido. Ellos han propuesto, con fines pedagógicos, poner la tabla periódica de cabeza, es decir, girarla 180° y así tener a los elementos con menor número atómico en la base. Los autores explican que esto tiene muchas ventajas, por ejemplo, su número atómico incrementaría de abajo hacia arriba, y creen que esta nueva orientación sería más fácil de entender por los estudiantes, pero el impacto pedagógico aún está por probarse y la controversia ha sido mucha…
*Conacyt-Instituto Potosino de Investigación Científica y Tecnológica, A.C. Contacto: daniel.salgado@ipicyt.edu.mx, fabiola.jaimes@ipicyt.edu.mx
REFERENCIAS
Navarro-Yáñez, A. (2019). El secreto de Promete. España: Guadalmazan.
Gordin, Michael D., (2019). A Well-Ordered Thing: Dmitrii Mendeleev and the Shadow of the Periodic Table. EE UU:Princeton University Press.
Bortz, F. (2014). The Periodic Table of Elements and Dmitry Mendeleyev. EE UU:Rosen Classroom.
Roberts, S. (2019). ¿Es momento de cambiar drásticamente la tabla periódica? The New York Times, Sección de Ciencia.
Martín-León, N. (2007). Mendeléiev: rebeldía y pasión por la ciencia. El País.
Mishra, P., y Nguyen-Jahiel, K. (1998). Multiple visual representations of the periodic system of elements: Epistemological and pedagogic implications. Disponible en: https://www.semanticscholar.org/paper/Multiple-Visual-Representations-Of-The-Periodic-Of-Mishra-Nguyen-Jahiel/ 85406d3cbe77be1b911664fcb2520128f3326dda#citing-papers.
BBC. (2019). Descubren la tabla periódica más antigua del mundo. BBC, Sec- ción News Mundo. https://www.bbc. com/mundo/noticias-46922730
Poliakoff, M., Makin, A.D., Tang, S.L., et al. (2019). Turning the periodic table upside down. Nature chemistry. 11(5):391.