VIRUS COMO ARMA CONTRA LAS BACTERIAS FARMACORRESISTENTES
María Fernanda Velarde Padilla*, Juan Daniel Hernández Altamirano*
CIENCIA UANL / AÑO 23, No.104, noviembre-diciembre 2020
Reconocidos como uno de los descubrimientos más importantes de la humanidad, los antibióticos, también llamados antimicrobianos, son fármacos usados para prevenir y tratar enfermedades en humanos y animales causadas por bacterias patógenas. Desde su hallazgo a mediados del siglo XX se han podido salvar incontables vidas.
Todos han escuchado hablar de los antibióticos. ¿Pero cómo funcionan en realidad? Estos agentes antimicrobianos se componen de moléculas que interrumpen procesos metabólicos vitales para la supervivencia de las bacterias, lo cual conlleva a su muerte y, por ende, a la finalización de la infección bacteriana en cuestión. El proceso se debe a que, de acuerdo con su clasificación, son capaces de inhibir la síntesis de proteínas, la formación de la pared bacteriana, e incluso impiden que el material genético de la bacteria se duplique, como si pusiéramos un tornillo para atascar el engranaje de una máquina, logrando que ésta deje de funcionar (Calvo y Martínez, 2009).
A pesar del éxito que representa el uso de antibióticos para combatir enfermedades, su uso indebido ha provocado el desarrollo de nuevas problemáticas, como la resistencia bacteriana. Según datos del Centro para la Prevención y Control de Enfermedades de EE UU, cerca de 23,000 personas mueren al año a causa de infecciones por bacterias resistentes a los antibióticos (CDC, 2014), y se prevé que para 2050 estos medicamentos serán ineficaces para hacerles frente (OMS, 2017).
En México, estos fármacos son los más vendidos y consumidos por la población. Se estima que se consumen más que en países desarrollados, aunque el uso justificado apenas se ubica entre 10- 15% de todas las prescripciones médicas (Dreser et al., 2008).
LA RESISTENCIA BACTERIANA
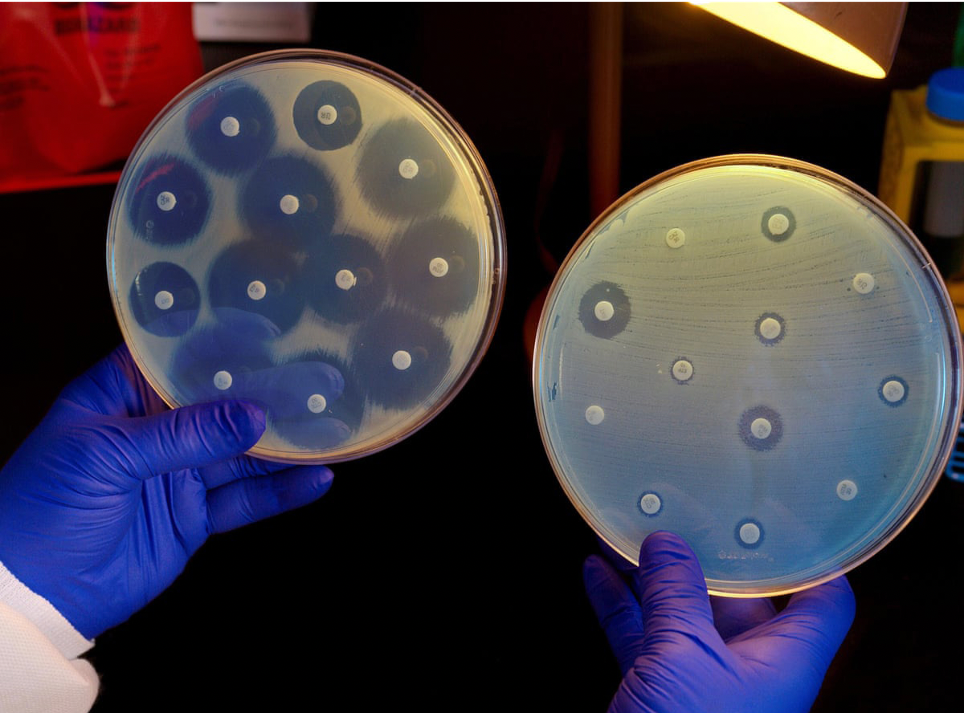
Existen bacterias que, por sus propias características, no son afectadas por los antibióticos, gozan de un mecanismo denominado resistencia intrínseca o natural. Ya sea que no posean el sitio blanco (donde se une la molécula antimicrobiana) o bien que este punto se encuentre inaccesible para que la molécula antimicrobiana actúe contra ellas.
De igual manera, existen otros tipos de resistencias conocidas como resistencia adquirida, que ocurren cuando la bacteria modifica el sitio de acción o crea mecanismos para evitar la penetración del fármaco a la membrana bacteriana, como:
- Bloqueo del transporte del antibiótico.
- Transformación enzimática del antibiótico.
- Producción de bombas que expulsan el antimicrobiano.
- Modificación del sitio blanco.
Un ejemplo de modificación del sitio blanco es el caso de la bacteria Streptococcus pneumoniae resistente a betalactámicos, dicha bacteria muta las moléculas de su membrana celular donde se unen estos medicamentos, para que sean inefectivos y no ocasionen alteraciones en los ciclos vitales (Chiou y Hseih, 2003).
Los mecanismos se transmiten de una bacteria a otra por medio de fragmentos de material genético codificados para dichas modificaciones fisiológicas y las bacterias puedan sobrevivir al ataque de estos compuestos químicos (Serra, 2017).
NUEVAS ESTRATEGIAS CONTRA LAS BACTERIAS PATÓGENAS
A todas luces, este futuro escenario parece sombrío. Por eso, en la lucha para erradicar a las infecciones bacterianas, se han desarrollado nuevos fármacos para las bacterias que han adquirido resistencia a los medicamentos comúnmente usados. Un ejemplo de estas nuevas moléculas terapéuticas son los péptidos: cadenas pequeñas de aminoácidos que desestabilizan la membrana bacteriana, ocasionan su ruptura y con ello la muerte celular (Calvo y Martínez, 2009).
De igual manera, se ha propuesto la reinvención y mejoramiento de fármacos a través de nuevas áreas como la nanotecnología. Como es el caso del uso de pequeñas partículas (nanopartículas) metálicas, poliméricas e incluso nanocristales, las cuales, debido a la escala nanométrica, provocarían un mejor contacto entre la bacteria y la nanopartícula, ya que, al ser muy pequeñas, éstas pueden escabullirse entre las estructuras bacterianas logrando que actúen de manera más eficaz en comparación con aquéllas de mayor tamaño (Lima, Sá de Fiol y Balcão, 2019).
Dentro de las estrategias planteadas como alternativa contra las bacterias resistentes a múltiples fármacos se encuentra la fagoterapia, que involucra el uso terapéutico de virus poseedores de una afinidad específica por las bacterias, conocidos como bacteriófagos o fagos, dichas partículas virales al sólo infectar bacterias tienen varias ventajas en comparación a los fármacos antimicrobianos, ya que estos virus pueden diseñarse para atacar de manera exclusiva a ciertas bacterias que causan enfermedades graves, como si se diseñara una llave para una cerradura concreta.
¿ES LA FAGOTERAPIA UNA SOLUCIÓN?
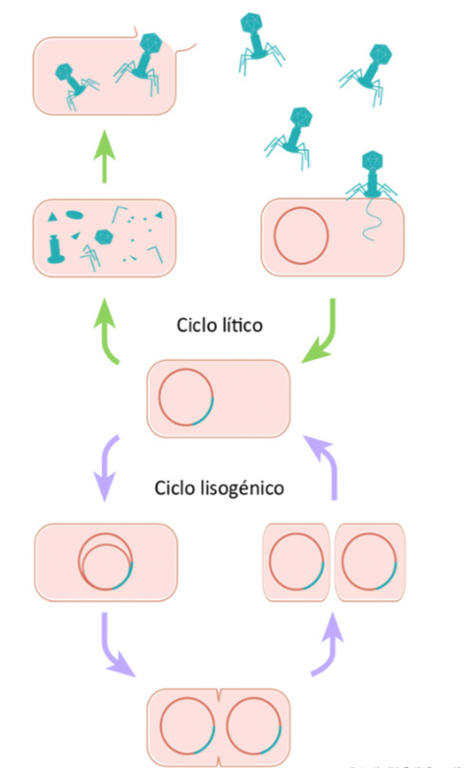
Los fagos, al ser virus que poseen la capacidad de infectar bacterias, se unen a determinados receptores de superficie e inyectan su material genético con el fin de que éste se replique empleando la maquinaria celular de sus hospederos bacterianos (Reina y Reina, 2018). Los fagos se caracterizan por tener dos ciclos de replicación denominados líticos y lisogénicos, el primero de mayor interés para el desarrollo de nuevas terapias contra bacterias, ya que destruyen las bacterias directamente, ocasionando que éstas estallen por el rompimiento de su membrana celular.
En el ciclo lisogénico, el material genético del bacteriófago se inserta en la bacteria y permanece latente. Es decir, se mantiene dentro de la célula y se acopla en el cromosoma bacteriano, además de poder ser transmitido en cada división celular. En contraparte, el ciclo lítico, llamado así porque cuando surge la progenie de nuevos bacteriófagos en la célula bacteriana, ésta muere por la lisis celular. En otras palabras, la bacteria muere por la ruptura de su membrana.
Sin duda alguna, la creciente problemática de resistencia a antibióticos ha posicionado a la fagoterapia como una alternativa prometedora, en especial contra aquellas bacterias que ya han adquirido una resistencia a múltiples antibióticos. Los fagos, al ser específicos para determinadas cepas bacterianas, tienen la capacidad de eliminarlas sin afectar la microbiota (bacterias benéficas) del huésped en comparación con los antibióticos.
Al ser sumamente sencillos los genomas de los fagos, es posible realizar modificaciones mediante técnicas de ingeniería genética y biología sintética. Esto facilita que los fagos acarreen genes, proteínas y moléculas antimicrobianas que puedan atacar de forma más eficiente a las bacterias, en especial a aquéllas que producen biopelículas o biofilms. Es decir, bacterias que sintetizan estructuras poliméricas y que ayudan en la protección contra ambientes hostiles, al conferir una barrera física contra los ataques de los antibióticos convencionales. Este mecanismo favorece la patogenicidad de las bacterias para causar infecciones crónicas, sobre todo en los centros hospitalarios (Reina y Reina, 2018; Chen et al., 2019).
Debido a la capacidad de las bacterias patógenas de formar estas biocapas, se les atribuye una mayor resistencia a los antibióticos; se ha comprobado que la mezcla de diferentes fagos frente a las bacterias responsables de estas infecciones, en el uso en conjunto con un antibiótico, permite aumentar la actividad bactericida. El bacteriófago vuelve más accesibles las dianas farmacológicas a las que se dirige las moléculas antibióticas (Reina y Reina, 2017).
Un ejemplo del uso de estas tecnologías contra biopelículas bacterianas fue el diseño de un fago T7 que acarreaba el gen DspB de Actinobacillus actinomycetemcomitans que codifica para la enzima degradadora de biofilm dispersina B (DspB) y reducía significativamente el recuento bacteriano en la biopelícula de una determinada cepa de Eschericia coli, de un 65.9 y 74.5% en un promedio de 4 y 8 horas, respectivamente.
Por otro lado, los fagos no sólo han sido diseñados contra bacterias formadoras de biopelículas, también como métodos para escindir o romper genes de resistencia a antibióticos. Tal es el caso del uso del sistema CRISPR-Cas9, herramienta de edición del ADN capaz de introducir cambios en el genoma tras reconocer de forma específica la secuencia que se quiere modificar. Un ejemplo es el diseño de fagémidos, fragmentos de material genético circular que poseen genes de un fago que contenían al sistema CRISPR-Cas9 y cuyo blanco era el gen de resistencia a kanamicina aph-3. Este vector fue empacado en el fago ΦNM1 específico para Staphylococcus aureus, en donde al ser evaluado frente a la cepa resistente, se observó una fuerte inhibición del crecimiento bacteriano (Chen et al., 2019).
LOS RETOS EN EL USO DE BACTERIÓFAGOS
Debido a su naturaleza proteica, los bacteriófagos pueden ser reconocidos por el sistema inmune y así perder su eficacia terapéutica, debido a que están sujetos a la desnaturalización o cambios en sus estructuras, se prevé que una posible solución podría ser el uso de nanoacarreadores, moléculas que pueden servir como una cápsula transportadora que los haga invisibles para el sistema inmune, tal y como lo haría un submarino antirradar para evitar ser detectado, y así poder generar el efecto deseado contra las bacterias que causen alguna infección (Lima et al., 2019).
En cuanto a la dosificación, podría representar todo un reto en materia de seguridad porque los fagos poseen la capacidad de transferir ADN de una bacteria a otra. Previo a su uso, habría que modificarlos genéticamente con el fin de que carezcan de dicha capacidad (Furfaro et al., 2018).
Al ser altamente específicos, ante una infección, la etiología bacteriana debería ser inmediatamente determinada, ya que su especificidad podría representar una limitación para aquellas enfermedades causadas por infecciones polimicrobiales. Es decir, aquellas bacterias que poseen inmunidad contra una gama diversa de antibióticos; sin embargo, se ha planteado que la terapia puede ser basada en un coctel de múltiples fagos específicos, con el fin de abarcar el mayor número de especies posibles causantes de infecciones clínicas (Reina y Reina, 2018).
Por otro lado, la naturaleza autorreplicativa de los fagos y la disponibilidad de procesos de producción simples, rápidos y de bajo costo presentan ventajas adicionales para su uso como una terapia antimicrobiana asequible y eficaz (Pires et al., 2016).
DESAFÍOS LEGALES EN MEDICINA
En materia de fagoterapia, en 2008 la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA por sus siglas en inglés) aprobó el primer ensayo clínico (número de registro NCT00663091), donde se evalúo la eficacia y seguridad de la preparación de fagos WPP-201 para el tratamiento de úlceras venosas de la pierna. Esta preparación comprendía ocho bacteriófagos líticos para las bacterias Pseudomona aeruginosa, Staphylococcus aureus y Escherichia coli. A pesar de que no se observaron efectos adversos ante la administración de la terapia, el estudio no continuó a fases de investigación subsecuentes (Rhoads et al., 2009).
La fagoterapia continúa sin ser completamente regulada por las autoridades sanitarias, lo cual se puede observar en el poco número de ensayos clínicos registrados en el Instituto Nacional de Salud de los Estados Unidos (NIH por sus siglas en inglés). Únicamente han sido registrados 15 ensayos clínicos. De éstos, sólo uno ha llegado hasta la fase III. Los restantes han sido retirados o llevados hasta la fase I/II de investigación, e incluso los resultados derivados de dichas investigaciones continúan sin ser publicados. Por lo tanto, continúa la expectativa de los efectos benéficos de esta terapia (Chen et al., 2019; Reina y Reina, 2018).
Es notable el poco desarrollo en materia de investigación clínica en torno a este tipo de terapias. Con todo, uno de los motivos por los cuales aún no hay alguna fagoterapia para uso humano en el mercado es debido a que, en la Unión Europea y en los Estados Unidos, los bacteriófagos han sido clasificados como productos medicinales, por lo que se requieren estudios clínicos estrictos y procedimientos de aprobación complicados (Chen et al., 2019). Sin embargo, se prevé que en un futuro esto cambie.
Otro de los puntos que debe continuar analizándose desde el ámbito de seguridad es que existe la posibilidad de que algunas bacterias generen resistencia contra los fagos mediante la modificación de los sitios diana (receptores celulares de membrana) que permiten la unión del fago a la bacteria. Sin embargo, esta limitación puede ser superada por medio de la edición genética de los fagos (Reina y Reina, 2018).
CONCLUSIÓN
A pesar de que esta estrategia pudiese resultar novedosa, su uso existe desde hace casi cien años, primordialmente en países de Europa Oriental. Sin embargo, a pesar de su enorme potencial como alternativa contra las bacterias multirresistentes, aún no es ampliamente aceptada en Occidente debido quizá al extenso uso y sobreuso de medicamentos por parte de la población. Como toda terapia, ésta también presenta una serie de retos que han causado que aún no sea comercializada o usada de manera cotidiana en pacientes, por lo que se han encaminado grupos de investigación para probar su eficacia y seguridad en las diferentes infecciones por bacterias patógenas.
El aumento exponencial de resistencia a antibióticos continuará impulsando a la comunidad médica y científica a explorar ésta y otras alternativas para el tratamiento de enfermedades. Por esto es importante que seamos conscientes y evitemos el uso indebido de antibióticos con el fin de impedir que más bacterias adquieran estos mecanismos de supervivencia. De esta manera se logrará que la terapia farmacológica contra este tipo de infecciones sea eficaz por más tiempo.
AGRADECIMIENTOS
Por la revisión de la redacción al Est. LLH. Ángel Gamaliel Figón Minor de la Facultad de Filosofía y Letras de la Universidad Autónoma de Nuevo León.
* Universidad Autónoma de Nuevo León.
Contacto: fernanda.velardepdll@uanl.edu.mx
REFERENCIAS
Calvo, J., y Martínez-Martínez, L. (2009). Mecanismos de acción de los antimicrobianos. Enfermedades Infecciosas y Microbiología Clínica. 27(1):44-52.
Centers for Disease Control and Prevention. (2014). Antibiotic Resistance Threats in the United States. Chicago. EE. UU.
Chen, Y., Batra,H., Dong,J., et al. (2019). Genetic Engineering of Bacteriophages Against Infectious Diseases. Front. Microbiol. 10(954):1-9.
Chiou C.C., y Hseih K.S. (2003) Pneumococcal infection in children: rational antibiotic choice for drug-resistant Streptococcus pneumoniae. Acta Paediatr Taiwan. 44(2):67-74.
Dreser, A., Wirtz, V., Corbett, K., et al. (2008) Uso de antibióticos en México: revisión de problemas y políticas. Salud Publica de México. 50(4):480-487.
Furfaro, L., Payne, M., y Chang, B. (2018). Bacteriophage Therapy: Clinical Trials and Regulatory Hurdles. Front. Cell. Infect. Microbiol, 8(376), pp. 1-5.
Leitner, L., Sybesma, W., Chanishvili, N., et al. (2017). Bacteriophages for treating urinary tract infections in patients undergoing transurethral resection of the prostate: a randomized, placebo-controlled, double-blind clinical trial. BMC urology. 17(1):90.
Lima, R., Sá Del Fiol, F., y Balcão, V. (2019). Prospects for the Use of New Technologies to Combat Multidrug-Resistan Bacteria. Frontiers in Pharmacology. 692(10):3-10.
Pires, D., Cleto, S., Sillankorva, S., et al. (2016) Genetically Engineered Phages: a Review of Advances over the Last Decade. Microbiol Mol Biol Rev. 80(3):523-543.
Reina, J. y Reina, N. (2018). Fagoterapia ¿una alternativa a la antibioticoterapia? Rev Esp Quimioter. 31(2):101-104.
Rhoads, D., Wolcott, D., Kuskowski, M., et al. (2009). Bacteriophage therapy of venous leg ulcers in humans: results of a phase I safety trial. Journal of wound care. 18(6):237-243.
Serra, M.A.V. (2017). La resistencia microbiana en el contexto actual y la importancia del conocimiento y aplicación en la política antimicrobiana. Revista Habanera de Ciencias Médicas. 16(3):402-419.