OREXINA Y SUS APLICACIONES EN LA CLÍNICA
Adriana Sánchez-García* Viviana Chantal Zomosa-Signoret*
Rocío Ortiz-López** Román Vidaltamayo***
CIENCIA UANL / AÑO 22, No.93 enero-febrero 2019
Las orexinas, también llamadas hipocretinas, son neurotransmisores peptídicos que se encuentran en una pequeña población de neuronas del hipotálamo descritos por primera vez hace más de 20 años (Sakurai et al., 1998; De Lecea et al., 1998). Se ha estimado un total de 1,500 neuronas orexigénicas en el cerebro del ratón (De la Herrán-Arita et al., 2011), y de 50,000 a 80,000 en el cerebro humano (Ohno y Sakurai, 2008).
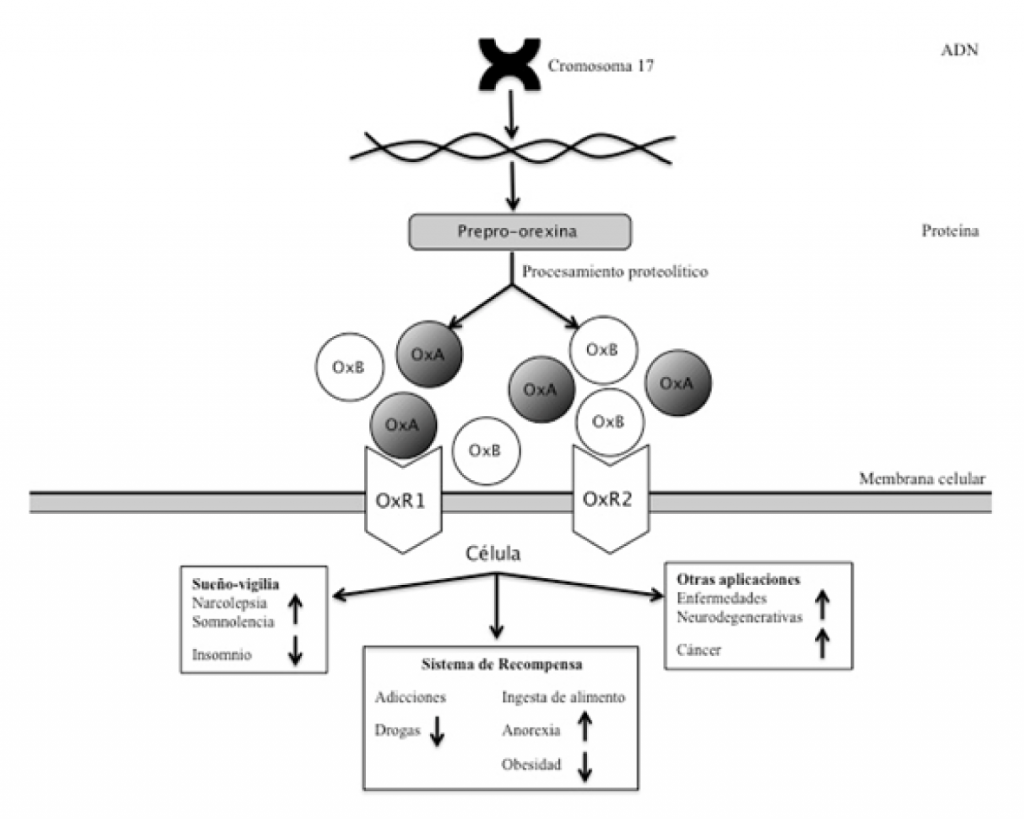
El gen que codifica a este neuropéptido se encuentra bien conservado entre diferentes especies de mamíferos. En el ser humano está localizado en el cromosoma 17q21, con una extensión de 1432 pares de bases (pb) y cuenta con dos exones y un intrón (Sakurai etal., 1999). Fue descrito por primera vez en 1999 y se ha estudiado su regulación a diferentes niveles, encontrando que la modulación del sistema es compleja. A la fecha, se han caracterizado dos isoformas de orexina: orexina A (OxA) o hipocretina 1, y orexina B (OxB) o hipocretina 2, similares en casi 50% de su secuencia de aminoácidos. Ambas provienen de un polipéptido precursor común, la prepro-orexina, que debe ser procesado por enzimas especializadas para dar lugar a ambas isoformas (Ohno y Sakurai, 2008).
Las orexinas ejercen su función al unirse con dos receptores llamados receptor de orexina 1 (OxR1) y receptor de orexina 2 (OxR2), un tipo de receptores acoplados a proteínas G que promueven una cascada de señalización para desencadenar los mecanismos moleculares necesarios para activar sus funciones celulares. Los receptores orexigénicos están localizados a lo largo del sistema nervioso central en regiones como la corteza prefrontal, hipocampo e hipotálamo (Marcus et al., 2001), entre otras, lo cual denota la amplia interacción con otros grupos neuronales y su participación en la regulación en una variedad de funciones. Se sabe que la afinidad por los receptores es diferente para cada una de las orexinas (Ohno y Sakurai, 2008), siendo OxA la más afín y a la que se han enfocado principalmente los estudios de investigación.
El sistema orexigénico es un sistema complejo que recibe e integra múltiples señales locales y sistémicas de tipo neuronal, hormonal y metabólico (Tanaka, 2012). Así, la secreción y expresión de orexina depende también de cambios internos como el pH, el nivel de glucosa y hormonas, además de estímulos ambientales externos como la actividad, la ingesta de alimento y el sueño. La regulación de sus funciones fisiológicas se logra a través de circuitos de retroalimentación incluso a nivel génico, sugiriendo un escenario en el que diferentes mecanismos moleculares se activan en respuesta al medio ambiente para promover o reprimir su actividad y expresión (Tanaka, 2012). Las neuronas orexigénicas, además, reciben y envían estímulos a otras poblaciones neuronales como las neuronas monoaminérgicas, histaminérgicas y colinérgicas para equilibrar su actividad (Sakurai, 2007). Factores humorales involucrados en el metabolismo energético influyen en la actividad de la orexina, lo cual es consistente con la idea de que las neuronas orexigénicas censan el estado nutricional del organismo (Sakurai et al., 1998).
La leptina y la glucosa son efectores metabólicos que disminuyen la producción de orexina mientras que la privación de alimento, el estrés o la actividad física, la incrementan (Tanaka, 2012). Las neuronas orexigénicas evocan la respuesta adaptativa durante la vigilia y el ayuno, por lo que se cree que el estado nutricional envía señales metabólicas que activan a las neuronas productoras de orexinas, activando el estado de alerta para alentar la búsqueda de alimento y la conducta de alimentación (Tsujino y Sakurai, 2013). Estos mecanismos son importantes en el mantenimiento de la vigilia y el estado de alerta durante los periodos de actividad y en la regulación de la homeostasis de energía (Ohno y Sakurai, 2008). Además, a nivel molecular, la expresión de orexina es controlada por distintos mecanismos que regulan la transcripción génica para promover o suprimir su expresión.
FUNCIONES BIOLÓGICAS DE LA OREXINA
La función biológica de la orexina comenzó a elucidarse desde que se estableció la relación directa entre su deficiencia y el trastorno del sueño llamado narcolepsia. La narcolepsia se caracteriza por excesiva somnolencia diurna, cataplexia y manifestaciones anormales del sueño. Aunque no es un padecimiento muy común, el hallazgo evidenció la importancia de la orexina en la regulación del ciclo del sueño-vigilia y en el mantenimiento del estado de alerta (Chemelli et al., 1999; Lin et al., 1999). Así, en estudios posteriores se ha descrito que la orexina participa en otros procesos fisiológicos complejos como la regulación de la ingesta de alimento, el balance energético y el sistema de recompensa (Martynska et al., 2005). Más recientemente, se ha relacionado con el control motor (Hu et al., 2015) y gastrointestinal (Korczynski et al., 2006; Baccari, 2010).

APLICACIONES CLÍNICAS DE LA MODULACIÓN DE LA OREXINA
Por la naturaleza de los procesos integrales en los que participa, en el área de neurociencias el estudio de orexina y su regulación resulta un campo atractivo para el diseño de estrategias que modulen los procesos en los que está involucrada con el fin de ofrecer nuevas opciones, igual o más efectivas que las disponibles actualmente para el tratamiento de desórdenes del sueño, las adicciones e, incluso, de la obesidad a través del control de la ingesta de alimento. El estudio de la orexina y su regulación ha dado pie a un entendimiento más preciso de los mecanismos implicados en el control del sistema orexigénico y se han desarrollado las primeras aplicaciones en la práctica clínica. La comprensión de su biología molecular ha resultado en el diseño de nuevas terapias para el tratamiento de desórdenes del sueño, del apetito, adicciones y cáncer (Xu et al., 2013).

Trastornos del sueño
La participación de la orexina en el control del sueño y de la vigilia es, probablemente, la función más estudiada. Por ello, la aplicación clínica con más progreso es en el tratamiento de los trastornos del sueño.
Las orexinas son fundamentales en la regulación del sueño-vigilia y se consideran neuromoduladores que promueven el estado de alerta. Se ha demostrado que las neuronas que expresan orexina se muestran más activas durante la vigilia y disminuyen su actividad durante el sueño (Sakurai et al., 2005).
La relación directa entre narcolepsia y la deficiencia de orexina evidenció el papel de la orexina en la promoción de la vigilia. Con lo que, en principio, se intuye entonces que bloqueando la actividad de orexina o bien, de sus receptores, podría promoverse el sueño y que, por el contrario, promoviendo su activación se favorece el estado de vigilia y alerta. Es bajo estas premisas que en la práctica se han diseñado compuestos que tienen su acción sobre los receptores orexigénicos.
Promover el sueño es de utilidad en el tratamiento del insomnio. El insomnio es el trastorno del sueño más común que se manifiesta por la incapacidad de dormir o permanecer dormido y puede ser primario o secundario a alguna otra condición médica, como estrés o depresión y a largo plazo afecta el rendimiento cognitivo y físico (Dubey, Handu y Mediratta, 2015); además, afecta hasta a un tercio de los adultos al menos una vez en la vida (Roth, 2007).
La investigación en el área del sueño ha llevado al descubrimiento de nuevos compuestos que tienen como blanco la vía de orexina capaces de producir somnolencia a través del bloqueo selectivo de sus receptores, es decir, son antagonistas. Hay antagonistas diseñados para actuar sobre los dos receptores de orexina (DORAs, antagonistas duales de los receptores de orexina), o bien, sobre uno de ellos específicamente (SORAs, antagonistas individuales de los receptores de orexina).

El suvorexant es el ejemplo mejor caracterizado de los antagonistas de ambos receptores y el primero en su tipo en ser aprobado en 2014 como una nueva opción para el tratamiento del insomnio. La mayor ventaja que ofrece sobre las terapias actuales, de acuerdo a estudio clínicos, es que no causa dependencia (Rhyne y Anderson, 2015). Sin embargo, se reportan efectos indeseables comunes a los tratamientos anteriores como somnolencia y la reducción del estado de alerta posterior a su uso. Otros ejemplos son los compuestos SB-649868 y el filorexant (Chen et al., 2015). Un punto importante a considerar al emplear estos nuevos antagonistas de orexina es si el sueño inducido es de la calidad requerida para producir un descanso similar al que se obtiene con el sueño natural (Dubey, Handu y Mediratta, 2015).
Por otra parte, la promoción del estado de vigilia y alerta también resulta en una alternativa atractiva (Chen et al., 2015). Aunque es una opción menos explorada, bajo las circunstancias adecuadas sería interesante contar con un agonista que mejore el estado de vigilia. Actualmente, se trabaja en el diseño y síntesis de agonistas dirigidos a uno u otro receptor de orexina (Chen et al., 2015), haciendo que el efecto sea más específico. Años de investigación sugieren que los agonistas de receptores de orexina podrían ser útiles en el tratamiento de trastornos del sueño como narcolepsia, cataplexia y somnolencia diurna excesiva, así como déficit de atención, depresión, desorden bipolar y desórdenes cognitivos (Szabadi, 2014; Heifetz, Bodkin y Biggin, 2015).


Trastornos adictivos
La adicción se define como una enfermedad crónica caracterizada por la búsqueda compulsiva de un estímulo, acompañado de la pérdida de control y un estado emocional negativo cuando el estímulo no está disponible (Koob, 2009). La adicción en los seres humanos es un patrón de conducta complejo que involucra componentes emocionales y sociales diversos. En la actualidad, el tratamiento de las adicciones se aborda como un problema integral desde el punto de vista psicológico y biológico. Sin embargo, a la fecha, la terapia disponible no resulta efectiva en muchos de los casos y, más aún, se dificulta con las recaídas que se presentan a largo plazo. En este contexto surge la necesidad de disponer de opciones alternativas que coadyuven o mejoren los tratamientos existentes.
El sistema de recompensa cerebral participa en la mediación de estímulos placenteros, y la orexina se relacionó estrechamente desde hace más de diez años con la modulación del sistema de recompensa (Baimel et al., 2015). Se sabe que los receptores orexigénicos se encuentran distribuidos en varias regiones cerebrales, especialmente en las regiones asociadas al sistema de recompensa (Marcus et al., 2001). La activación repetida de este sistema se relaciona con el establecimiento de una conducta adictiva. Además, la orexina activa las neuronas productoras de dopamina, un neurotransmisor relacionado con la sensación de bienestar (Baimel et al., 2015), reforzando el estímulo placentero. Diferentes investigaciones han mostrado el efecto que se tiene con drogas como alcohol, cocaína, nicotina y morfina (Chen et al., 2015). Se ha demostrado que bloqueando los receptores de orexina se reduce la conducta de búsqueda del estímulo y, por el contrario, la activación aumenta la necesidad del estímulo. De esta manera, compuestos antagonistas de orexina podrían resultar útiles en el tratamiento de las adicciones al disminuir la activación del sistema de recompensa, ofreciendo un complemento a las terapias actuales que permita incrementar el éxito del tratamiento en las diferentes adicciones (Scammell y Saper, 2007). Más recientemente, el nivel de orexina se ha propuesto incluso como un marcador de riesgo para las adicciones (Ziólkowski et al., 2015).

La mayoría de los estudios para el tratamiento de las adicciones se enfocan en el OxR1 (Zhou, Sun y See, 2011). Ejemplos de compuestos empleados, por ahora, sólo los tenemos en modelos murinos para el tratamiento de la adicción: SB-334867 y JNJ-10397049 (Xu et al., 2013). En un estudio hecho en ratas, se demostró que la aplicación intracerebral del antagonista del OxR1 SB-334867 disminuyó la conducta de búsqueda de cocaína sin alterar la conducta normal de búsqueda (Martin-Fardon y Weiss, 2014). En otro estudio hecho por Schmeichel et al. (2015), el tratamiento con el compuesto NBI-80713 (antagonista del OxR2) demostro disminuir la autoadministración de heroína en un modelo de ratas.
Los ejemplos anteriores ilustran buenos resultados con drogas altamente adictivas en modelos animales usando una administración aguda y a corto plazo intracerebral. Sin embargo, los modelos empleados para el estudio de la adicción tienen limitantes en su misma naturaleza para demostrar la efectividad de los antagonistas de orexina. La evaluación de la conducta adictiva en animales, después de un periodo de condicionamiento, no se parece a la situación en el humano, en el que para el desarrollo de la adicción intervienen factores conductuales, psicológicos y sociales. La vía de administración y el esquema de dosis también deberían ajustarse al ser trasladada la aplicación a humanos. Por otro lado, la principal ventaja de un tratamiento basado en orexina sería el control sobre el sistema de recompensa que podría brindar apoyo adicional a la terapia convencional, desde una perspectiva diferente que la complemente. Por el contrario, muy seguramente se observarían los mismos efectos colaterales que se han visto con las terapias del sueño y, en humanos, será necesario demostrar la utilidad en adicciones diferentes a las que involucran sustancias.
Aun con estas limitantes, los ensayos han demostrado resultados alentadores y, por ahora, son el mejor modelo que se tiene para examinar la posible aplicación de orexina en las adicciones. Una vez que se obtengan resultados concluyentes, podría darse el paso necesario para comenzar a probar la eficacia del tratamiento en humanos en situaciones concretas en las que el beneficio potencial supere a cualquier efecto adverso.

Control de la ingesta de alimento
De la mano con el trastorno de la adicción, el control de la ingesta de alimento es otro ámbito en el que la regulación de orexina ha buscado aplicarse, principalmente, para el tratamiento de la obesidad.
La obesidad se define como la acumulación excesiva o anormal de tejido adiposo que afecta la salud, debida principalmente a un desequilibrio entre las calorías ingeridas y las calorías gastadas. A 2014, la Organización Mundial de la Salud reporta que 39% de los adultos tienen sobrepeso mientras 13% tiene obesidad (OMS, 2018). La obesidad trae consigo otras enfermedades crónicodegenerativas como enfermedades cardíacas, diabetes, osteoartrosis y cáncer. La obesidad es una entidad prevenible, y dado que las medidas profilácticas no han dado resultados efectivos, se continúa en la búsqueda de opciones de tratamiento que apoyen las recomendaciones actuales de un estilo de vida más sano, o bien, ayuden a mantenerlo una vez implementado. Por ello, la regulación de orexina se investiga como un tratamiento potencial.
Señales metabólicas como los niveles de glucosa activan las neuronas orexigénicas, promoviendo el estado de alerta y la vigilia para facilitar la búsqueda e ingesta de alimento (Tsujino y Sakurai, 2013), mecanismo de supervivencia importante en la naturaleza. Sin embargo, la activación del sistema de recompensa, asociado a la ingesta de alimentos hipercalóricos y agradables al paladar que generan una sensación de bienestar al ser consumidos, pueden causar una respuesta similar a la que se tiene con otras adicciones, como las drogas. Se ha demostrado que la comida es capaz de activar las mismas vías neuronales de aprendizaje, memoria y motivación que se activan con las drogas, promoviendo la ingesta excesiva de alimento más allá de las necesidades de nutrición. De manera que un nuevo blanco se centra en la reducción de la ingesta de alimento que no tiene como fin la nutrición y es más bien el resultado de la conducta de recompensa, la cual puede ser disparada por estímulos ambientales asociados a comida alta en grasa y azúcar (Reichelt, Westbrook y Morris, 2015). Adicionalmente, otros datos indican que OxA puede ser clave en la resistencia a la obesidad al incrementar el nivel de actividad física espontánea y la termogénesis (Butterick et al., 2013), elevando el gasto calórico basal del individuo.
Los compuestos que intervienen con el sistema de orexina se han utilizado en un intento por modular la ingesta excesiva de alimento, mostrando resultados contradictorios. La administración del antagonista OxR1 SB-334867 disminuyó la respuesta de búsqueda en ratas examinadas en un modelo de recompensa con sacarina (Cason y Aston-Jones, 2013). Más complicado aún resulta el hecho de que la respuesta ante el mismo estímulo es diferente según el sexo de los animales examinados, encontrando un menor efecto en la conducta de búsqueda en esta prueba de sacarina en las hembras (Cason y Aston-Jones, 2014). Por el contrario, el tratamiento con otro antagonista del OxR1 (ACT-335827) en ratas no mostró mejorías en un modelo de obesidad y síndrome metabólico (Rodgers et al., 2013), haciendo necesarios estudios más exhaustivos y en otros modelos que ayuden a corroborar la efectividad real como terapia contra la obesidad.

El extremo opuesto son los desórdenes en los que se restringe la ingesta de alimento, como la anorexia. En pacientes con anorexia se han observado niveles menores de orexina (Chen et al., 2015), con la consecuente disminución del apetito. El tratamiento con el antagonista SB-334867 demostró la reducción de la ingesta de alimento en ratas (Rodgers et al., 2013), por lo que el efecto opuesto podría conseguirse con un agonista, sin embargo, a la fecha no se dispone de estudios hechos en humanos que demuestren esto.
Al igual que con las adicciones, el control de la ingesta de alimento aplicada a humanos resulta más complicada que la observada en modelos animales. Los factores ambientales, como la disponibilidad de comida y la interacción social, dificultan la restricción y los condicionamientos que se manejan en los modelos animales. También es importante considerar que en el control del apetito y la modulación de la ingesta intervienen otros péptidos reguladores (leptina, grelina, neuropéptido Y), cuya contribución no debe desecharse.

Otras aplicaciones potenciales
Reportes más recientes de la participación de orexina en nuevas funciones dejan al descubierto la posibilidad de aplicaciones en otros trastornos.
La orexina se ha relacionado con el cáncer, especialmente con el cáncer de próstata y colón. En células de carcinoma de próstata, se demostró que la administración de OxA causa la sobreexpresión del OxR1, resultando en una disminución de la supervivencia celular (Valiante et al., 2015). Por otro lado, se ha demostrado que el OxR1 promueve la apoptosis en células humanas de cáncer de colón y el tratamiento con orexina reduce su crecimiento, por lo que agonistas de orexina son candidatos para el tratamiento del cáncer de colón (Heifetz, Bodkin y Biggin, 2015). La orexina o sus antagonistas muestran buenos resultados que podrían ser válidos para otros tipos de cáncer, aunque por el momento se limitan a ensayos in vitro.
Las enfermedades neurodegenerativas son otro campo de estudio. Se ha descrito una pérdida parcial de las neuronas orexinérgicas en la enfermedad de Parkinson y trastornos del sueño asociados parecidos a los de la narcolepsia en pacientes que la padecen (Katsuki y Michinaga, 2012), de manera que la activación de orexina podría mejorar estos síntomas. Por otra parte, en la enfermedad de Alzheimer también se observan alteraciones en el ciclo de sueño-vigilia. Estudios en ratones muestran que la disminución en los niveles de orexina reduce la formación del péptido β–amiloide responsable de la formación de placas características del Alzheimer (Roh et al., 2014), por lo que su aplicación representa una alternativa al tratamiento actual.
La pérdida de neuronas que expresan orexina o la disminución de los niveles del neurotransmisor se ha observado en pacientes con depresión, ansiedad y esquizofrenia (Chen et al., 2015), por lo que podría ser un blanco para su tratamiento. La administración de orexina, antagonistas del OxR1 (SB-334867, SB-674042), antagonistas del OxR2 (TCSOX229) y antagonistas de ambos receptores (SB-649868, filorexant) se han empleado en diferentes modelos animales y en humanos con resultados alentadores (Chen et al., 2015) mas no concluyentes, por lo que su potencial aplicación sigue evaluándose.

CONCLUSIONES
Las orexinas son neurotransmisores peptídicos que participan en numerosos procesos fisiológicos cruciales en la conservación de la homeostasis. Debido a la gran cantidad de factores que afectan su actividad, es difícil establecer puntualmente cómo se lleva a cabo su regulación; sin embargo, ha sido posible identificar puntos clave. El objetivo final es la intervención de los procesos en que participa para tratar de manera específica y dirigida desórdenes del sueño, control de la ingesta de alimento y de conductas adictivas desde una perspectiva innovadora, eficiente y directa a nivel cerebral. Sin embargo, el sistema orexigénico es un sistema integral que regula numerosas funciones, por lo que se deben considerar las vías neuronales secundarias que serían alteradas y tener en cuenta los posibles efectos a corto y largo plazo. Es necesario estudiar cuidadosamente qué pasa cuando se deprime o activa el sistema orexigénico, sin afectar la función normal de alerta y motivación. La continua investigación permitirá refinar el conocimiento de cómo actúa la orexina molecular, local y sistémicamente para alcanzar la especificidad en sus aplicaciones, obteniendo el máximo beneficio con el mínimo riesgo. Aún es pronto para pensar en intervenciones totalmente efectivas, pero se han dado los primeros acercamientos con el uso de los antagonistas de receptores de orexina. Así, el campo de estudio ofrece un importante potencial de investigación para explorar en años venideros.
* Universidad Autónoma de Nuevo León.
** Instituto Tecnológico y de Estudios Superiores de Monterrey.
*** Universidad de Monterrey.
Contacto: asanchezg@meduanl.com
REFERENCIAS
Baccari, M.C. (2010). Orexins and gastrointestinal functions. Curr. Protein. Pept. Sci. 11(2): 148-155.
Baimel, C., Bartlett, S.E., Chiou, L.C., et al. (2015). Orexin/hypocretin role in reward: implications for opioid and other addictions. British Journal of Pharmacology. 172: 334-348.
Butterick, T.A., Billington, C.J., Kotz, C.M., et al. (2013). Orexin: pathways to obesity resistance? Rev. Endocrinol. Metab. Disord. 14(4): 357-364.
Cason, A.M., y Aston-Jones, G. (2013). Attenuation of saccharin-seeking in rats by orexin/hypocretin receptor 1 antagonist. Psychopharmacology. 228(3): 499-507.
Cason, A.M., y Aston-Jones, G. (2014). Role of orexin/ hypocretin in conditioned sucrose-seeking in female rats. Neuropharmacology. 86: 97-102.
Chemelli, R., Willie, J., Sinton, C., et al. (1999). Narcolepsy in orexin knockout mice: molecular genetics of sleep regulation. Cell. 98(4): 437-51.
Chen, Q., De Lecea, L., Hu, Z., et al. (2015). The hypocretin/orexin system: an increasingly important role in neuropsychiatry. Medicinal Research Reviews. 35(1):152-197.
De la Herrán-Arita, A.K., Zomosa-Signoret, V.C., Millán-Aldaco, D.A., et al. (2011). Aspects of the narcolepsy-cataplexy syndrome in O/E3-null mutant mice. Neuroscience. 183: 134-143.
De Lecea, L., Kilduff, T., Peyron, C., et al. (1998). The hypocretins: hypothalamus-specific peptides with neuroexcitatory activity. Proc. Natl. Acad. Sci. USA. 95(1): 322-327.
Dubey, A.K., Handu, S.S., y Mediratta, P. (2015). Suvorexant: The first orexin receptor antagonist to treat insomnia. J. Pharmacol. Pharmacother. 6(2): 118-121.
Harris, G.C., Wimmer, M., y Aston-Jones, G. (2005). A rolefor lateral hypothalamic orexin neurons in reward seeking. Nature. 437(7058): 556-559.
Heifetz, A., Bodkin, M.J., y Biggin, P.C. (2015). Discovery of the first selective, nonpeptidic orexin 2 receptor agonists. J. Med. Chem. 58(20): 7928-7930.
Hu, B., Yang, N., Qiao, Q.C., et al. (2015). Roles of the orexin system in central motor control. Neurosci. Biobehav. Rev. 49: 43-54.
Katsuki, H., y Michinaga, S. (2012). Anti-Parkinson drugs and orexin neurons. Vitam. Horm. 89: 279-290.
Koob, G.F. (2009). Neurobiological substrates for the dark side of compulsivity in addiction. Neuropharmacology. 56(1): 18-31.
Korczynski, W., Ceregrzyn, M., Matyjek, R., et al. (2006). Central and local (enteric) action of orexins. J. Physiol. Pharmacol. 57(6): 17-42.
Lin, L., Faraco, J., Li, R., et al. (1999). The sleep disorder narcolepsy is caused by a mutation in the hypocretin (orexin) receptor2gene.Cell.6(98):365-376.
Marcus, J., Aschkenasi, C., Lee, C., et al. (2001). Differential expression of orexin receptors 1 and 2 in the rat brain. J. Comp. Neurol.435(1):6-25.
Martin-Fardon, R., y Weiss, F. (2014). Blockade of hypocretin receptor-1 preferentially prevents cocaine seeking: comparison withnaturalrewardseeking.Neuroreport.25(7):485-488.
Martynska, L., Wolinska-Witort, E., Chmielowska, M., et al. (2005).Thephysiologicalroleoforexins.NeuroendocrinolLett. 26:289-292.
Nagahara, T., Sautoh, T., Kutsumura, N., et al. (2015). Design and synthesis of non-peptide, selective orexin receptor 2 agonists. J. Med.Chem.58(20):7931-7937.
Ohno,K.,ySakurai,T.(2008).Orexinneuronalcircuitry:Rolein the regulation of sleep and wakefulness. Frontiers in Neuroendocrinology.29:70-87.
Organización Mundial de la Salud. (2018). Obesidad y sobrepeso.Disponibleen:http://www.who.int/mediacentre/factsheets/ fs311/es/.
Reichelt, A.C., Westbrook, R.F., y Morris, M.J. (2015). Integration of rewards signaling and appetite regulating peptides systems in the control of food-cue responses. Br. J. Pharmacol. 172(22): 5225-5238.
Rhyne, D.N., y Anderson, S.L. (2015). Suvorexant in insomnia: efficacy,safetyandplaceintherapy.TherAdv. Drug. Saf. 6(5): 189-195.
Rodgers, R.J., Wright, F.L., Snow, N.F., et al. (2013). Orexin-1 receptor antagonism fails to reduce anxiety-like behavior in either plus-maze-naïve or plus-maze-experienced mice. Bhev. Brain Res. 243: 213-219.
Roh,J.H.,Jiang,J.,Finn,M.B.,etal.(2014).Potentialroleoforexin and sleep modulation in the pathogenesis of Alzherimer’s disease. J. Exp. Med. 211(13): 2487-2496.
Roth,T.(2007).Insomnia:Definition,prevalence,etiologyand consequences. J. Clin. Sleep. Med. 3: S7-10.
Sakurai, T., Amemiya, A., Ishii, M., et al. (1998). Orexins and orexin receptors: a family of hypothalamic neuropeptides and G protein-coupled receptors that regulate feeding behavior. Cell. 92(4): 573-585.
Sakurai,T.,Moriguchi,T.,Furuya,K.,etal.(1999).Structureand function of the prepro-orexin gene. Journal of Biological Chemistry.274(25):17771-17776.
Sakurai, T., Nagata, R., Yamanaka, A., et al. (2005). Input of orexin/hypocretin neurons revealed by a genetically enconded tracer in mice. Neuron. 46(2): 297-308.
Sakurai, T. (2007). The neural circuit of orexin (hypocretin): maintaining sleep and wakefulness. Nature Reviews Neuroscience.8:171-181.
Scammell, T., y Saper, C. (2007). Orexins: looping forward to slepp, back at addiction. Nat. Med. 13: 126-128.
Schmeichel, B.E., Barbier, E., Misra, K.K., et al. (2015). Hypocretin receptor 2 antagonism dose-dependently reduces escalated heroin self-administration in rats. Neuropsychopharmacology.40(5):1123-1129.
Steiner, M.A., Sciarretta, C., y Pasquali, A. (2013). The selective orexin receptor 1 antagonist ACT-335827 in a rat model of diet-induced obesity associated with metabolic syndrome. Front Pharmacol. 4: 165.
Szabadi, E. (2014). Selective targets for arousal-modifying drugs: implications for the treatment of sleep disorders. Drug DiscoveryToday.19(5):701-708.
Tanaka, S. (2012). Transcriptional regulation of the hypocretin/orexin gene. Vitam. Horm. 89: 75-90.
Tsujino, N., y Sakurai, T. (2013). Role of orexin in modulating arousal, feeding and motivation. Front. Behav. Neurosci. 7: 28.
Valiante, S., Liguori, G., Tafuri, S., et al. (2015). Expression and potential role of the peptide orexin-A in prostate cancer. Biochem. Biophys. Res. Commun. 464(4):1290-1296.
Xu, T.R., Yang, Y., Ward, R., et al. (2013). Orexin receptors: multi-functional therapeutic targets for sleeping disorders, eating disorders, drug addiction, cancers and other physiological disorders. Cell Signal. 25(12): 2413-2423.
Zhou, L., Sun, W.L., y See, R.E. (2011). Orexin receptor targets for anti-relapse medication development in drug addiction. Pharmaceuticals. 4: 804-821.
Ziólkowski, M., Czarnecki, D., Budzynski, J., et al. (2015). Orexin in patients with alcohol dependence treated for relapse prevention: A pilot study. Alcohol Alcohol. pii: agv129.
