El brillo que ilumina a la ciencia
Jessica Jaramillo*
CIENCIA UANL / AÑO 17, No. 65, ENERO – FEBRERO 2014
Comida que brilla en la oscuridad, ovejas fluorescentes o plantas que sirvan como alumbrado público son cosas que bien pudieran estar sacadas de algún cuento de ciencia ficción o aún lejanas de la realidad.
Pero no se trata de ningún invento producto de la imaginación de alguien, sino de aquéllos que forman parte de los avances que la ciencia ha conquistado paso a paso, a través de años de investigaciones en el tema de la bioluminiscencia, que ahora puede dar las características de luz propia a organismos más allá de las luciérnagas y las medusas.
Qué es la bioluminiscencia
Ciertos organismos vivos producen luz como resultado de una reacción química dentro de sus cuerpos, proceso al que se denomina bioluminiscencia. En éste, la oxidación de un sustrato de proteína es catalizada por una enzima. Existen dos organismos bioluminiscentes a partir de los cuales se ha investigado: las luciérnagas y las medusas.
Las primeras sintetizan la sustancia denominada luciferina, que se oxida con la ayuda de la enzima luciferasa. Esta reacción se lleva a cabo prácticamente sin pérdida de energía. Las medusas poseen una proteína capaz de recibir luz de alta energía (normalmente en el rango del UV), denominada proteína verde fluorescente (GFP, por sus siglas en inglés), que emite fluorescencia en el rango de la luz verde.
La bioluminiscencia está bastante generalizada en hábitats marinos. Se cree que más de 90% de las especies animales de la porción media y abisal del océano emiten algún tipo de bioluminiscencia. En tierra, se limita al reino de los hongos e invertebrados.
GFP
La GFP es producida por la medusa Aequorea victoria. El gen que codifica esta proteína, que ya ha sido clonado, se utiliza como marcador en biología molecular. El descubrimiento y estudio de la GFP amplía la capacidad del microscopio óptico y otorga una nueva dimensión visible al ojo humano.
La GFP puede utilizarse como marcador de biomoléculas y para seguir procesos como la migración celular. Gracias a este uso se ha reducido el efecto perjudicial de marcadores fluorescentes químicos, los cuales eran empleados en las investigaciones. Un fluoróforo, tras cierto tiempo de exposición a la luz, libera un electrón que reacciona con el oxígeno, originando radicales tóxicos que dañarían la célula e incluso le causarían la muerte. La estructura de GFP evita ese impacto, pues cuando el fluoróforo libera un electrón, los radicales resultantes quedan dentro de la proteína sin tocar la célula.
Una característica importante de la GFP es que no necesita aditivos para brillar, en contraste con otras proteínas bioluminiscentes; es suficiente irradiarla con luz UV o azul para que emita fluorescencia.
Permite ver procesos previamente invisibles, como el desarrollo de neuronas, cómo se diseminan las células cancerosas, el desarrollo de la enfermedad de Alzheimer, el crecimiento de bacterias patogénicas, la proliferación del virus del SIDA, entre otros.
La historia del descubrimiento de esta proteína inició en los años sesenta y fue desarrollándose a través de varias décadas, gracias a Osamu Shimomura, Martin Chalfie y Roger Y. Tsien, quienes recibieron en partes iguales el Premio Nobel de Química 2008.
Estos investigadores nunca colaboraron directamente entre ellos, ni siquiera el estudio de la GFP era el principal foco de sus carreras científicas; sin embargo, gracias a sus contribuciones, surgió el uso de esta proteína que proporcionó una poderosa variedad de herramientas para visualizar la biología celular en funcionamiento.
En los años sesenta, Osamu Shimomura investigó el fenómeno de bioluminiscencia. Años más tarde, al estudiar la medusa Aequorea victoria, identificó los órganos de luz que eran responsables de la fluorescencia azul que emitía, y junto a Frank Johnson aisló una proteína bioluminiscente dependiente del calcio, a la que llamaron aequorina. Shimomura descubrió que la luz azul emitida por esta última era absorbida por una segunda proteína (más tarde llamada GFP), la que a su vez reemitía luz verde.
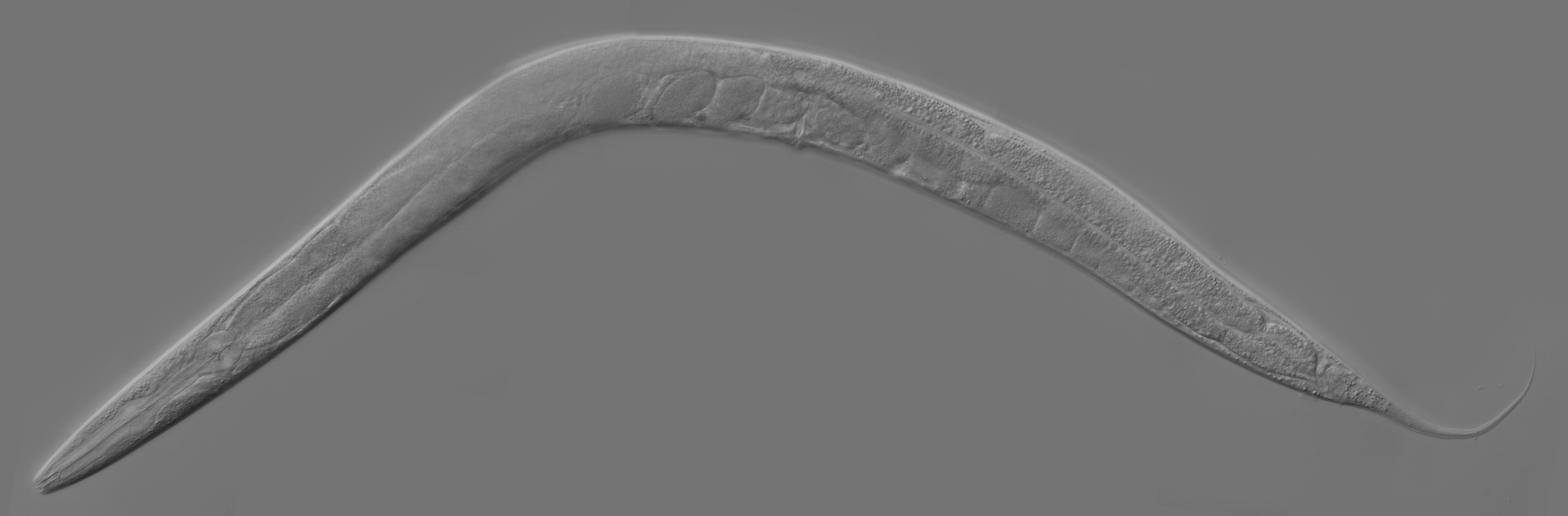
En 1988, Martin Chalfie, mediante técnicas de biología molecular, introdujo el gen que codificaba para la GFP en el ADN de gusano transparente Caenorhabditis elegans, de modo que las células de los gusanos producían GFP y emitían luz verde, sin necesidad del agregado de componentes adicionales y sin daño para el gusano.
Roger Y. Tsien modificó la estructura de la proteína para producir moléculas que emitían luz a distintas longitudes de onda y produjo marcadores de distintos colores. Por otro lado, su grupo agregó nuevas moléculas fluorescentes provenientes de otras fuentes naturales.
La GFP se modificó para producir variantes que emiten en regiones del azul (BFP), cian (CFP) y amarillo (YPF). A partir del descubrimiento de la primera proteína fluorescente roja en un coral no bioluminiscente, la llamada Desired RED protein (DsRED), el grupo de Tsien desarrolló proteínas más pequeñas y luego una serie como la mPlum, mCherry, mStrawberry, mOrange y mCitrine, de acuerdo al color de su brillo. Otros investigadores y compañías han contribuido con nuevos colores a esta resplandeciente gama.
La DsRED, más grande y pesada que la GFP, no es tan versátil como marcador de procesos biológicos. El grupo de investigación de Tsien rediseñó la DsRED para lograr proteínas estables, fluorescentes y de una sola cadena de aminoácidos.
Las proteínas fluorescentes se utilizan en la microbiología, ingeniería genética, fisiología y aplicaciones en biotecnología, incluyendo la detección de arsénico en los pozos de agua. Éste es un enorme problema en partes del sudeste de Asia, donde se producen intoxicaciones por arsénico de forma natural, afectando a miles de personas. Los investigadores han modificado genéticamente bacterias resistentes al arsénico para que se iluminen en presencia de este elemento. También han modificado otros organismos para que emitan fluorescencia en presencia del explosivo trinitrotolueno (TNT) o metales pesados como el cadmio o zinc.
Arcoiris cerebral o brainbow
En 2007, un grupo de investigadores de la Universidad de Harvard desarrolló un mapa para representar el sistema nervioso, el cual, mediante la combinación de proteínas fluorescentes, muestra las neuronas y otras células cerebrales en colores diferentes, permitiendo analizar el sistema nervioso y clasificar los procesos neuronales.
Algunos ratones fueron modificados genéticamente para producir determinadas cantidades de proteínas con colores amarillo, cian y rojo, en células nerviosas individuales del cerebro. El resultado fue un cerebro que brilla con noventa tonalidades diferentes. Los investigadores podían así seguir las fibras nerviosas de células individuales dentro de una densa red en el cerebro.
Las imágenes fueron llamadas brainbow, el arcoiris cerebral. Se utilizó la técnica Cre-lox P, que consiste en cortar y pegar de forma aleatoria trozos de ADN, en el gen Thy1, que es responsable de la producción de una gran variedad de neuronas. Así se seleccionó ADN de hasta cuatro proteínas fluorescentes de los colores antes mencionados, lo que generó un gran número de combinaciones.
Jeff Lichtman, uno de los autores del trabajo publicado por la revista Nature, profesor del Departamento de Biología Celular y Molecular y del Centro de Ciencias del Cerebro de la Universidad de Harvard, explicaba entonces que esta técnica utiliza las proteínas para después representar las neuronas de la misma forma que el monitor de un televisor mezcla el rojo, el verde y el azul para representar una amplia selección de colores.
Ovejas fluorescentes
Durante 2013, el esfuerzo conjunto de un grupo de investigadores que iniciara su aventura desde 2009, rindió frutos con el nacimiento de los primeros borregos transgénicos en Sudamérica, los cuales, además, brillan en la oscuridad.
El Instituto de Reproducción Animal Uruguay (Irauy) es el escenario en el que ahora se desarrollan estas nueve ovejas que nacieron en 2011, un esfuerzo en conjunto con la Unidad de Animales Transgénicos y de Experimentación del Instituto Pasteur de Montevideo (IPM).
A las ovejas se les incorporó el gen que produce la GFP, durante la fase embrionaria, para identificar si el animal es transgénico o no gracias a la luminiscencia de su piel. Esto sirvió como prueba de concepto, para poner la técnica a funcionar, de acuerdo al doctor Alejo Menchaca, veterinario fundador del Irauy, quien dirigió el estudio junto a Martina Crispo, encargada de la unidad del IPM.
El objetivo principal de esta investigación fue generar conocimiento que ayude a investigaciones futuras. «Ahora, con la técnica en nuestras manos, podemos trabajar con otros genes de mayor interés», explicaba Menchaca en entrevista.
Un gen de interés podría ser, por ejemplo, el encargado de la producción de la hormona de crecimiento en el ser humano, el cual se agrega a un embrión de una vaca, oveja o cabra, para que lo incorpore a su ADN y en un futuro produzca en su leche esa hormona. Después se aísla la proteína y se elabora el medicamento que consumirá la persona con enfermedades endócrinas. Este proceso haría más accesibles los costos entre la población.
Otra forma de alumbrar, luciferina y luciferasa
El otro método utilizado para la bioluminiscencia parte de las luciérnagas y las reacciones luciferina-luciferasa, en las que una sustancia luminiscente (luciferina) es oxidada por la acción catalizadora de una enzima (luciferasa).
El sistema bioluminiscente de las luciérnagas se utiliza ampliamente en microanálisis para diagnóstico de la contaminación del medio ambiente, para control de calidad de los productos de la industria alimenticia, para la detección de la cantidad de los microorganismos durante los procesos de fermentación y en las muestras biológicas de laboratorios de investigación o clínicos, entre otros.
Plantas brillantes para iluminar calles
Existen otras propuestas que no buscan sólo desarrollar el conocimiento, sino generar iniciativas masivas que modifiquen nuestra cotidianeidad. Tal es el caso del proyecto Glowing Plant (planta brillante), a cargo de la compañía Genome Compiler, que desarrolla plantas transgénicas fluorescentes, con la idea de que algún día lleguen a reemplazar al alumbrado público tradicional.
La iniciativa aplica la luciferasa en la planta Arabidopsis thaliana, la primera cuyo genoma se conoció completo, con el fin de que brille en la oscuridad. Esta mutación es posible gracias a una bacteria llamada Vibrio fischeri (relacionada con el virus del cólera), que tiene la capacidad de ser fluorescente. Los genes encargados del brillo son incluidos en otro organismo conocido como Agrobacterium, que posteriormente se integra a diferentes especies de plantas. La empresa tiene la intención de utilizar esta tecnología para crear plantas y árboles fluorescentes más grandes que se localicen en las calles públicas.
El proyecto se dio a conocer de forma masiva gracias a la plataforma de financiación colectiva Kickstarter, pues inicialmente consiguieron que más de nueve mil microinversores donaran una suma mayor a 400,000 dólares, cuando sólo pedían alrededor de 67,000. Por 50 dólares se ofertaban las semillas modificadas y por 150 dólares una rosa brillante. Sin embargo, el proyecto fue rechazado por Kickstarter, quien a partir de entonces cambió las reglas para no aceptar más proyectos relacionados con la biotecnología.
El equipo de trabajo no se desanima y sigue adelante con la fecha de entrega de las primeras semillas para mayo de 2014.
Fluorescencia para evaluar agentes infecciosos
En España, cuatro grupos de investigación de la Red de Enfermedades Tropicales (Ricet), perteneciente al Instituto de Salud Carlos III, han desarrollado unas proteínas fluorescentes rojas, a partir de la luciérnaga y el pólipo marino Renilla reniformis, que permitirán evaluar la patogenicidad en tiempo real, hacer estudios de cribado de fármacos de alto rendimiento y constituirán un sistema de alerta en ciertas enfermedades mucho más precoces que los propios síntomas. Además, reducirán 90% la cantidad de animales que exige sacrificar la actual metodología utilizada en experimentación.
La investigación comenzó en 2010 y utiliza una cepa de leishmania que fue modificada genéticamente para que contenga la proteína mCherry.
Helado brillante
Ahora, incluso la GFP se está empleando para trivialidades que podrían causar gracia, como el primer helado fluorescente creado por Charlie Francis, fundador de la firma Lick me I’m delicious.
Para lograr su cometido, Francis pidió a un grupo de científicos chinos que sintetizaran y produjeran en laboratorio la proteína responsable de la fluorescencia, la cual se activa al pasar la lengua por el helado (gracias a las diferencias en el nivel de pH más caliente de la boca y el pH más neutro del helado), dándole ese característico tono verde brillante.
Si hoy en día la GFP se encuentra hasta en los juguetes que se iluminan en la oscuridad, es muy probable que en un futuro no muy lejano sea empleada para los usos menos imaginados.
* Universidad Nacional de San Martín, Argentina.
Contacto: jaramillo.jess@gmail.com
Referencias
1. Ilyina, A.D., Cerda, F.R., Estrada, B.C., Dukhovich, A.F., Gaona, L.G.J., Garza, G.Y., Rodríguez, M.J. Sistema bioluminiscente luciferina-luciferasa de las luciérnagas. “Parte I: Propiedades bioquímicas y catalíticas de la enzima luciferasa”. Journal of the Mexican Chemical Society [en línea] 1998, 42 (mayo-junio) : [fecha de consulta: 18 de noviembre de 2013] Dis- ponible en: <http://www.redalyc.org/articulo. oa?id=47542301>ISSN 1870-249X
2. EcuRed [en línea] [fecha de consulta: 18 de noviem- bre de 2013] Disponible en: <http://www.ecured.cu/ index.php/Bioluminiscencia>
3. Pérez Millán, María Inés and Becú-Villalobos, Damasia. “La proteína verde fluorescente ilumina la biociencia”. Medicina (B. Aires) [en línea] Jun 2009, vol.69, no.3, p.370-374. [fecha de consulta: 05 de noviembre de 2013] Disponible en: <http:// www.scielo.org.ar/pdf/medba/v69n3/v69n3a15.pdf> ISSN 0025-7680
4. Furtado, Sonia. “Pintando en verde: GFP”. Science in school [en línea] Octubre de 2013 [fecha de consulta: 14 de noviembre de 2013] Disponible en: <http:// www.scienceinschool.org/2009/issue12/gfp/spanish> ISSN 1818-0361
5. Pais, Ana. “Los corderos que iluminan a la ciencia nacional”. Cromo [en línea] Abril 2013 [fecha de consulta: 30 de octubre de 2013] Disponible en <http:// www.cromo.com.uy/2013/04/los-corderos-que-iluminan-a-la-ciencia-nacional/>
6. López, Ángeles. “El arco iris del cerebro”. El mundo.es [en línea] Noviembre 2007 [fecha de consulta: 18 de noviembre de 2013] Disponible en <http:// www.elmundo.es/elmundosalud/2007/11/02/ neurociencia/1193990922.html>
7. Romá, Carlos. Pintando el cerebro (2/2): más allá del arco iris. Hablando de ciencia [en línea] Febrero 20120 [fecha de consulta: 20 de noviembre de 2013] Disponible en <http://www.hablandodeciencia.com/ articulos/2012/02/20/pintando-el-cerebro-22-mas- alla-del-arco-iris/>
8. Rizzi, Paula. Árboles fosforescentes para alumbrar calles: ¿solución o desastre ambiental? ADN Discovery [en línea] Mayo de 2013 [fecha de consulta: 15 de octubre de 2013] Disponible en <http:// adn.tudiscovery.com/arboles-fluorescentes-para-alumbrar-calles-solucion-o-desastre-ambiental/>
9. Glowig Plant. [fecha de consulta: 20 de octubre de 2013] Disponible en <http://glowingplant.com/>
10. Proteínas fluorescentes y bioluminiscentes obtenidas de la luciérnaga y un pólipo marino reducen un 90% la cantidad de animales sacrificados para experimentación. Noticias médicas [en línea] Marzo de 2013 [fe- cha de consulta: 22 de noviembre de 2013] Disponible en <http://www.portalesmedicos.com/medicina/ noticias/19092/1/Proteinas-fluorescentes-y- bioluminiscentes-obtenidas-de-la-luciernaga-y-un- polipo-marino-reducen-un-90-la-cantidad-de-animales-sacrificados-para-experimentacion/Page1.html>
11. El primer helado fluorescente. ABC.es [en línea] No- viembre de 2013 [fecha de consulta: 13 de noviembre de 2013] Disponible en <http://w>ww.abc.es/ciencia/ 20131112/abci-primer-helado-fluorescente- 201311121615.HTML>