Caracterización de tetraploides y formación de híbridos triploides en tomate de cáscara
FRANCISCA RAMÍREZ GODINA*, VALENTÍN ROBLEDO TORRES*, RAHIM FOROUGHBAKHCH POURNAVAB**, ADALBERTO BENAVIDES MENDOZA*, MARCO ANTONIO ALVARADO VÁZQUEZ**, DEYANIRA QUISTIAN MARTÍNEZ**
CIENCIA UANL / AÑO 16, No. 64, OCTUBRE-DICIEMBRE 2013
El presente artículo está basado en la investigación “Caracterización de tetraploides y formación de híbridos triploides en tomate de cáscara (Physalis ixocarpa Brot.)”, galardonada con el Premio de Investigación UANL 2013, en la categoría de Ciencias de la Tierra y Agropecuarias, otorgado en sesión solemne del Consejo Universitario, en septiembre de 2013.
El tomate de cáscara, tomate verde o tomatillo Physalis ixocarpa Brot., es una especie nativa de México y Centroamérica, y su aprovechamiento se remonta a épocas prehispánicas. (1) El tomatillo es un ingrediente de platillos mexicanos con frecuencia usado en lugar de tomate rojo (Lycopersicon esculentum Mill), debido a su color verde y acidez. Es fuente de vitaminas A y C, y se ha sugerido que los productos químicos aislados del tomatillo, como el ixocarpalactone A, poseen propiedades quimiopreventivas al cáncer de colon.2 Actualmente es uno de los cultivos hortícolas más importantes de México, (3) ocupa el cuarto lugar entre las hortalizas en superficie sembrada: 48475.17 has. (4)
El contenido de humedad del tomatillo es de aproximadamente 92%, y de la materia seca: 11% es proteína, 18% grasas, 13% ceniza y 5% fibra alimenticia total, 53% de carbohidratos; el contenido calórico es de 31 Kcal 100g-1 y un pH de 3.76.5 La importancia adquirida por este cultivo se debe al aumento significativo en el consumo per cápita (4.5 kg) a nivel nacional, así como al aumento de la exportación a los Estados Unidos de Norteamérica y Canadá. (6)
A pesar de la amplia variabilidad genética, tanto en el tomate silvestre como en el domesticado, (7) el rendimiento medio nacional es de 15.58 t ha-1, el cual se considera bajo, de acuerdo al rendimiento potencial de 40 t ha-1.
La autopoliploidía es un estado biológico inducible caracterizado por la duplicación del número de genomas de un mismo individuo, con lo cual se logra incrementar la variabilidad genética, que puede ser aprovechada por los fitomejoradores. La autopoliploidía aumenta el tamaño efectivo de la población e incrementa la flexibilidad genómica, y facilita así el manejo de la selección artificial. La redundancia genética permite la divergencia adaptativa de genes duplicados. (8) El mejoramiento genético mediante la formación de tetraploides en especies como sandía, papa, plátano espárragos, café, cítricos, y la obtención de híbridos triploides ha originado importantes avances. La utilización de autotetraploides y diploides de tomate de cáscara previamente caracterizados y seleccionados como parentales, así como la obtención de híbridos triploides podría aumentar los rendimientos y mejorar características agronómicas en esta especie, en la cual la hibridación mediante la utilización de líneas endogámicas no es posible, debido a que presenta autoincompatibilidad gametofítica. (9) El objetivo de este trabajo fue caracterizar y seleccionar autotetraploides para generar híbridos triploides de tomate de cáscara de alto rendimiento.
MATERIALES Y MÉTODOS
El material inicial utilizado consistió en semillas de cinco poblaciones tetraploides: 2T, 5T, 11T, 16T y 20T, formadas por acción de la colchicina10 y cinco diploides originarias de México: (19D) variedad rendidora, de la cual se formaron las poblaciones autotetraploides, (13D) gran esmeralda (población mejorada), (1D) criollo (Acatzingo, Puebla), (21D) criollo (Quecholac, Puebla) y el (18D) criollo morado tamazula (Arandas, Jalisco). Diez híbridos triploides formados del cruzamiento de tetraploides por diploides. La evaluación en campo de componentes de rendimiento y calidad de fruto de los materiales citados se realizó en 2009, 2010 y 2011, en General Cepeda, Coahuila (25° 23 ́ 02 ́ ́ LN; 101° 27 ́ 10 ́ ́ LO;1480 msnm, ambiente 1), en el campo agrícola experimental de la Universidad Autónoma Agraria “Antonio Narro”, en Saltillo, Coahuila (25° 22 ́ LN; 101° 00 ́ LO; 1742 msnm, ambiente 2), y en los laboratorios de los Departamentos de Fitomejoramiento y Horticultura de la misma Universidad.
Análisis del nivel de ploidía
Se inició con la caracterización citogenética de los autotetraploides y diploides para determinar el nivel de ploidía de dichos materiales, esto fue por análisis mitótico con la técnica del proceso enzimático, estandarizada para tomate de cáscara. (11) Para esto se pusieron a germinar 20 semillas en cajas Petri de cada población. Las células con cromosomas en metafase se obtuvieron de puntas de raíces de semillas en germinación, además se confirmó el nivel de ploidía mediante análisis de citometría de flujo, que se realizó en el Laboratorio Nacional de Genómica para la Biodiversidad (Langebio) en el Cinvestav de Irapuato, Guanajuato, de acuerdo al protocolo del equipo (Partec CyStain UV precise P-05-5002).
Establecimiento en campo
Para la producción de plántulas se sembraron 100 semillas de cada población en charolas de germinación, colocando una semilla por cavidad, a una profundidad de 0.5cm. Posteriormente, las charolas se llevaron al invernadero para acelerar el proceso de geminación; tres días después se colocaron las charolas en un contenedor con agua a una altura de 5cm, donde se mantuvieron alrededor de treinta días. Cuando las plántulas alcanzaron de 10 a 12cm de altura y dos pares de hojas verdaderas, fueron llevadas a campo para su trasplante.
El trasplante en campo fue bajo el diseño experimental de bloques al azar, con cinco repeticiones; las camas de siembra fueron preparadas con una bordeadora, posteriormente fue colocada manualmente la cinta de riego y el acolchado plástico. Las camas de siembra fueron de 5 metros de largo y 1.80 m de ancho y con una separación de 60 cm entre plantas y dos hileras por cama, con una separación de 30 cm entre éstas, la parcela útil fue de diez plantas con competencia completa.
Análisis de viabilidad de polen
Para el análisis de polen, 30 días después del trasplante se tomaron florecillas de tres plantas por población en cada una de las repeticiones. La viabilidad de polen se estimó por la técnica de tinción con colorante acetocarmín a 1%. (12)
Evaluación de componentes de rendimiento y calidad de fruto
Las variables evaluadas en las dos localidades fueron de rendimiento total de fruto (RTF), que se determinó al momento de cosecha, pesando todos los frutos producidos por planta: peso promedio de fruto (PPF), número total de frutos por planta (NTF). Las tres variables anteriores fueron estimadas de una muestra aleatoria de diez plantas en cada una de las repeticiones, en cinco cortes con intervalos de ocho días. Las variables diámetro polar (DPF) y diámetro ecuatorial de fruto (DEF) se midieron con un vernier digital de precisión (AutoTECTM), en tres frutos por planta de tres plantas tomadas al azar de cada población y por repetición, del segundo, tercero y cuarto corte.
Se estimaron sólidos solubles totales (SST) en jugo de frutos, mediante un refractómetro Atago N-1E. y expresada en °Brix, la firmeza de fruto (FF) se determinó con un penetrómetro con soporte marca Frut Presure Tester 13 Kg FT-327 y puntilla de 8 mm, para esto se retiró la cutícula en dos puntos opuestos de la parte ecuatorial del fruto, se introdujo el penetrómetro de un solo impulso hasta la marca y se tomaron dos lecturas por fruto (Kg cm-2), el pH fue estimado en jugo concentrado de frutos frescos, y se utilizó un potenciómetro digital Corning modelo 320, la vitamina C se determinó de acuerdo a la metodología oficial del AOAC,13 estimada en (mg 100g-1). Las cuatro variables antes citadas fueron tomadas en tres frutos por planta de tres plantas seleccionadas al azar de cada población y por repetición, del segundo, tercero y cuarto corte, que se efectuaron a los 84, 93 y 100 días después del trasplante.
Formación y evaluación de híbridos triploides
Para formar los híbridos triploides se utilizaron cinco tetraploides (2T, 5T, 11T, 16T y 20T) selecciona- dos con base en el rendimiento y la calidad de fruto y cinco diploides (1D, 13D, 18D, 19D y 21D). Se sembraron 50 semillas por población en charolas de poliestireno, con turba canadiense como sustrato. Posteriormente, las charolas se llevaron a invernadero donde se desarrollaron las plántulas. Treinta días después, cuando las plántulas alcanzaron de 10 a 12 cm de altura y dos pares de hojas verdaderas, se trasplantaron en invernadero. Se plantaron 50 plántulas (cinco por cada población), en suelo con acolchado y fertiriego, las que se colocaron en pares (una diploide con una tetraploide) para facilitar las cruzas.
Los cruzamientos se realizaron de forma manual, pasando polen de las flores de los diploides a las flores de tetraploides, previamente emasculadas. Cada una de las flores fecundadas se marcó con una eti- queta y se cubrió con una bolsa de papel, se polinizaron diariamente de cinco a diez flores por planta hasta el término de la floración; los cruzamientos fueron de acuerdo al diseño II de Carolina del Norte. Los híbridos triploides obtenidos se verificaron por análisis meiótico en diacinesis de la profase I de la meiosis. (14) Para la evaluación de los componentes del rendimiento y calidad de fruto de los diez híbridos triploides generados por el cruzamiento de diploides por tetraploides, se utilizó el mismo procedimiento descrito anteriormente para los tetraploides y diploides, en lo que se refiere al establecimiento en campo y variables evaluadas.
Análisis estadístico
A las variables rendimiento de fruto, número y peso de fruto, diámetro ecuatorial y polar de fruto, sóli- dos solubles totales, firmeza de fruto, pH y vitamina C, de poblaciones diploides, tetraploides y triploides de tomate de cáscara (tratamientos) se les aplicó el análisis de varianza para el modelo de un diseño de bloques al azar, y la comparación de medias se realizó mediante la prueba de Tukey (p≤0.05). Para ello se utilizó el programa estadístico de SAS versión 9.0.
RESULTADOS Y DISCUSIÓN
Análisis del nivel de ploidía
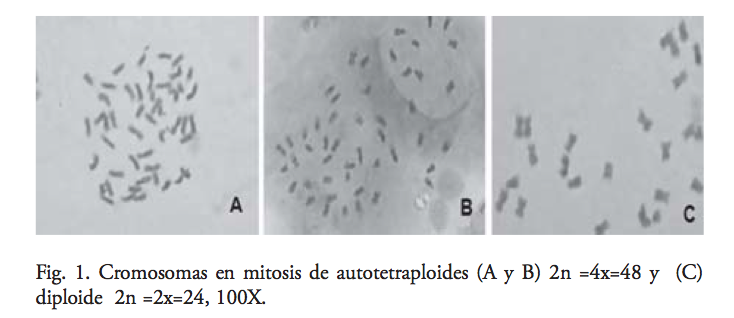
El nivel de ploidía estimado en los diploides fue de 24 cromosomas, que coincide con lo reportado por Menzel y Grimaldo,15,16 quienes mencionan que en tomatillo el número haploide de cromosomas es de 12, es decir, cada una de las células somáticas tiene 24 cromosomas (diploide 2n = 2x = 24). Sin embargo, en las 15 poblaciones autotetraploides de tomate de cáscara estudiadas, se confirmó que su número cromosómico fue 2n = 4x = 48, ratificando la efectividad de la colchicina para duplicar el número cromosómico en tomate de cáscara, aunque se ha encontrado que la inducción de poliploidía en otras especies puede ser poco estable, ocurriendo el restablecimiento del número diploide de cromosomas17 (figura 1).
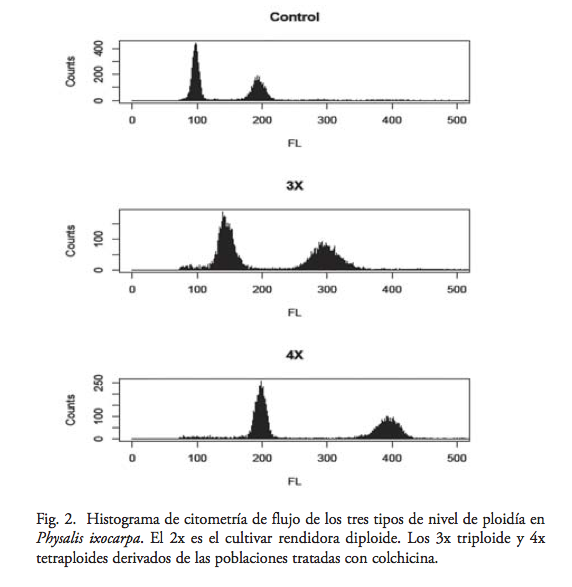
De las 25 plantas analizadas por citometría de flujo se encontró que 20 fueron tetraploides (80%), mientras que cinco mostraron picos en la citometría de flujo, que indican una condición triploide. En las poblaciones diploides, rendidora (19D), morado tamazula (18D) y el criollo de la región Palmarito (21D), utilizados como plantas control, el citómetro mostró perfiles que indican un estado diploide. La distribución del pico principal de fluorescencia en las 25 plantas experimentales y el grupo control diploide mostraron una distinción entre materiales con condiciones 2X, 3X y 4X (figura 2).
Análisis de viabilidad de polen
Se encontró que las poblaciones diploides presentaron de 82.52 a 95.81% de viabilidad de polen, mientras que en los autotetraploides fue de 52.47 a 73.21%. Los diploides presentaron, aproximadamente, de 22.6 a 30.05% más viabilidad de polen que los autotetraploides. La duplicación del genoma en tomatillo produjo una reducción en la viabilidad del polen. Resultados similares encontraron Fernández, Arbo y Fernández (18,19) en otras especies autopoliploides. Los porcentajes más bajos de viabilidad del polen en algunas poblaciones poliploides son el resultado de irregularidades meióticas que conducen a la producción de gametos no balanceados e inviables. He et al. (20) mencionan que la duplicación del genoma juega un papel importante en el desarrollo de polen normal en arroz. De acuerdo con el criterio de Stebbins, (21) los autopoliploides se caracterizan por la presencia de multivalentes en meiosis, dando como consecuencia fertilidad reducida; por lo tanto, baja viabilidad de polen.
Evaluación de componentes de rendimiento y calidad de fruto
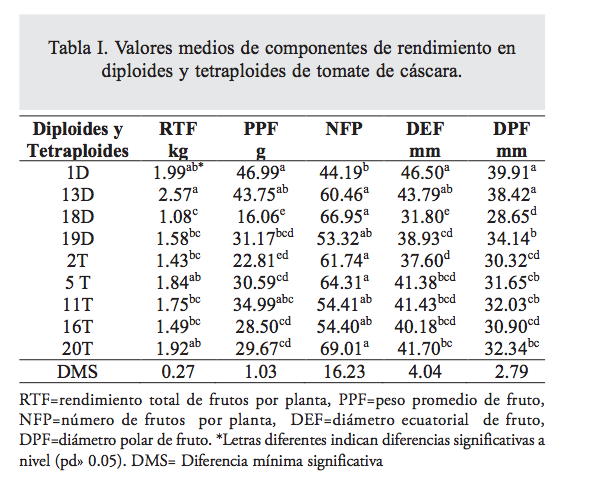
El análisis de varianza mostró diferencias altamente significativas (p<0.01) entre ambientes. Los valores obtenidos en el ambiente 1 fueron superiores en 38.74 en RTF, 58.8 en PPF, 46.67 en DPF y 20.53% en DEF, a los obtenidos en el ambiente 2, solamente en el ambiente 2 se tuvo 9.94% más NFP que en el ambiente 1. Los diploides 1D (1.99Kg planta-1) y 13D (2.57 Kg planta-1) tuvieron los mayores rendimientos, pero fueron iguales a los tetraploides 5T (1.83Kg planta-1), 11T (1.75) y 20T (1.92), estos autotetraploides derivaron de la población diploide 19D (1.58 Kg planta-1), la cual tuvo un rendimiento inferior en 9.87 a 17.70% a dichos tetraploides. Los rendimientos obtenidos en todas las poblaciones bajo estudio superan el rendimiento medio nacional en 87% a 236.39%, y el rendimiento del mejor tetraploide superó el rendimiento medio nacional en 151.18%. Se encontraron diferencias altamente significativas (p<0.01) entre las poblaciones estudiadas para las variables RTF, PPF, DPF, DEF y NFP. En el PPF, los diploides 1D (46.98g) y 13D (43.74g) y el tetraploide 11T (34.98g) fueron estadísticamente iguales (p≤0.05), se encontró que el PPF del diploide 19D fue estadísticamente mayor (F= 41.48 p<0.01) al peso promedio de fruto de los tetraploides (tabla I), esto indica que la poliploidización redujo el PPF, el menor PPF en tetraploides se debe, en parte, a que los tetraploides tuvieron mayor número de frutos, aunque de menor tamaño. El tetraploide 20T con 69 frutos planta-1 fue estadísticamente superior (p<0.05) en NFP a la población 13D, que produjo 60 frutos planta-1, y fue el diploide con mayor rendimiento de fruto.
En DEF, el diploide 1D y 13D fueron estadísticamente iguales (p≤0.05); además, el 13D fue igual (p>0.05) a los tetraploides 5T, 11T, 16T y 20T. Los diploides tuvieron un DPF estadísticamente diferente (p<0.05) a los tetraploides, siendo los diploides 1D (39.91mm) y 13D (38.42mm) los que presentaron los valores más altos (tabla I), el mejor diploide su- peró en 19% al mejor tetraploide, la duplicación del genoma indujo una reducción el DPF.
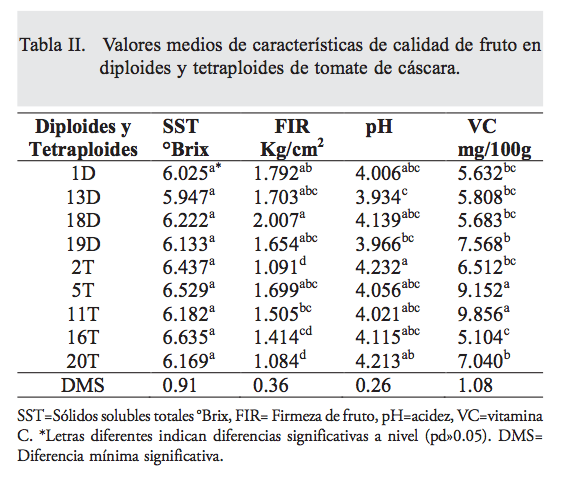
En el análisis de varianza realizado para estimar el efecto de la poliploidía sobre la calidad de frutos de tomate de cáscara, se encontraron diferencias estadísticas significativas entre ambientes para sólidos solubles totales (p=0.005) y pH (p<0.01), indican- do que las poblaciones tuvieron un comportamiento diferencial en los ambientes bajo estudio, mientras que la FF y vitamina C se comportaron estables a través de ambientes. Se presentaron diferencias altamente significativas (p<0.01) entre poblaciones para FF, VC y en pH (p=0.003); sin embargo, en SST no se encontraron diferencias significativas (p=0.237) entre poblaciones; los diploides fueron estadísticamente superiores en FF a los tetraploides (tabla II).
La FF se disminuyó con la duplicación del genoma, la baja firmeza de fruto en los tetraploides se debió a que éstos presentaron un llenado parcial con un hueco entre el endocarpio y mesocarpio; por lo tanto, en la formación de tetraploides y para un pro- ceso de selección se deberá evitar esta característica negativa. Las diferencias estadísticas significativas (p= 0.003) en el pH de los frutos indican la gran variabilidad entre las poblaciones estudiadas; además, es posible tener frutos con diferencias en sabor, aunque esta característica no es influida por la modificación en el nivel de ploidía. El contenido de vitamina C de los diploides fue de 5.6 a 7.5 Mg 100g-1, y en los tetraploides de 5.1 a 9.8; asimismo, se encontró que al duplicar el genoma de tomate de cáscara, se incrementó el diámetro del fruto. Se indica que los poliploides tienen mayor capacidad de producción de metabolitos secundarios; (22) en tomate de cáscara la autopoliploidía favoreció el incremento de vitamina C, mejorando la calidad nutricional del fruto, que resulta relevante, ya que la vitamina C tiene una función importante en la nutrición humana: es un antioxidante que contribuye a la salud humana, se le atribuye el fortalecimiento del organismo en defensa de enfermedades cardiovasculares. (23) Por esta razón, se considera que estos nuevos tetraploides presentan potencial para desarrollar nuevas líneas, o para usarse como progenitores en la producción de híbridos triploides, como ha ocurrido en otros cultivos como melón, en que se han logrado altos rendimientos con el uso de tetraploides. (24,25)
Formación de híbridos triploides
Se obtuvo semilla triploide, producto de diez cruzas que se establecieron en campo para su análisis meiótico. Los resultados obtenidos indican que, al cruzar autotetraploides 4x (formados por la acción de la colchicina usados como hembras) con diploides 2x (usados como machos) sobresalientes en rendimiento, es factible la producción de híbridos triploides en tomate de cáscara (Physalis ixocarpa). Resultados similares encontraron Aleza et al., (26) Maynard et al., (27) Nugent y Adelberg (28) y Estrada, (29) al formar híbridos triploides en especies como sandía, melón, mandarina, limón y papa.
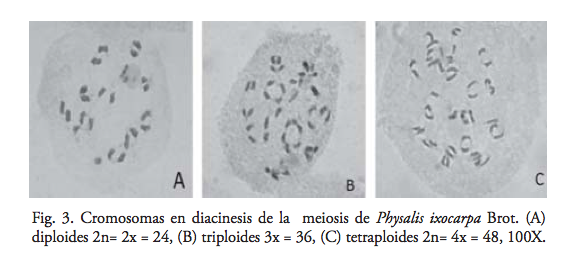
El análisis de los conteos cromosómicos en diacinesis de la meiosis I, de las diez cruzas establecidas en campo, mostró que 83.33% de las plantas presentó el nivel de ploidía esperado que sugiere un porcentaje alto de híbridos triploides 3X; sin embargo, las ploidías de 4X y 2X encontradas, aunque bajas en porcentaje, sugieren la posibilidad de que al menos la 4X sea producto de autofecundación o de apomixis. (30) Además, se observó que los triploides presentaron en diacinesis cromosomas univalentes, bivalentes, trivalentes y tetravalentes.
Esto indica que en los triploides, los cromosomas homólogos no siempre se asocian en bivalentes o univalentes, sino que en ocasiones también ocurren asociaciones de tres o más cromosomas. Jackson y Casey (31) mencionan que en meiosis I, los cromosomas homólogos de los triploides normalmente se asocian en trivalentes, bivalentes y univalentes; esto es, al término de la diacinesis, se juntan tres, dos o un solo cromosoma, respectivamente, o bien sólo se forman univalentes y en anafase los univalentes se dirigen aleatoriamente a cualquiera de los polos de la célula, lo que da lugar a una variación cromosómica y, por tanto, a gametos estériles. En los diploides sólo se observaron bivalentes; sin embargo, en los tetraploides predominaron las asociaciones bivalentes seguidas de las cuadrivalentes, mientras que las univalentes y trivalentes se observaron en mínima cantidad (figura 3). Por tanto, se señalaría que las plantas con 2n=4x=48 cromosomas se comportan citológicamente como autotetraploides, de acuerdo con la clasificación de poliploides propuesta por DeWet. (32) El estudio meiótico se realizó con la finalidad de determinar los niveles de ploidía; por ende, se contó el número de cromosomas por célula, y sólo se hicieron observaciones visuales de las asociaciones cromosómicas.
Rendimiento de fruto de híbridos triploides y sus progenitores
Los análisis de varianza aplicados a progenitores e híbridos exhibieron diferencias significativas (p<0.01) entre híbridos y progenitores para RTF, NF, PPF, DPF, DEF, FIR, SST y pH, lo que sugiere la existencia de variabilidad genética que permite visualizar posibilidades para desarrollar variedades superiores en tomate de cáscara poliploide.
El rendimiento total de fruto (RTF) en las diez cruzas y sus progenitores presentó un rango de 0.915Kg planta-1 (2Tx1D) a 4.264 Kg planta-1 (2Tx13D). La comparación de medias indica que 15 poblaciones integraron el grupo superior con un RTF mayor de 1.5 Kg planta-1, en el cual quedaron incluidas las cruzas 5Tx13D, 20Tx1D, 2Tx13D, 5Tx19D, 11Tx21D, 16Tx1D y 16Tx21D, también se incluyen en este grupo los cinco progenitores diploides y tres de los autotetraploides. Las mejores cruzas en RTF fueron la 2Tx13D, con 4.26 Kg planta-1, y la 11Tx21D con 3.07 Kg planta-1. La cruza 2Tx13D superó en 178.24% y 19.66% a su progenitor tetraploide 2T y al progenitor diploide 13D, respectivamente; la cruza 11Tx21D rindió 145.76% y 0.39% más que su progenitor tetraploide 11T y que su progenitor diploide 21D, respectivamente (figura 4). En rendimiento de fruto de las cruzas, la 2Tx13D y 11Tx21D y 16Tx1D superaron el rendimiento encontrado en los mejores híbridos de las cruzas de las variedades Chapingo x Puebla en tomate de cáscara realizadas planta x planta por Santiaguillo et al. (7)
Además, estos rendimientos superan el rendimiento medio nacional del ciclo de producción 2010, que fue de 15.58 t ha-1, (5) y el potencial productivo de rendimiento de variedades mejoradas de 40 t ha-1. (33) El alto rendimiento en las tres cruzas se debe probablemente a que éstas presentaron un periodo reproductivo más largo y de mayor capacidad de rendimiento que sus progenitores diploides y tetraploides, coincidiendo con lo reportado por Estrada et al., (34) en tomate de cáscara variedad rendidora.
En el NTF se encontró que siete cruzas presentaron de 84 a 149 frutos planta-1 y fueron iguales estadísticamente (p>0.05) a cinco progenitores diploides y cuatro tetraploides.
La comparación de medias para el PPF mostró que la cruza 11Tx21D (37.153g) presentó el mayor peso de fruto, y fue estadísticamente igual (p>0.05) a las cruzas 2Tx13D, 16Tx1D y 16Tx21D y a cuatro progenitores diploides.
En el diámetro polar de fruto (DPF) no hubo variación entre cruzas ni entre progenitores, ya que todos fueron estadísticamente iguales, siendo únicamente diferente la cruza 2Tx1D, que fue la que tuvo el menor DPF.
La cruza 11Tx21D presentó el mayor diámetro ecuatorial de fruto (DEF) 51.66 mm, y fue igual a las cruzas 5Tx13D, 20Tx1D, 2Tx13D, 5Tx19D y 16Tx21D, y a los cinco progenitores diploides y dos tetraploides. Sin embargo, en todas las cruzas fue mayor el DEF que el DPF, dando frutos aplanados de los polos. Peña et al. (35) mencionan que hay una correlación positiva entre número de frutos y rendimiento total, en tomate de cáscara. De igual forma, se encontró que el mayor número de frutos por planta lo presentaron las cruzas con los más altos rendimientos, a excepción de la cruza 20Tx1D, que presentó un gran número de frutos, pero tuvo bajos rendimientos; esto se debe a que esta cruza tuvo plantas quiméricas menos desarrolladas, que dieron frutos pequeños exhibiendo bajo PPF y bajos valores de DEF y DPF. Por el contrario, la cruza 11Tx21D presentó plantas muy vigorosas con frutos grandes, mayor DPF, DEF y alto PPF, aunque con menor NPF; dando, por lo tanto, altos RTF. La forma ovalada o achatada del fruto de los híbridos triploides en tomate de cáscara se debe a que el DEF fue más grande que el DPF, coincidiendo con híbridos triploides obtenidos en otras especies. (26,28,36)
Calidad de fruto en híbridos triploides y sus progenitores
Los progenitores diploides presentaron los valores más altos en FF, y fueron iguales estadísticamente (p>0.05) a las cruzas 20Tx1D, 2Tx13D y 11Tx21D.
Los resultados muestran que ocho híbridos fue- ron iguales (p>0.05) entre sí en SST; asimismo, fue- ron iguales a los cinco diploides y a tres de los progenitores tetraploides. Los valores de acidez del fruto de tomate de cáscara fueron similares para los híbridos triploides, ya que ocho de ellos fueron iguales estadísticamente (p>0.05), además fueron iguales a los diploides y a tres tetraploides, sólo fueron diferentes (p<0.05) dos híbridos y dos progenitores tetraploides. En general, la firmeza de fruto, tanto en híbridos como progenitores tetraploides, fue baja en comparación con la reportada por Santiaguillo et al.; (7) sin embargo, dos de las cruzas más rendidoras presentaron los valores más altos, similares a sus progenitores diploides. De acuerdo con Aleza et al., (26) Nugent y Adelberg, (28) Rhodes y Zhang, (36) los híbridos triploides generalmente presentan esterilidad, debido tal vez a la formación de gametos desbalanceados estériles originando frutos sin semilla. (31)
Una de las causas de baja firmeza en Solanum lycopersicon se debe a que las semillas no se han desarrollado completamente en el lóculo, y como resultado no han liberado hormonas que estimulen la producción de la sustancia amniótica gelatinosa que proporciona firmeza al fruto. (37) Para mejorar esta característica negativa en los híbridos, deberán buscarse nuevas alternativas como las utilizadas por Qiu et al., (38) quienes retrasaron el ablandamiento de los tejidos, al aumentar los niveles de calcio en frutos de papaya, y mantuvieron así la calidad de los mismos. Dos de los híbridos triploides de tomate de cáscara presentaron valores de SST más altos que sus progenitores diploides y tetraploides, estos resultados coinciden con Nugent y Adelberg, (28) quienes encontraron que los híbridos triploides de melón presentaron niveles de azúcar más altos que sus progenitores diploides.
Para el carácter rendimiento de fruto, las cruzas (11Tx21D y 2Tx13D) presentaron valores de heterosis de 44.22 y 67.48%, además estas mismas dos cruzas presentaron heterobeltiosis de 2.20% y 19.76%, respectivamente. Las cruzas 11Tx21D y 2Tx13D presentaron altos valores de heterosis en todas las variables estudiadas. Por lo que los diploides 13D y 21D, y los tetraploides 2T y 11T podrían ser la base de un programa de mejoramiento por hibridación, dado el patrón heterótico detectado.
CONCLUSIONES
Mediante el estudio citogenético y de citometría de flujo, fue posible demostrar la estabilidad cromosómica de los tetraploides formados. La autopoliploidía en Physalis ixocarpa disminuyó la viabilidad del polen, ocasionando pérdida de fertilidad. La duplicación cromosómica en tomate de cáscara contribuyó a la modificación de la forma de frutos, y éstos resultaron de forma achatada de los polos, dejando huecos entre el endocarpio y mesocarpio. La formación de autopoliploides en esta especie permite incrementar los contenidos de metabolitos secundarios, entre éstos la vitamina C, y modificar otras características relacionadas con la calidad del fruto. Se identificaron poblaciones diploides y autotetraploides de alto rendimiento y calidad de fruto. En los híbridos triploides, se encontró amplia variabilidad en los componentes de rendimiento y calidad de fruto, identificando a las mejores cruzas para su explotación a nivel comercial.
RESUMEN
El tomatillo (Physalis ixocarpa Brot.) es de los cultivos hortícolas más importantes de México, aunque presenta rendimientos bajos, debido a que su autoincompatibilidad impide la formación de líneas puras e híbridos. La formación de poliploides sobresalientes de tomatillo es una alternativa para aumentar rendimientos y calidad de fruto. En este trabajo se encontraron diferencias significativas (p<0.01) entre diploides y tetraploides para RTF, NF, PPF, DPF, DEF, FIR, SST, pH y VC. Los híbridos triploides, 2Tx13D y 11Tx21D mostraron heterosis y heterobeltiosis en todas las variables estudiadas. En rendimiento, el triploide 2Tx13D superó en 178.24% al 2T y 19.66% al 13D, el 11Tx21D superó en 145.76% y 0.39% al tetraploide y diploide, respectivamente.
Palabras clave: Poliploides, Autoincompatibilidad, Colchicina, Rendimiento de fruto, Calidad de fru- to, Physalis ixocarpa.
ABSTRACT
The tomatillo (Physalis ixocarpa Brot.) is of major horticultural crops of Mexico, although it has low yields because your self-incompatibility prevents the formation of pure lines and hybrids. The polyploids formation outstanding of tomatillo, are an alternative to increase yields and fruit quality. In this work, was showed significant differences (p<0.01) between diploid and tetraploid in RTF, NF, PPF, DPF, DEF, FIR, TSS, pH and VC. Triploid hybrids 11Tx21D and 2Tx13D they showed heterosis and heterobeltiosis in all the variables studied. In yield, the triploid hybrid, 2Tx13D exceeded in 178.24% and 19.66% to parents 2T and 13D, meanwhile the hybrid 11Tx21D exceeded to the diploid and tetraploid in 0.39% and 145.76% respectively.
Keywords: Polyploids, Self-incompatibility, Colchicine, Fruit yields, Fruit quality, Physalis ixocarpa.
REFERENCIAS
1. Hudson D.W. Relationships of Domesticated and Wild Physalis philadelphica. En: D ́Arcy W. G. (Ed.) Solanaceae Bilology and Systematics. Columbia University Press. New York, U.S.A. 1986. pp.416-432.
2. Choi K.J., Murillo G. Su B.N., Pezzuto M.J., Kinghorn A.D., Mehta G.R., Ixocarpalactone A isolated from the Mexi- can tomatillo shows potent antiproliferative and apoptotic activity in colon cancer cells. FEBS Journal. 2006. 273:5714-5723.
3. Cantwell M., Flores J., Trejo A. Developmental changes and postharvest physiology of tomatillo fruits (Physalis ixocarpa Brot.). Sci. Hortic-Amserdam. 1992. 50: 59-70.
4. SIAP-SAGARPA. Servicio de Información y Estadística Agroalimentaria y Pesquera. 2011. www.siap.sagarpa. gob.mx
5. Bock M.A., Sanchez P.J., McKee L.J., Ortiz M. Selected nutritional and quality analyses of tomatillo (Physalis ixocarpa). Plant Foods Hum.Nutr. 1995. 48: 127-133.
6. Peña L.A., Molina G.J.D., Márquez S.F., Sahagún C.J., Ortiz C.J., Cervantes S.T. Respuestas estimadas y observadas de tres métodos de selección en tomate de cáscara (Physalis ixocarpa Brot.). Revista Fitotecnia Mexicana. 2002. 25:171-178.
7. Santiaguillo H.J.F., Cervantes S.T., Peña L.A. Selección para rendimiento y calidad de fruto de cruzas planta x planta entre variedades de tomate de cáscara. Revista Fitotecnia Mexicana. 2004. 27:85-91.
8. Parisod C., Holderegger R., Brochmann C. Evolutionary con- sequences of autopolyploidy. New Phytol. 2010. 186:5-17.
9. Pandey K.K. Genetics of self-incompatibility in Physalis ixocarpa Brot. A new system. American Journal of Botany. 1957. 44:879-887.
10. Robledo T.V., Ramírez G.F., Foroughbakhch P.R., Benavi- des M.A., Hernández G.G., Reyes V.M.H. Development of tomatillo (Physalis ixocarpa Brot.) autotetraploids and their chromosome and phenotypic characterization. Breeding Science. 2011. 61:288-293.
11. Jewell D.C., Islam F.N. A technique for somatic chromosome preparation and c-banding of maize in walbot M. Freeling V. The maize handbook. Spring-Vorlang, NY. USA. 1994. p. 484-493.
12. Stone J.L., Thomson J.D., Dent A.S.J. Assessment of pollen viability in Hang-pollination experiments: A Review. American Journal of Botany. 1995. 82(9): 1186-1197.
13. AOAC. Official methods of analysis, 17thed. Association of Official Analytical Chemists, Gaithersburg, MD. 2000.
14. García V.A. Técnicas y procedimientos de citogenética ve- getal. Colegio de Postgraduados. Montecillo, Estado de México. 1990. 144 p.
15. Menzel Y.M. The cytotaxonomy and genetics of Physalis.
Proc. Amer. Philos. Soc. 1951. 95(2):132-183.
16. Grimaldo J.O., García V.A., Peña L.A. Morfología cromosómica y comportamiento meiótico en tomate de cáscara (Physalis ixocarpa Brot.) Revista Chapingo Serie Horticultura. 1999. 5(1) 31-35.
17. Molero P.T., Matos A. Efectos de la inducción artificial de la poliploidía en plantas de Aloe vera (L.). ReviCy HLUZ. Boletín Centro de Investigaciones Biológicas Venezuela. 2008. 42(1):111-133.
18. Fernández A. Estudios cromosómicos en Turnera y Piriqueta (Turneraceae). Bonplandia. 1987. 6: 1-21.
19. Arbo M.M., Fernández A. Posición taxonómica, citología y palinología de tres niveles de ploidía de Turnera subulata Sm. Bonplandia. 1983. 5(23): 211-226.
20. He Y.C., Wei Q. Ge. J., Jiang A.M., Gan L., Song Z.J., Cai D.T.. Genome duplication effects on pollen development and the interrelated physiological substances in tetraploid rice with polyploid meiosis stability. Planta. 2010. 232(5):1219-1228.
21. Stebbins G.L.Types of polyploids: Their classification and significance. Advances in Genetics. 1947. 1:403–429.
22. Cequea A.C. Cytogenetic analysis of the artificial tetraploid Lycopersicon esculentum var cerasiforme. Ciencia. 2000. 8(2): 119-126.
23. Carr A.C., Frei B. Toward a new recommended dietary allowance for vitamin C based on antioxidant and health effects in humans. American Journal of Clinical Nutrition. 1999. 69(6): 1086-1107.
24. Nugent E.P., Ray TD. Spontaneous tetraploid melons. HortScience 1992. 27(1):47-50.
25. Dumas de V.R. Étude des possibilities d’utilisation de la polyploidie dans l’amélioration du melon (Cucumis melo L.). Annales. Amelior Plantes. 1974. 24:389-403.
26. Aleza P., Juárez J., Ollitrault P., Navarro L. Production of tetraploid plants of non apomictic citrus genotypes. Plant Cell Reports. 2009. 28(12):1837-1846.
27. Maynard D.N., Elmstrom G.W. Triploid watermelon produc- tion practices and varieties. Acta Hort. 1992. 318:169-173.
28. Nugent P.E., Adelberg J. Fruit characteristics of hybrid triploid melon. HortScience. 1995. 30:821-822.
29. Estrada R.N. Híbridos triploides derivados de Solanum stoloniferun y su valor en el mejoramiento de la papa. Re- vista Latinoamericana de la Papa. 1990. 3:80-87.
30. Inzunza C.J.F., García V.A., Carballo C.A., Peña L.A. Viability, pollen and seed size in husk tomato (Physalis ixocarpa Brot.). Agricultura técnica en México. 1999. 25(1):69-77.
31. Jackson R.C., Casey J. Cytogenetics of polyploids. In W. H. Lewis (ed) Polyploidy – Biological Relevance. Plenum Press: New York. 1980. pp. 17-44.
32. DeWet J.M.J. Origin of polyploids. In Polyploidy. Plenum, Lewis HW (eds). Nueva York, EE.UU. 1980. pp. 3-15.
33. Peña L.A., Santiaguillo H.J.F. Variabilidad genética de to- mate de cáscara en México. Boletín Técnico #2. Departa- mento de Fitotecnia. Universidad Autónoma Chapingo. Chapingo, Méx. 1999. 26 p.
34. Estrada T.V., Peña L.A., Contreras M.E. Evaluación de 28 familias de tomate de cáscara (Physalis ixocarpa Brot). Re- vista Chapingo. Serie Horticultura. 1994. 2:135-139.
35. Peña L.A., Contreras M.G., Rodríguez P.J.E., Carballo C.A., Rodríguez P.J.E., Maldonado M.M. Parámetros genéticos de tomate de cáscara (Physalis ixocarpa Brot.) Variedad Verde Puebla. Revista Fitotecnia Mexicana 2004. 27 (1):1 – 7.
36. Rhodes B., Zhang X. Hybrid seed production in watermelon. Journal of new seeds. 2000. 1 (3-4):69-88.
37. Marlow D. Firmeza de frutos. Productores de hortalizas 2010. 11:14-15.
38. Qiu Y., Nishina M.S., Paull R.S. Papaya fruit growth, calcium uptake, and fruit ripening. J. Am. Soc. Hortic. Sci. 1995. 120:246-253.
Recibido: 1 de agosto de 2013 Aceptado: 9 de septembre de 2013
* Universidad Autónoma Agraria Antonio Narro, Departamento de Fitomejoramiento y Horticultura.
Contacto: godramf@gmail.com.
**Universidad Autónoma de Nuevo León, FCB.