Estudio de la formación de las células espumosas en el actinomicetoma experimental
Irene Meester*, Adrián Geovanni Rosas Taraco*, Mario César Salinas Carmona*
CIENCIA UANL / AÑO 16, No. 64, OCTUBRE-DICIEMBRE 2013
El presente artículo está basado en la investigación “Estudio de la formación de las células espumosas en el actinomicetoma experimental inducido por Nocardia brasiliensis”, galardonada con el Premio de Investigación UANL 2013, en la categoría de Ciencias de la Salud, otorgado en sesión solemne del Consejo Universitario, en septiembre de 2013.
Las células espumosas se caracterizan por haber acumulado lípidos y están presentes en el arterioesclerosis, algunas enfermedades de almacenamiento lisosómico y varias enfermedades infecciosas, como malaria, dengue y tuberculosis, las cuales siguen siendo problemas de salud mundial. Aunque se desconoce el papel exacto de las células espumosas en las enfermedades infecciosas, hay indicaciones que son aprovechadas por los diferentes patógenos para sobrevivir. (1, 2) Las células espumosas se han observado también en el actinomicetoma experimental por Nocardia brasiliensis (Nb). (3)
Nb es una bacteria Gram+, aeróbica, con una pared celular con abundantes ácidos micólicos que podrían fungir como factor de virulencia (4) cuando este saprófito se convierte en patógeno facultativo después de una infección traumática y accidental. (5) Otros factores de virulencia son la catalasa y la superóxido dismutasa, enzimas que neutralizan los radicales tóxicos generados por el estallido respiratorio de la respuesta inmune. (6, 7)
México es una región endémica del actinomicetoma por Nb, y el patógeno fácilmente desarrolla resistencia al tratamiento antibiótico, por lo que muchas veces se recurre a la amputación de extremidades, lugar más comúnmente afectado por la enfermedad. El actinomicetoma es una infección subcutánea que afecta igual a tejidos subyacentes como músculo y hueso. Hay edema con cicatrización en lugares donde ha ocurrido drenaje de gránulos de bacterias desde las fístulas internas. Histológicamente, se observan microabscesos multiloculares con principalmente polimorfonucleares (PMN) que rodean el grano bacteriano central. En la periferia se observan linfocitos, mientras que las células espumosas se encuentran entrelazadas en la cápsula fibrosa. (8)
Para estudiar la respuesta inmune contra el patógeno se ha desarrollado un modelo experimental en ratones BALB/c. (7) Típicamente, la inflamación aguda llega a su máximo una semana después de la inoculación. La infección crónica (actinomicetoma) se desarrolla después de cuatro semanas con una inflamación severa y la deformación del tejido. La abundante presencia de PMN refleja una respuesta inmune innata crónica, mientras que la presencia local de la interleucina (IL) 12 e interferón gamma (IFN-γ) (8,9) indican la activación de la respuesta inmune celular o de linfocitos T cooperadores tipo 1 (Th1). Además se activa la respuesta inmune humoral o tipo Th2, en la que, aparte de la producción de anticuerpos IgG, (7,10) niveles sostenidos de IgM relativamente altos parecen ser importantes en la protección de una manera independiente del complemento. (11,12)
A pesar de esto, el patógeno sobrevive y la enfermedad sigue desarrollándose. Estudios sugieren que el patógeno podría refugiarse para evadir la respuesta inmune hospedero, como se ha descrito en los casos de tuberculosis y lepra. En estas enfermedades, los patógenos causantes se establecen en macrófagos espumosos. (1,13) Se han reportado modelos in vitro para estudiar la formación de macrófagos espumosos al retarlos con los patógenos involucrados. (1,13) Sin embargo, estudios inmunohistoquímicos sugieren que igual podrían ser células dendríticas. (3,14)
La falta de exclusividad de marcadores para macrófagos y células dendríticas dificulta la interpretación de tales estudios. Por lo anterior, estudiamos in vivo el linaje de las células espumosas, además del tipo de microambiente en la lesión, enfocándonos en la expresión de las citocinas involucradas en la diferenciación local de monocitos en macrófagos o células dendríticas: el GM-CSF (proinflamatorio), M-CSF, IL-4 e IL-13 ( ́antiinflamatorio ́), y de los marcadores de activación clásica (nos2/iNOS) o alternativa (chi3l3/Ym1 y retnla/FIZZ1)15, 16 de los fagocitos.
METODOLOGÍA
Modelo experimental
Ratones BALB/c fueron mantenidos bajo condiciones controlados con agua y alimento para roedores (Purina) ad libitum, y se manipularon con respeto a las normas éticas y de investigación establecidas por el Comité Institucional y referidas en la NOM 062- 200-1999. El Comité Bioética Institucional aprobó el protocolo de investigación (IN 10-003).
La cepa ATCC 700358 de Nb se cultivó durante tres días, a 37°C, hasta su fase log de crecimiento en infusión cerebro- corazón (BHI, Oxoid). La película bacteriana se lavó con 0.85% de solución salina (SS) a 1600 g, y fue homogeneizada en 10 ml SS con un Potter. Después de 10 min de reposo se recuperó la parte no sedimentada del homogeneizado.
Generación y marcaje de macrófagos y células dendríticas derivados de la médula ósea (MDMO y DCDMO, resp.)
La médula ósea de los fémures y tibias de un ratón (de seis semanas en adelante) se recuperó en medio de RPMI 1640/25mM HEPES/24 mM bicarbonato, adicionado con penicilina 50-100 U/ml y estreptomicina 50-100 μg/mL (todos los reactivos de Sigma; RPMI incompleto), homogeneizado por pipeteo y lavado (400 g, 8-10 min.). La aplicación de un hemólisis con 0.8% NH4Cl/0.08% NaHCO3/ 0.04% EDTA en H2O, durante 10 min a 21-25°C con agitación gentil, seguido de dos lavados en RPMI incompleto, fue estándar para la generación de DCDMO y opcional para MDMO.
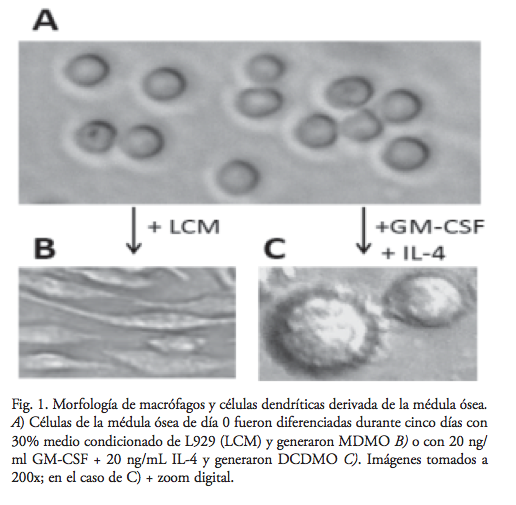
Una muestra de la suspensión celular, diluida 1:10 con 2% ácido acético/10 mM amortiguador de fosfatos, pH 7.3 (PBS), fue contada con un hemocitómetro. Las células fueron sembradas a 1×105 células/cm2 en cajas Petri (Corning 430293) en medio de diferenciación apropiado, lo cual consistía de RPMI completo (= RPMI incompleto suplementado con 10% suero bovino fetal inactivado por calor, 30 min. 56°C), suplementado con 30% medio condicionado de L929 para generar MDMO y para DCDMO con 20 ng/ml GM-CSF recombinante más 20 ng/mL IL-4 recombinante (Peprotech, No. 315-03 y 214-04, respectivamente). La mitad del medio fue reemplazada cada segundo o tercer día hasta su diferenciación a día 6.
Las células diferenciadas fueron cargadas con 2 μM succinimidil éster de carboxifluoresceína (CFSE), según las instrucciones del proveedor (Molecular Probes). Uno a tres días después del marcaje, las células fueron cosechadas en frío con escrapers, homogeneizadas por pipeteo y lavadas en RPMI completo. Para eliminar los macrófagos “contaminantes” del cultivo de las DCDMO, los macrófagos se marcaron con anti-F4/80 conjugado con biotina (eBioscience) diluida 1:100 en RPMI completo, durante 15 min a 21-25°C más 30 min a 4°C, y se lavaron con PBS o RPMI, después se aplicó la depleción con perlas magnéticas conjugadas con streptavidina y una columna MS (Miltenyi Biotec), según las instrucciones del proveedor.
Inmunofenotipificación por citometría de flujo
Los receptores Fc se bloquearon con suero hiperinmune de ratón 1:50 (10 min, 21-25°C). Des- pués se incubaron durante 30 min a 4°C, con los anticuerpos específicos diluidos en RPMI completo. Se usaron CD11b-APC (1:300) con CD11c-PE (1:80), F4/80-PE (un marcador de macrófagos; 1:160) con CD205-APC (un marcador de células dendríticas; 1:1250), todos de eBioscience, además de controles de isotipo conjugado con PE (1:100; Caltag) y un control sin anticuerpo. Después de 2-3 lavados en 2 ml de PBS frío (400 g, 10 min), las células fueron resuspendidas y fijadas en 550 μl 0.37% formaldehido/PBS, y almacenadas a 4°C en la oscuridad hasta su lectura. Se analizaron > 10,000 células/muestra en un FACS-Calibur (BD Bioscience) o un FACS-Canto II (BD Bioscience).
Prueba de fagocitosis
MDMO adherentes se incubaron con microesferas de Látex carboxilado de 2 μm (Polysciences), en una razón de 10-30 microesferas/célula, en RPMI completo durante 1-4 h a 37°C . La fagocitosis fue detenida por la adición de 2-3 volúmenes de PBS frío y se realizaron lavados para eliminar microesferas libres. Las células se fijaron con 10% de formalina durante 10 min, y fueron guardadas en PBS. Se contaron 100 células por duplicado para determinar el índice de fagocitosis.
Transferencia adoptiva de células marcadas
Se inyectaron 100 ̃μl de una suspensión celular/PBS (equivalente a 5×104-5×105 células CFSE+ totales) en una lesión > 15 días.
Infección de ratones y obtención de biopsias
El cojinete plantar izquierdo de ratones hembras (8- 11 semanas) se inyectó con 1×106 unidades formadoras de colonias en fase log de crecimiento de la cepa ATCC 700358 de Nb. (7) Se monitoreó el desarrollo de la lesión con la fórmula del elipsoide (V = 4/3π* 1⁄2 longitud * 1⁄2 grosor * 1⁄2 anchura). Para experimentos de expresión génica, en los tiempos
indicados, los ratones se sacrificaron (n = 5) por dis- locación cervical, y una biopsia de la lesión se colocó en 1 mL Trizol (Invitrogen) para la determinación de la expresión génica. Las muestras fueron homogeneizadas con un TissueTearer a 0-4°C y después incubadas durante 15-20 min. a 21-25°C, antes de almacenarlas a -80°C. Para los estudios de linaje, a los días 1, 3 o 7 después de la transferencia adoptiva (n = 3-5), se tomaron biopsias (sin huesos), las cuales se fijaron inmediatamente.
Preparación histológica
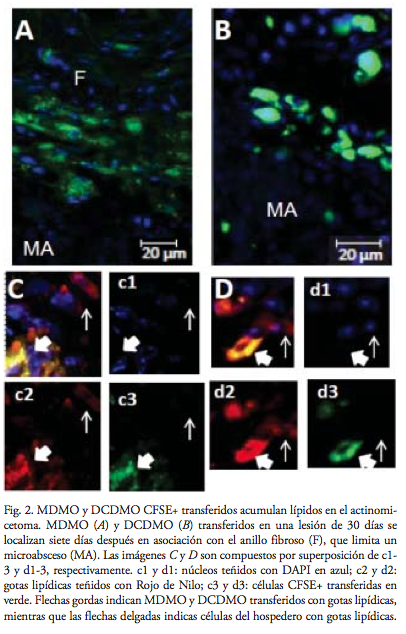
Después de fijar las biopsias en 10% de formalina durante 8h, se realizaron tres lavados (2-8h/lavado) en 10 mM PBS (pH 7.3), y se guardaron > 18h en 30% sucrosa (Sigma)/PBS a 4°C, procurando la oscuridad en todo el proceso. Posteriormente, las biopsias fueron semisecadas, antes de incluirlas en OCT (TissueTek), y congeladas a -20oC. Se realizaron cortes de criostato de 10 μm a tres diferentes profundidades de la biopsia, los cuales se recolectaron en un portaobjetos cubierto con Polysine (ThermoScientific) por triplicado, e inmediatamente se mantuvieron en la oscuridad, antes de su almacenamiento, a -20°C hasta su uso. Para la tinción de las gotas lipídicas, los cortes fueron incubados con el fluorocromo Rojo de Nilo/PBS (300 ng/mL), preparado desde un stock de 1mg/ml en metanol, durante 15 min a 21-25°C, posteriormente se lavaron 2-3 veces con PBS. Las laminillas fueron montadas en Vectashield con DAPI (Vector Laboratories), selladas con un esmalte transparente y analizadas con un microscopio confocal LSM700 o LSM710, controlado por software Zen2011 (Zeiss). Las configuraciones para la visualización fueron: DAPI λex/em = 360/458-531 nm para núcleos, CFSE λex/em = 488/ 490-569 nm para células transferidas, y Rojo de Nilo λex/em = 591/594-692 nm para gotas lipídicas.
Obtención de RNA y qRT-PCR
Se extrajo el RNA de los homogeneizados en Trizol, según las instrucciones del proveedor (Invitrogen). Un tratamiento con DNasa (Promega), según las instrucciones del proveedor, fue incluido para eliminar DNA y seguido de una reextracción del RNA, lo cual se recuperó en H2O tratado con dietilpirocarbonato. Se aplicó espectrofotometría (SmartSpec, BioRad) para determinar la concentración y la pureza. El criterio de la pureza fue un 260/280 > 1.7. Dos μg RNA fue retrotranscrito durante 1h a 37oC, con 10 mM dNTP (Epicentre), 10 ng/μl solución de sondas al azar (Invitrogen) y 1 μl transcriptasa inversa (M- MLV-RT; Invitrogen) en el buffer recomendado por el proveedor, en un volumen final de 20 μl.
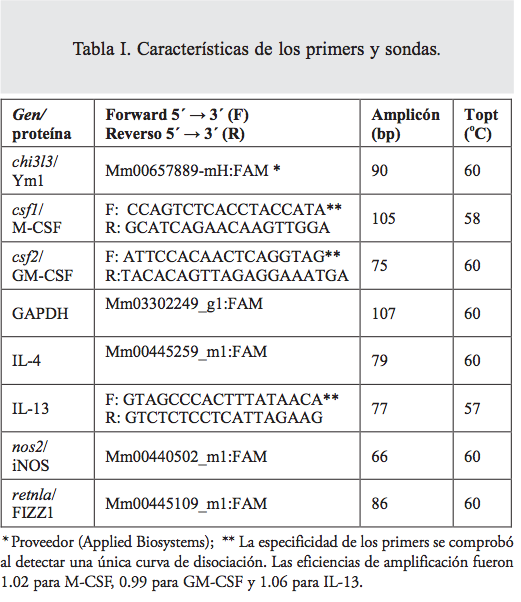
La concentración y pureza del cDNA se determinaron por espectrofotometría, como se describió antes. Por duplicado, se amplificó 500 ng de cDNA en un volumen final de 20 μl con detección por: 1) el método de SYBRGreen, usando el IQTM SYBRGreen Supermix (BioRad), 5 pmol de cada primer (tabla I) y el siguiente esquema de amplificación: 50°C por 10 min, 90°C por 3 min, y 40 ciclos de 90°C por 30s y la temperatura óptima (Topt) °C por 30 s (tabla I), o 2) el método Taqman, usando las soluciones de primers y sondas Taqman (Applied Biosystems, tabla I) a 40x y el IQTM Supermix (BioRad) con un programa de termociclador, según las indicaciones del proveedor (Applied Biosystems). La expresión génica se formuló como expresión relativa, calculada con el método de Livak, y con la fórmula de 2– ̃∆∆Ct, con el gliceraldehído-3-fosfato deshidrogenasa (GAPDH) como referencia y relativo a la expresión de la primera detección durante el desarrollo.
Análisis estadístico
Los experimentos se realizaron por lo menos dos veces. Se aplicó la prueba T de Student para comparar dos grupos con distribución normal. La prueba de ANOVA con prueba posterior de Tukey se utilizó para la comparación múltiple de > 2 grupos con distribución paramétrico. En todas las pruebas estadísticas, se consideró un P < 0.05 como valor significativo.
RESULTADOS
El fenotipo y la funcionalidad de los fagocitos no son alterados por el marcaje
La diferenciación de células de la médula ósea con el medio condicionado generó macrófagos con su morfología típica (figura 1), y con > 98% de las células cosechadas positivas para el marcador de macrófagos murinos F4/80. Sin embargo, la diferenciación de células de la médula ósea con GM-CSF + IL-4 generó una mezcla de células dendríticas semiadherentes, macrófagos adherentes y PMN en suspensión. Estos últimos fueron fácilmente eliminados al descartar el medio de cultivo seguido de lavados de las células adherentes. Sin embargo, eliminar macrófagos fue más importante, considerando el objetivo del estudio. No confiamos en la técnica de la selección positiva de células CD11c+ o CD205+, ya que estos marcadores ocurren también en subgrupos de macrófagos,17,18 decidimos por una depleción de macrófagos F4/80+, con lo cual aceptamos la posible pérdida de algunas células dendríticas F4/80+,19, 20 pero asegurando mayor pureza de las células dendríticas. Logramos disminuir el porcentaje células F4/80+ de > 33% a < 4.5% en las DCDMO.
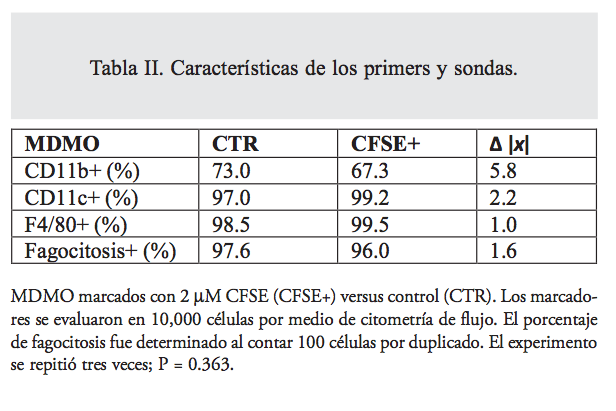
El marcaje de MDMO y DCDMO, con 2 μM CFSE, causó un cambio transitorio en su morfología. Los MDMO obtuvieron una apariencia más redonda y la adherencia al sustrato disminuyó temporalmente. Sin embargo, al día siguiente habían recuperado su morfología típica. La inmunotipificación de las células marcadas fue similar a la de las células no marcadas (tabla II). El marcaje tampoco afectó la funcionalidad de los macrófagos. El índice de fagocitosis de macrófagos CFSE+ fue 0.96 (+ 0.03) y el de las células control 0.975 (+ 0.02); no hubo una diferencia significativa entre los grupos (tabla II).
Macrófagos y células dendríticas marcadas acumularon gotas lipídicas
Los macrófagos y células dendríticas que se habían transferido en una infección de 30 días se localizaron siete días después en la periferia de los microabscesos, yuxtapuestos a los fibroblastos (figura 2 a y b, respectivamente), el lugar típico de las células espumosas. Además, al teñirlos con Rojo de Nilo, se comprobó que habían acumulados gotas lipídicas (figura 2 c y d). Obviamente, también macrófagos y células dendríticas del hospedero podrían acumular gotas lipídicas, por lo cual algunas células mostradas se tiñeron de rojo, sin tener la señal del CFSE en verde.
La expresión relativa in situ de IL-13 y GM-CSF aumenta durante la infección con Nb
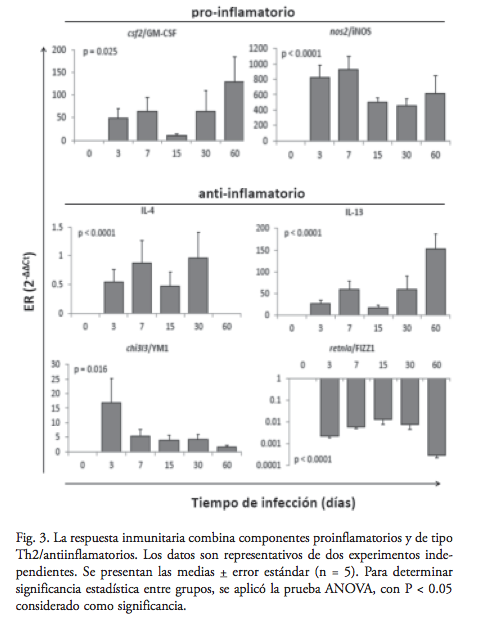
La expresión de csf1/M-CSF aumentó durante la inflamación, con un expresión relativa (ER) máximo de 5.7x (SEM 1.6) al día 7, pero no hubo diferencia significativa (P = 0.184) en comparación con el día 0 o con otros tiempos. El csf2/GM-CSF no fue detectable en homeostasis; pero, una vez detectado en un ratón a 0.5 días y en todos los ratones a un día, continuó aumentando su expresión mientras transcurría la infección, sólo interrumpida con una disminución temporal a día 15. En el día 60 se expresó más csf2/GM-CSF, con una ER de 129x, SEM 55 (figura 3). Con respecto a las citocinas Th2, la IL-4 no se detectó en la homeostasis, y solamente a niveles muy bajos durante la inflamación aguda.
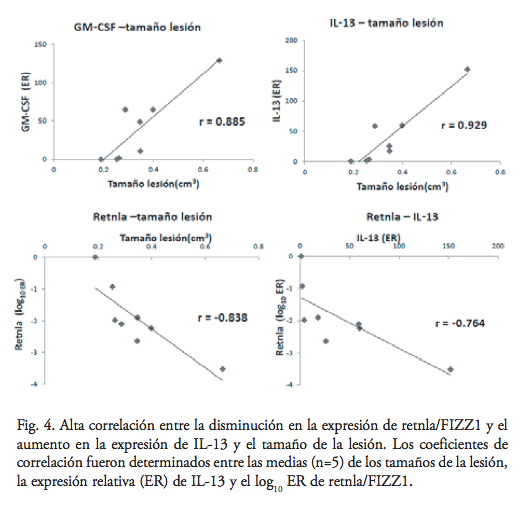
Con excepción del grupo de 0.5 día, al menos un ratón no expresaría un nivel detectable de IL-4 en los diferentes grupos de inflamación. No hubo diferencia significativa entre los grupos que expresaron IL-4. Por otro lado, la expresión de IL-13 aumentó durante la inflamación aguda (ER 60x, SEM 18), pero sin significancia estadística, y después de una disminución temporal durante la semirresolución de la fase aguda, la expresión se incrementó de nuevo y significativamente durante la inflamación crónica (ER 152x, SEM 35, p = 0.003) (figura 3). El coeficiente de correlación entre el tamaño de la lesión y las ER de GM-CSF y de IL-13 fueron, respectivamente, 0.885 y 0.929. Por tanto, también hubo una buena correlación entre sí de 0.97 (figura 4).
Los marcadores de macrófagos M2 demuestran un perfil de expresión opuesto
La expresión del marcador de la activación clásica de macrófagos, nos2/iNOS aumentó de manera significativa (P < 0.0001), inmediatamente después de infectar los ratones, alcanzó su máxima ER durante la inflamación aguda (día 7: ER 922, SEM 177, P = 0.0008), después disminuyó, pero sostuvo un aumento significativo en comparación con el control (día 60, ER 623, SEM 222; P< 0.02) (figura 3).
Los marcadores de la activación alternativa de los macrófagos demostraron expresiones relativas opuestas. El chi3L3/Ym1 no fue detectable en la homeostasis, fue inducido a las 12h de la infección y alcanzó su máxima expresión el día 3 (ER 17, SEM8, p = 0.05). En la infección crónica, la expresión disminuyó, con niveles de expresión no significativamente diferentes a la expresión de 12h (figura 3). Cabe mencionar que la expresión más alta de chi3L3/Ym1 se encontró en el bazo de un ratón infectado (dato no mostrado). Al contrario, la expresión de retnla/FIZZ1 fue más alta en la homeostasis, y ésta disminuyó significativamente en respuesta a la infección, sobre todo durante la inflamación crónica, que en el día 60 tuvo una ER de 3.2×10-4 (P = 8×10-4) (figura 3). El coeficiente de correlación entre el tamaño de la lesión y el log10 de la ER de FIZZ1 fue -0.84 (figura 4).
DISCUSIÓN
La presencia de marcadores propios de células dendríticas en células espumosas ha causado polémica. Algunos autores consideran que las células espumosas son macrófagos que empiezan a expresar algunos marcadores de células dendríticas, (14) mientras otros las consideran células dendríticas, por expresar marcadores de células dendríticas. (21) El problema de fondo es que no existen marcadores exclusivos para cualquiera de estas dos células. (22) Éste fue el primer estudio que aplicó la técnica de transferencia adoptiva de células identificadas antes como macrófago o célula dendrítica, para estudiar su destino en el actinomicetoma experimental.
Al considerar nuestro objetivo, era muy importante garantizar las poblaciones más puras posibles. Criterios de morfología e inmunofenotipificación probaron la generación de macrófagos puros; sin embargo, para DCDMO era necesario una separación inmunomagnética para aumentar la pureza de DCDMO a 95.5%. El marcaje con 2 μM CFSE no alteró las células de manera significativa. Los MDMO y DCDMO CFSE+ singénicos y transferidos fueron localizables en el lugar típico de las células espumosas, es decir, asociados con el anillo fibroso de un microabsceso. Esta localización sugirió que podrían haber acumulado gotas lipídicas, lo cual fue confirmado con la tinción de Rojo de Nilo localizable en células CFSE+, tanto para macrófagos como para células dendríticas.
La capacidad de acumular lípidos, compartida por macrófagos y células dendríticas, se suma a otras características que tienen en común, disminuyendo aún más la supuesta diferencia entre ellas. Ambos comparten muchos marcadores de superficie celular, de hecho, es difícil encontrar un marcador de superficie exclusiva. (22) Aunque se han descrito linajes separados en homeostasis, durante la inflamación, ambos pueden diferenciarse a partir de monocitos, (17) presentar antígenos (22) y activarse de manera clásica, como macrófagos M1 o TipDC, respectivamente. (23) Ésta es la primera vez que se comprueba de manera convincente que, in vivo, macrófagos y células dendríticas se convierten en células espumosas.
Los precursores de las células espumosas en el actinomicetoma, ya sean macrófagos o células dendríticas, podrían estar en su estado proinflamatorio (macrófagos M1 o TipDC, respectivamente) o antiinflamatorio (M2 o cDC, respectivamente). (24) Parece lógico suponer que un estado antiinflamatorio podría favorecer la supervivencia de Nb dentro de la célula, pero en la bibliografía existe controversia sobre el tipo de activación de las células espumosas en diferentes modelos de infección. Los antecedentes en nuestro modelo indican que las células espumosas eran TNF- α negativas, (8) tal como lo reportó antes Ares, (25) un fenotipo consistente con los macrófagos M2 antiinflamatorios.
Stenzel reportó que las células espumosas en el criptococcosis cerebral efectivamente eran macrófagos M2 Ym1+. (26) Por otro lado, Higgins reportó que un ambiente proinflamatorio, rico en GM-CSF, favorecía la aparición de células espumosas, mientras que un tratamiento con M-CSF, más relacionado con macrófagos M2, causó la disminución de células espumosas en un modelo de tuberculosis. (27) En nuestro estudio, el aumento en la expresión de GM-CSF e iNOS se suma a la reportada presencia de IFN-γ, (8, 9) y sugiere una activación proinflamatoria. Cabe mencionar que no se descarta que sean los PMN los responsables del aumento en la expresión de iNOS. (28)
También hubo indicaciones de una posible activación alternativa por el aumento en la expresión de Ym1 e IL-13. La expresión de IL-4 fue apenas detectable en la lesión, aunque el nivel de IL-4 aumenta en el suero. (7) Estos perfiles de expresión de IL- 4 e IL-13 concuerdan con reconocidas diferencias de distribución de estas citocinas Th2, en que la IL-4 juega un papel sistémico desde su expresión en órganos linfáticos, mientras la IL-13 ejerce su función localmente. (29) Otro estudio inmunohistoquímico evidenció la expresión de Ym1+ macrófagos espumosos en un ambiente rico en IL-13 en el criptococcosis cerebral.26 En nuestro estudio no descartamos que Ym1 sea expresado por otras células como PMN. (30)
El papel de Ym1 aún no ha sido elucidado, pero podría estar involucrado en la acumulación local de PMN o monocitos, ya sea por reclutamiento (31) o por estimular la proliferación local. (32,33) La IL-13 podría estar involucrada en varios fenómenos observados en el actinomicetoma: 1) la falta de producción de óxido nítrico a pesar de la expresión de iNOS; (4, 34) 2) la formación de las cápsulas fibrosas (35) que limitan los microabscesos; 3) la activación alternativa de los macrófagos; (36) 4) en cooperación con GM-CSF, la polarización de monocitos reclutados hacia células dendríticas, (37) lo que sería consistente con la presencia de marcadores de células dendríticas en “macrófagos espumosos” reportado en tuberculosis. (27) Sorprendió que la expresión de retnla/FIZZ1disminuyera drásticamente durante el desarrollo del actinomicetoma. Por lo general, se considera que los macrófagos M2 expresan Ym1 y FIZZ1 en conjunto. (15) La disminución en la expresión de FIZZ1 no es necesariamente inconsistente con la activación antiinflamatoria, ya que se ha reportado recientemente en un modelo de infección con alfavirus artritogénicos en macrófagos M2. (38)
Hay indicaciones que FIZZ1 sea un regulador de la retroalimentación negativa de la inflamación crónica. En una infección crónica por helmintos, ratones retnla-/- desarrollaron granulomas exacerbados en comparación con ratones silvestres. (39) Además, FIZZ1 suprime la expresión de IL-13 por esplenocitos. (40) Estos reportes concuerdan con nuestros resultados, en los que una disminución de FIZZ1 permite un aumento de IL-13 con sus efectos enumerados antes. Al integrar nuestros resultados con los reportados de otros autores se propone la siguiente explicación: el Ym1 favorece la acumulación de leucocitos. El ambiente rico en GM-CSF e IL-13 favorece la diferenciación de monocitos a células dendríticas. El aumento en la expresión de iNOS indica una activación proinflamatoria y microbicida, pero su efectividad podría deshabilitarse por la presencia de IL-13. El FIZZ1 está suprimido, por lo que la IL-13 se expresa desenfrenadamente, y favorece la inflamación crónica y la fibrosis.
CONCLUSIÓN
Macrófagos y células dendríticas se convierten en células espumosas en el actinomicetoma experimental inducido por Nb en un microambiente con elevada expresión de GM-CSF e IL-13, citocinas de tipo proinflamatorio y antiinflamatorio/Th2, respectivamente. De manera consistente, aumentó la expresión de los marcadores iNOS e YM1, de la activación clásica y alternativa de los macrófagos, respectivamente. Sin embargo, disminuyó otro marcador de la activación alternativa (FIZZ1).
RESUMEN
El actinomicetoma por Nocardia brasiliensis (Nb) se desarrolla a pesar de una respuesta inmune adecuada. Con la idea de que Nb podría evadir la defensa del hospedero dentro de unas células inofensivas, nos enfocamos en las células espumosas presentes en la lesión, y estudiamos su linaje y los factores de diferenciación relevantes. Por medio de transferencia adoptiva de células marcadas, demostramos in vivo que macrófagos y DC pueden convertirse en células espumosas en el actinomicetoma experimental en ratones BALB/c. El microambiente contiene simultáneamente aspectos proinflamatorios (aumento de GM-CSF e iNOS) y antinflamatorios/Th2 (aumento de IL-13 e YM1), pero con un inesperado disminución de FIZZ1.
Palabras clave: Actinomicetoma, Nocardia brasiliensis, Células espumosas, IL-13, FIZZ1.
ABSTRACT
The actinomycetoma by Nocardia brasiliensis (Nb) developes despite an adecuate immune response. Considering that Nb might evade the host ́s immune response within inoffensive cells, we decided to study foamy cells that are present in the lesion, focusing on their lineage and the presence of relevant differentiation factors in the micro-environment. By means of adaptive transfer of labeled cells, we demonstrated that macrophages and DC become foamy cells in the experimental actinomycetoma in BALB/c mice. The microenvironment contains proinflammatory (GM-CSF and iNOS expression increased) and anti-inflammatory/Th2 aspects (IL- 13 and YM1 expression are increased), accompanied by an unexpected decrease in FIZZ1 expression.
Keywords: Actinomycetoma, Nocardia brasiliensis, Foamy cells, IL-13, FIZZ1
AGRADECIMIENTOS
Los autores agradecen al Sr. R. Rodríguez y a la QFB A. Gallegos por la asistencia técnica, al MC V. Romero y el DC J.C. Segoviano, por su apoyo en partes histológicas, y al Servicio de Hematología y a la empresa Uniparts. IM expresa su gratitud al Conacyt por la beca de manutención. Este proyecto fue apoyado por el Conacyt (SEP- Ciencias Básicas 2008 – 99149).
* Universidad Autónoma de Nuevo León, FM. Contacto: meesterirene@hotmail.com
REFERENCIAS
1. Peyron P., Vaubourgeix J., Poquet Y., et al. Foamy macrophages from tuberculous patients’ granulomas constitute a nutrient-rich reservoir for M. tuberculosis persistence. PLoS Pathog 2008;4:e1000204.
2. Meester I., Rosas-Taraco A.G., Solís-Soto J.M., Salinas- Carmona M.C. The roles of lipid droplets in human infectious disease. Medicina Universitaria 2011;13:207- 16.
3. Segoviano-Ramírez J.C. Characterización inmunológico de las células espumosas del actinomicetoma experimental en ratones BALB/c [Dr. en C. with orientation in immunology]. Monterrey: Universidad Autónoma de Nuevo León, 2008.
4. Treviño-Villarreal, J.H.; Vera-Cabrera L., Valero-Guillén, P.L.; Salinas-Carmona, M.C. Nocardia brasiliensis Cell Wall Lipids Modulate Macrophage and Dendritic Responses favoring Development of Experimental Actinomycetoma in BALB/c Mice. Infect Immun 2012; 80:3587-601.
5. Salinas-Carmona, M.C. Nocardia brasiliensis: from microbe to human and experimental infections. Microbes Infect 2000;2:1373-81.
6. Revol A., Espinoza-Ruiz M.; Medina-Villanueva I.; Sali- nas-Carmona, M.C. Expression of Nocardia brasiliensis superoxide dismutase during the early infection of murine peritoneal macrophages. Can J Microbiol 2006;52:1255- 60.
7. Salinas-Carmona, M.C.; Torres-López, E.; Ramos, A.I.; Licon-Trillo A.; González-Spencer D. Immune response to Nocardia brasiliensis antigens in an experimental model of actinomycetoma in BALB/c mice. Infect Immun 1999;67:2428-32.
8. Solís-Soto, J.M.; Quintanilla-Rodríguez, L.E.; Meester, I.; Segoviano-Ramírez J.C., Vázquez-Juárez J.L., Salinas Carmona M.C. In situ detection and distribution of inflammatory cytokines during the course of infection with Nocardia brasiliensis. Histol Histopathol 2008;23:573-81.
9. Rosas-Taraco A.G., Pérez-Liñan A.R., Bocanegra-Ibarias P., Pérez-Rivera L.I., Salinas-Carmona M.C. Nocardia bra- siliensis induces an immunosuppressive microenvironment in BALB/c mice favoring chronic infection. Infect Immun 2012;80:493-9.
10. Salinas-Carmona M.C., Vera L., Welsh O., Rodríguez M. Antibody response to Nocardia brasiliensis antigens in man. Zentralbl Bakteriol 1992;276:390-7.
11. Salinas-Carmona M.C., Pérez-Rivera I. Humoral immunity through immunoglobulin M protects mice from an expe- rimental actinomycetoma infection by Nocardia brasiliensis. Infect Immun 2004;72:5597-604.
12. González-Suárez M.L., Salinas-Carmona M.C., Pérez-Ri- vera I. IgM but not IgG monoclonal anti-Nocardia brasiliensis antibodies confer protection against experimen- tal actinomycetoma in BALB/c mice. FEMS Immunol Med Microbiol 2009;57:17-24.
13. Mattos, K.A.; Lara, F.A.; Oliveira; V.G. et al. Modulation of lipid droplets by Mycobacterium leprae in Schwann Cells: a putative mechanism for host lipid acquisition and bacterial survival in phagosomes. Cell Microbiol 2011;13:259-73.
14. Ordway D., Henao-Tamayo M., Orme I.M., González- Juarrero M. Foamy macrophages within lung granulomas of mice infected with Mycobacterium tuberculosis express molecules characteristic of dendritic cells and antiapoptotic markers of the TNF receptor-associated factor family. J Immunol 2005;175:3873-81.
15. Raes G., De Baetselier P., Noel W., Beschin A., Brombacher F., Hassanzadeh Gh. G. Differential expression of FIZZ1 and Ym1 in alternatively versus classically activated macrophages. J Leukoc Biol 2002;71:597-602.
16. Mantovani A., Sica A., Locati M. Macrophage polarization comes of age. Immunity 2005;23:344-6.
17. Ammon C., Meyer S.P., Schwarzfischer L., Krause S.W., Andreesen R., Kreutz M. Comparative analysis of integrin expression on monocyte-derived macrophages and monocyte-derived dendritic cells. Immunology 2000;100:364-9.
18. Inaba K., Swiggard W.J., Inaba M., et al. Tissue distribution of the DEC-205 protein that is detected by the monoclonal antibody NLDC-145. I. Expression on dendritic cells and other subsets of mouse leukocytes. Cell Immunol 1995;163:148-56.
19. Kruger T., Benke D., Eitner F., et al. Identification and functional characterization of dendritic cells in the healthy murine kidney and in experimental glomerulonephritis. J Am Soc Nephrol 2004;15:613-21.
20. Austyn J.M., Gordon S. F4/80, a monoclonal antibody directed specifically against the mouse macrophage. Eur J Immunol 1981;11:805-15.
21. Paulson K.E., Zhu S.N., Chen M., Nurmohamed S., Jongstra-Bilen J., Cybulsky M.I. Resident intimal dendritic cells accumulate lipid and contribute to the initiation of atherosclerosis. Circ Res 2010;106:383-90.
22. Hume D.A. Macrophages as APC and the dendritic cell myth. J Immunol 2008;181:5829-35.
23. Geissmann F., Manz M.G., Jung S, Sieweke M.H., Merad M., Ley K. Development of monocytes, macrophages, and dendritic cells. Science 2010;327:656-61.
24. Mosser D.M., Edwards J.P. Exploring the full spectrum of macrophage activation. Nat Rev Immunol 2008;8:958- 69.
25. Ares M.P., Stollenwerk M., Olsson A., Kallin B., Jovinge S., Nilsson J. Decreased inducibility of TNF expression in lipid-loaded macrophages. BMC Immunol 2002;3:13.
26. Stenzel W., Muller U., Kohler G., et al. IL-4/IL-13- dependent alternative activation of macrophages but not microglial cells is associated with uncontrolled cerebral cryptococcosis. Am J Pathol 2009;174:486-96.
27. Higgins D.M., Sánchez-Campillo J., Rosas-Taraco A.G., et al. Relative levels of M-CSF and GM-CSF influence the specific generation of macrophage populations during infection with Mycobacterium tuberculosis. J Immunol 2008;180:4892-900.
28. Tsukahara Y., Morisaki T., Horita Y., Torisu M., Tanaka M. Expression of inducible nitric oxide synthase in circulating neutrophils of the systemic inflammatory response syndrome and septic patients. World J Surg 1998;22:771-7.
29. Wills-Karp M., Finkelman F.D. Untangling the complex web of IL-4- and IL-13-mediated signaling pathways. Sci Signal 2008;1:pe55.
30. Nio J., Fujimoto W., Konno A., Kon Y., Owhashi M., Iwanaga T. Cellular expression of murine Ym1 and Ym2, chitinase family proteins, as revealed by in situ hybridization and immunohistochemistry. Histochem Cell Biol 2004;121:473-82.
31. Falcone F.H., Loke P., Zang X., MacDonald A.S., Maizels R.M., Allen J.E. A Brugia malayi homolog of macrophage migration inhibitory factor reveals an important link bet- ween macrophages and eosinophil recruitment during nematode infection. J Immunol 2001;167:5348-54.
32. Hung S.I., Chang A.C., Kato I., Chang N.C. Transient expression of Ym1, a heparin-binding lectin, during developmental hematopoiesis and inflammation. J Leukoc Biol 2002;72:72-82.
33. Jenkins S.J., Ruckerl D., Cook P.C., et al. Local macro- phage proliferation, rather than recruitment from the blood, is a signature of TH2 inflammation. Science 2011;332:1284-8.
34. El-Gayar S., Thuring-Nahler H., Pfeilschifter J., Rollinghoff M., Bogdan C. Translational control of inducible nitric oxide synthase by IL-13 and arginine availability in inflammatory macrophages. J Immunol 2003;171:4561-8.
35. Kaviratne M., Hesse M., Leusink M., et al. IL-13 activates a mechanism of tissue fibrosis that is completely TGF- beta independent. J Immunol 2004;173:4020-9.
36. Nair M.G., Cochrane D.W., Allen J.E. Macrophages in chronic type 2 inflammation have a novel phenotype characterized by the abundant expression of Ym1 and Fizz1 that can be partly replicated in vitro. Immunol Lett 2003;85:173-80.
37. Hiasa M., Abe M., Nakano A., et al. GM-CSF and IL-4 induce dendritic cell differentiation and disrupt osteoclastogenesis through M-CSF receptor shedding by up-regulation of TNF-alpha converting enzyme (TACE). Blood 2009;114:4517-26.
38. Stoermer K.A., Burrack A., Oko L., et al. Genetic ablation of arginase 1 in macrophages and neutrophils enhances clearance of an arthritogenic alphavirus. J Immunol 2012;189:4047-59.
39. Pesce J.T., Ramalingam T.R., Wilson M.S., et al. Retnla (relmalpha/fizz1) suppresses helminth-induced Th2-type immunity. PLoS Pathog 2009;5:e1000393.
Gad W., Nair M.G., Van Belle K., et al. The Quiescin Sulfhydryl Oxidase (hQSOX1b) Tunes the Expression of Resistin-Like Molecule Alpha (RELM-alpha or mFIZZ1) in a Wheat Germ Cell-Free Extract. PLoS One 2013;8:e55621.
Recibido: 1 de agosto de 2013. Aceptado: 9 de septiembre de 2013.