Capacidad antioxidante, contenido en licopeno y fenoles totales en tomate de huerto familiar
Laura Gisela Ramos Muñoz*, Cristina Saraí Contreras Martínez*, José Carranza Téllez*, José Carranza Concha*
Resumen
Dos tipos de tomate fueron cultivados en un huerto familiar de la ciudad de Jerez, Zacatecas, México. Tomate de semilla comercial (TSC)-tomate comercial (TC) adquirido en un supermercado y tomate de semilla extraido de un tomate (TSE). La actividad antioxidante, el contenido en ácido ascórbico, la acidez total, el contenido en licopeno y el contenido fenólico total fueron analizados. El ANOVA mostró diferencias estadísticamente significativas (P ≤ 0.05) entre los tres tipos de tomates, excepto en la actividad antioxidante. El uso del huerto familiar para autoconsumo conlleva la obtención de alimentos con una alta calidad nutricional.
Palabras clave: fitoquímcos, Solanum lycopersicum L, huerto.
Abstract
Two types of homegarden tomatoes were grown in Jerez, Zacatecas City, México. Commercial seed tomato (CST) -commercial tomato (CT) which was bought in a supermarket-, and tomato that was grown using seeds previously extracted from another tomato (EST). The antioxidant activity, the ascorbic acid content, the total acidity, the lycopene content and total phenolic compounds were all analyzed. The ANOVA showed statistically significant differences (P ≤ 0.05) between the three tomato types, except on the antioxidant activity. The use of homegarden for growing food for ones own consumption, leads to obtaining food with high nutritional quality
Keywords: phytochemicals, Solanum lycopersicum L, homegarden.
La continua utilización de insumos como el agua, los fertilizantes y los plaguicidas están contaminando, da- ñando o disminuyendo los recursos naturales, provocando un impacto ambiental negativo (Domenico et al., 2015). Debido a eso, la agricultura se está reinterpretando, cada vez es más frecuente observar, en ciudades de países desarrollados, huertos colectivos o comunitarios, parcelas o grupos de parcelas cultivadas por un grupo de personas para autoconsumo (Sheromm, 2015). Lotes abandonados o vacíos pueden ser una alternativa para aquellas personas que deseen cultivar y cosechar su propia comida, permitiéndoles paralelamente involucrarse con el sistema alimentario local así como con otras comunidades. Desde hace unos años, en Estados Unidos los huertos familiares se han vuelto un fenomeno popular y cada vez más importante en muchas comunidades (Corrigan, 2011). Los consumidores están cada vez más preocupados por cómo, dónde y cuándo se producen los alimentos. Esto ha llevado a un creciente interés de los consumidores por las hortalizas cultivadas orgánica o ecológicamente, incluidas las producidas en invernaderos (Thybo et al., 2006). Lo anterior ha provocado el desarrollo de muchos estudios, cuyo objetivo es hacer una comparación entre los productos orgánicos y los convencionales, tanto en sus aspectos sensoriales como nutrimentales, ambientales y de inocuidad, siendo el contenido nutrimental el aspecto al que mayor importancia le dan los consumidores (Shafie y Rennie, 2012). El huerto familiar es la parcela donde se cultivan vegetales, por lo general se establece en pequeños espacios de tierra, dentro o fuera de la casa o en algún lote cercano a ella. Tiene como ventajas la obtención de alimentos a menor costo, en cantidades de acuerdo al tamaño de la familia, minimizando la sobreproducción y el desperdicio, así como la obtención de alimentos de alta calidad higiénica y libre de herbicidas, plaguicidas o cualquier otro contaminante.
El tomate (Solanum lycopersicum L.), tanto fresco como procesado, es uno de los vegetales más consumidos en México, así como en todo el mundo. Es parte fundamental de la alimentación y componente básico de la dieta mediterránea. Se encuentra comúnmente disponible en diversos productos procesados como purés, pastas, tomates pelados enteros, productos cortados en cubitos, jugos, salsas y sopas. Es un alimento rico en compuestos bioactivos, como carotenos (licopeno y β-caroteno), ácido ascórbico, tocoferoles y compuestos fenólicos (Charanjit et al., 2013); por ser una gran fuente de antioxidantes, su consumo está fuertemente asociado a la reducción y prevención del desarrollo de enfermedades crónico degenerativas (Pinela et al., 2012).
Las prácticas agronómicas han sido identificadas como un factor crítico y determinante de la calidad nutricional de los cultivos (Barret et al., 2007). Los niveles de compuestos bioactivos en tomates frescos pueden verse afectados por muchos factores (el cultivo, la etapa de maduración del fruto al momento de la cosecha y las técnicas agrícolas) durante la pre y poscosecha (Dumas et al., 2003). No obstante, en la bibliografía científica no existe un consenso en cuanto a la composición fitoquímica y la actividad antioxidante de los productos orgánicos y convencionales, que además varía en función del tipo de método de análisis, el compuesto bioactivo cuantificado y del alimento que se trate (Carbonaro et al., 2002; Lombardi et al., 2004). Por lo tanto, el propósito de este estudio fue analizar y comparar la capacidad antioxidante, el contenido de licopeno y fenoles totales de tomates producidos en huerto familiar con cuidado ecológico frente al tomate convencional.
Material y métodos
Materia prima
Los tomates comerciales (TC) fueron adquiridos en un supermercado de la ciudad de Zacatecas, éstos se seleccionaron con características similares de tamaño (11- 13 cm aproximadamente), apariencia fresca, sin signos de mohos, coloración típica, sin golpes y sin signos de putrefacción.
Para la obtención del tomate con semillas extraídas (TSE), éstas se obtuvieron a partir de un tomate comercial con las características antes mencionadas. Se le extrajeron las semillas, enseguida fueron lavadas con agua desionizada hasta eliminar el mucilago que las cubre. Posteriormente se secaron bajo condiciones de sol y sombra en intervalos de tres horas. Por otra parte, se sembró tomate utilizando semilla comercial (TSC).
Siembra
Los tomates fueron cultivados en un huerto familiar, en Jerez, Zacatecas, México, ubicado a 22° 38’50.60”N, 102° 58’27.06”W y 1999 msnm. Se sembraron las semillas extraídas del tomate (TSE), así como las semillas comerciales (TSC) (2-3 mm de profundidad para evitar la podredumbre de las semillas) en semilleros hechos con bolsas de plástico que fueron irrigadas con 10 ml de agua con jeringa. El trasplante se realizó cuando la plántula alcanzó una altura aproximada de 15 cm. La distancia entre cada plántula fue de aproximadamente 80 cm. Se utilizó composta elaborada a partir de residuos orgánicos (hojas secas, cáscara de verduras y frutas, excepto cítricos). Posteriormente se combinó con tierra de río, tierra de mezquite y tierra de la región a partes iguales. La mezcla se esterilizó con agua hirviendo, se dejó enfriar y después se sembraron las semillas. La cosecha se realizó cuando los tomates alcanzaron un color rojo característico homogéneo (después de seis meses).
Reactivos
Patrón de ácido gálico, reactivo Folin-Ciocalteau 2N, ABTS+• (2,2-Azinobis (3-ethylbenzothiazoline-6-sulfonic acid diammonium salt), patrón de Trolox (6-hydroxy-2,5,7,8-tetramethylchromane-2 carboxylic acid), persulfato potásico, hidroxitolueno butilado (BHT) y carbonato de sodio (Sigma Chemical Co. St. Louis, MO, USA); etanol, n-hexano y metanol grado analítico (JT Baker, USA).
Análisis
El contenido en humedad se llevó a cabo mediante el método 950.46 de la AOAC (1997). La determinación de los sólidos solubles (ºBrix) se realizó mediante la medida del índice de refracción de las muestras. Para ello se utilizó un refractómetro (General tools and instruments, RHB-32/ATC). Para poder realizar la lectura de los ºBrix, las muestras se homogeneizaron previamente con un Ultra-turrax modelo T-25 y posteriormente fueron centrifugadas a 10,000 rpm durante 10 min a 4ºC. Las medidas fueron sobre la fracción liquida de las muestras. Para la determinación del pH se utilizó un potenciómetro (Denver instrument Ultrabasic). La determinación del contenido en ácido ascórbico (AA) se llevó a cabo mediante el método descrito por la AOAC (967.21, 1997) para frutas y vegetales. Los resultados fueron expresados como mg de AA/100 g de muestra.
La determinación de la acidez titulable (AT) se efectuó de acuerdo con el método 942.15 de la AOAC (1997). Los resultados fueron expresados como mg de ácido cítrico en 100 g de muestra. También se calculó la relación sólidos solubles totales/acidez titulable (índice de madurez).
La extracción para la cuantificación de los fenoles totales (FT) se llevó a cabo mediante la técnica descrita por Peiró et al. (2006) y siendo cuantificados mediante el método de Folin Ciocalteau (Li, Smith y Hossain, 2006). Los resultados fueron expresados como mg de ácido gálico (GAE) en 100 g de muestra.
Para el análisis de la actividad antioxidante de los jitomates se trabajó con el mismo extracto utilizado para la determinación de los fenoles totales. La actividad antioxidante (AC) se cuantificó mediante una modificación de la técnica espectrofotométrica desarrollada del ABTS+•, empleado por Re et al. (1999), utilizando el radical ABTS+• generado con persulfato potásico (K2 S2 O8 ) 2.45 mM, la disolución se dejó reposar durante 16 h en oscuridad. Posteriormente el ABTS+• fue disuelto hasta obtener una absorbancia de 0.7 ± 0.1 a 734 nm. Para la lectura de las muestras, se tomaron 100 µL de extracto y se mezclaron con 900 µL de ABTS+• diluido, midiéndose la absorbancia a la misma longitud de onda. Los resultados fueron expresados como µmoles de Trolox (TEAC) en 100g de muestra.
La extracción de licopeno fue llevada a cabo mediante el método de Fish et al. (2002). Brevemente, 100 g de tomate fueron triturados finamente durante tres minutos en un ultraturrax, posteriormente se colocaron 600 mg de puré de tomate en un vaso de precipitados cubierto con aluminio. Enseguida se añadieron 5 ml de BHT a 0.05% en acetona (w/v), más 5 ml de etanol y 10 ml de hexano dejándose en agitación continua durante diez minutos a 180 rpm en un baño de hielo. Para obtener una mejor separación de los compuestos polares y los no polares, se agregaron 3 ml de agua desionizada después de transcurridos los diez minutos y dejando cinco minutos más en agitación. Posteriormente, se dejaron reposar las muestras durante cinco minutos a temperatura ambiente para permitir la separación de las fases polar y no polar.
La medida de la absorbancia se realizó a 503 nm, utilizando únicamente la parte no polar, para lo cual se colocó la cantidad necesaria en una cubeta de cuarzo de 1 cm en el espectrofotómetro (Thermo Scientific, Genesys 10S UV-Vis spectrophotometer, USA). Como blanco se utilizó hexano. El contenido en licopeno se calculó empelando la siguiente formula (Fish et al., 2002):
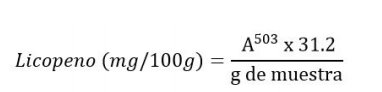
donde A503 es la absorbancia de las muestras a 503 nm y 31.2 es el coeficiente de extinción molar.
Todos los resultados de cada una de las determinaciones corresponden al valor medio y desviación estándar de tres repeticiones. Con los datos se realizó el análisis de la varianza (ANOVA one way) con un nivel de significancia de 5%. Se aplicó la prueba de Tukey HSD (diferencia significativa honesta) para confirmar la existencia de diferencias significativas entre los tratamientos después del ANOVA (p < 0.05). Además se aplicó la correlación de Pearson para determinar la relación entre algunas de las variables. Todos los análisis estadísticos se llevaron a cabo utilizando el software Statgraphics Centurion (16.1.15 versión, USA).
Resultados y discusión
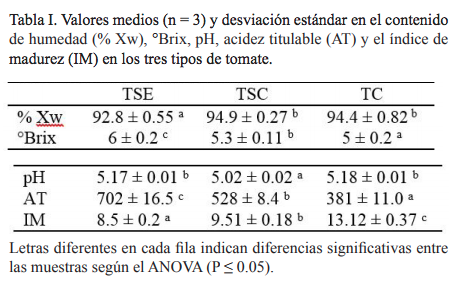
De acuerdo con los resultados obtenidos, se observaron diferencias estadísticamente significativas (P ≤ 0,05) en los °Brix, el pH, la acidez titulable, el índice de madurez y la humedad de los tomates. El tomate TSE presentó valores significativamente más bajos en la humedad y el índice de madurez (P ≤ 0.05) en comparación con los otros dos tipos, y más altos en los °Brix y la acidez titulable (tabla I). Los valores en sólidos solubles son similares a aquellos reportados por Charanjit et al. (2013). Los sólidos solubles son un aspecto muy importante en la definición del procesamiento de los tomates, representan azúcares y ácidos orgánicos, cuya relación, junto con la composición en aromas volátiles, caracterizan el sabor del fruto (Bergougnoux, 2014).
En cuanto al contenido en ácido ascórbico, el tomate TSE presentó niveles (21.2 mg·100 g-1 ± 0.85) significativamente más altos que los otros (P ≤ 0.05), 11.5 ± 0.8 mg·100 g-1 de ácido ascórbico para el tomate comercial y 11.95 ± 0.01 mg para el tomate TSC (figura 1). Di Matteo et al. (2010) demostraron que la acumulación de AA se consigue aumentando la degradación de la pectina y pudiendo ser activada por el etileno.
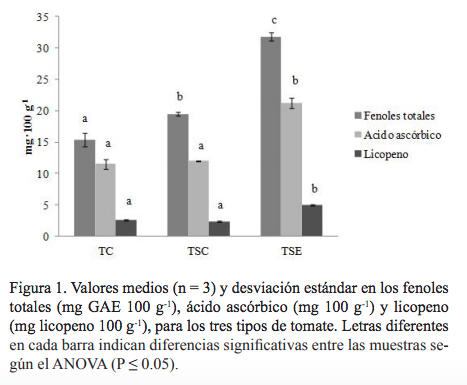
El tomate TSE fue significativamente más alto (p < 0.05) en el contenido de licopeno (3.84 mg 100 g-1 ± 0.17) en comparación con los otros tipos de tomate (figura 1), 2.5 mg de licopeno 100 g-1 para el tomate comprado en el supermercado (TC) y 2.3 mg de licopeno 100 g-1 para el tomate producido con semilla comercial (TSC). Juroszek et al. (2009) mencionan que los tomates modifican la producción de licopeno por las características genéticas de la semilla utilizada, así como por la ubicación, estacionalidad de la cosecha y las características del suelo. Las diferencias encontradas entre la cantidad de licopeno entre el TSE y TC podrían ser uno de estos factores; en el presente estudio asumimos las diferencias sobre todo en el proceso de cultivo y en el tipo de semilla que se utilizó. El impacto de estos factores puede explicar la variabilidad encontrada en los compuestos estudiados.
En cuanto a los fenoles totales (figura 1), se encontraron diferencias significativas (P ≤ 0.05) entre los tres tipos de tomate. Estas diferencias pueden estar relacionadas con la utilización de pesticidas y fertilizantes. Winter y Davis (2006) comentan que las frutas y vegetales tienen más energía bioquímica para sintetizar metabolitos de plantas secundarias beneficiosas como antioxidantes polifenólicos, así como toxinas naturales. El tomate TSE mostró el contenido más alto en fenoles totales (31.8 mg de ácido gálico 100 g-1). La cantidad y calidad de polifenoles en los alimentos vegetales puede variar significativamente de acuerdo con diferentes factores intrínsecos y extrínsecos, como factores genéticos, la variedad, la composición del suelo, condiciones de cultivo, estado de madurez y condiciones poscosecha, entre otros (Winter, 2006).
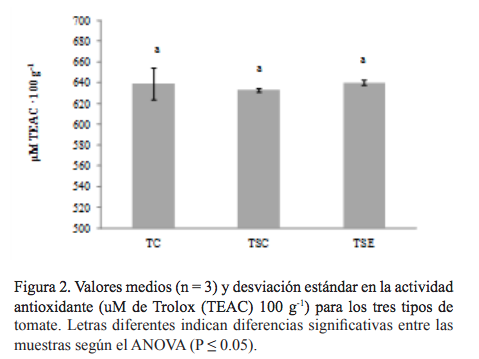
En cuanto a la actividad antioxidante, se obtuvieron valores de 640.2 µM de TEAC 100 g-1 en tomate TSE, 639.4 y 633.3 µM de TEAC 100 g-1 para TC y TSC respectivamente (figura 2). De acuerdo con el ANOVA, no se encontraron diferencias estadísticamente significativas (P ≤ 0.05) entre los tres tipos de tomate.
La AC en tomate comercial está fuertemente influenciada por factores abióticos y por la forma de cultivo (Anissa y Chafik, 2013), por el genotipo (Riadh et al., 2011), técnicas agronómicas (Dumas et al., 2003), exposición a la luz y temperatura (Pék et al., 2011). También hay que tener en cuenta los efectos sinérgicos y las interacciones redox entre las diferentes moléculas de nutrientes y “no nutrientes” que en conjunto contribuyen a los supuestos beneficios para la salud (Anissa y Chafik, 2013).
El análisis de la correlación de Pearson mostró una relación positiva de los fenoles totales con la acidez titulable (P = 0.0147, r = 0,94650), con el contenido en ácido ascórbico (P = 0.0054, r = 0.9728), así como en el contenido en licopeno (P = 0.0237, r = 0.9265).
Conclusiones
Los tomates cultivados en el huerto familiar, sobre todo TSE, tuvieron una mejor composición química que los adquiridos en un supermercado. Los valores obtenidos en fenoles totales, ácido ascórbico y licopeno nos permiten recomendar el cultivo de tomate bajo técnicas de agricultura amigable con el ambiente como el TSE; en cambio, para la actividad antioxidante no se aprecian diferencias entre las muestras de tomate. La comparación de los resultados obtenidos frente a los publicados por otros autores se torna complicada puesto que algunas investigaciones toman en cuenta variables diferentes, como el grado de madurez, las condiciones de cultivo, la variedad, el tamaño del fruto o incluso los métodos de análisis empleados.
* Universidad Autónoma de Zacatecas.
Contacto: joseconcha10@hotmail.com
Referencias
Anissa, R. y Chafik, H. (2013). Bioactive compounds and antioxidant activity of organically grown tomato (Solanum lycopersicum L.) cultivars as affected by fertilization. Sci. Hortic-Amsterdam. 151: 90–96.
AOAC. (1997). Official Methods of Analysis, 16th ed. Association of Official Analytical Chemists, Washington, DC.
Barret, D.M., et al. (2007). Qualitative and nutritional differences in processing tomatoes grown under commercial and organic production systems. J. Food Sci. 72: C441-C451.
Bergougnoux V. (2014). The history of tomato: From domestication to biopharming. Biotechnol. Adv. 32: 170–189.
Carbonaro M., et al. (2002). Modulation of antioxidant compounds in organic vs. conventional fruit (peach, Prunus persica L., and pear, Pyrus communis L.). J. Agric. Food Chem. 50: 5458–5462.
Charanjit K., et al. (2013). Functional quality and antioxidant composition of selected tomato (Solanum lycopersicon L) cultivars grown in Northern India. LWTFood Sci. Technol. 50: 139-145.
Corrigan, M.P. (2011). Growing what you eat: Developing community gardens in Baltimore, Maryland. Appl. Geogr. 31: 1232-1241.
Di Matteo A., et al. (2010). The ascorbic acid content of tomato fruits is associated with the expression of genes involved in pectin degradation. BMC Plant Biol. 163: 1471-2229.
Domenico R., et al. (2015). Physiological responses of processing tomato in organic and conventional Mediterranean cropping systems. Sci. Hortic-Amsterdam 190: 161–172. http://dx.doi.org/10.1016/j.scienta.2015.04.027
Dumas Y., M., et al. (2003). Review: Effects of environmental factors and agricultural techniques on antioxidant content of tomatoes. J. Sci. Food Agric. 83: 369–382.
Fish, W.W., Perkins V., P., Collins, J.K. (2002). A quantitative assay for lycopene that utilizes reduced volumes of organic solvents. J. Food Compos. Anal. 15: 309–317.
Jaffery, E.H., A.F. Brown, A.C. Kurilich, A.S. Keek, N. Matusheski and Klein, B.P. (2003). Variation in content of bioactive components in broccoli. J. Food Compos. Anal. 16: 323–330.
Juroszek, P., et al. (2009). Fruit quality and bioactive compounds with antioxidant activity of tomatoes grown on-farm: comparison of organic and conventional management systems. J. Agric. Food Chem. 57: 188-94.
Li, B.B., Smith, B. y Hossain, M.M. (2006). Extraction of phenolics from citrus peels I. Solvent extraction method. Sep. Purif. Technol. 48: 182-188.
Lombardi B., G., et al. (2004). Nutrients and antioxidant molecules in yellow plums (Prunus domestica L.) from conventional and organic productions: a comparative study. J. Agric. Food Chem. 52: 90–94.
Peiró, R., et al. (2006). Micronutrient flow to the osmotic solution during the grapefruit osmotic dehydration. J. Food Eng. 74: 299–307.
Pék, Z., et al. (2011). The effect of natural light on changes in antioxidant content and color parameters on vine-ripened tomato (Solanum lycopersicum L.) fruits. HortScience 46: 583–585.
Pinela, J., et al. (2012). Nutritional composition and antioxidant activity of four tomato (Lycopersicon esculentum L.) farmer’ varieties in Northeastern Portugal homegardens. Food Chem. Toxicol. 50: 829-834.
Riadh I., et al. (2011). Antioxidant activity and bioactive compound changes during fruit ripening of high-lycopene tomato cultivars. J. Food Compos. Anal. 24: 588–595.
Re, R., et al. (1999). Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Bio. Med. 26: 1231-1237.
Shafie, F.A. y Rennie, D. (2012). Consumer Perceptions towards Organic Food. Procedia Soc. Behav. Sci. 49: 360–367.
Sheromm, P. (2015). Motivations and practices of gardeners in urban collective gardens: The case of Montpellier. Urban For. Urban Green. 14: 735–742.
Thybo, A.K., et al. (2006). Effect of organic growing systems on sensory quality and chemical composition of tomatoes. LWT- Food Sci. Technol. 39: 835–843.
Winter, C.K. y Davis, S.F. (2006). Organic foods. J. Food Sci. 71: 117–124.
RECIBIDO: 23/12/2016
ACEPTADO: 27/07/2017
