Óxido nítrico sintasa (iNOS), mediador antiviral frente al VHC
CLARA PATRICIA RÍOS IBARRA*, SONIA LOZANO SEPÚLVEDA*, LINDA MUÑOZ ESPINOSA*, ANA ROSA RINCÓN SÁNCHEZ*, ANA MARÍA RIVAS ESTILLA*
CIENCIA UANL / AÑO 18, No. 76, NOVIEMBRE-DICIEMBRE 2015
El virus de la hepatitis C (VHC) infecta aproximadamente a 3% de la población mundial y es un agente etiológico importante de la hepatitis crónica, cirrosis hepática y cáncer de hígado. (1) El VHC, un virus de la familia Flaviviridae, posee un genoma de ARN, de cadena positiva de aproximadamente 9.6 kb. (2,3) Los pacientes con hepatitis C crónica se tratan actualmente con IFN-a pegilado (PEG-IFN) en combinación con ribavirina; sin embargo, todavía no existe cura para una gran proporción de los pacientes con hepatitis C crónica; (4,5) por consiguiente, el desarrollo de nuevas terapias para la infección por VHC es crucial para mejorar el tratamiento. (6)
Los mecanismos por los que el VHC provoca daño celular son poco conocidos, y los diferentes mecanismos descritos sugieren un importante papel del estrés oxidativo y nitrosativo, con la infección crónica del virus. (7,8)
Aunque la importancia de estas especies reactivas de nitrógeno y oxígeno se ha documentado como una defensa natural contra las bacterias y los hongos, su papel en la patogénesis de las infecciones virales se entiende sólo parcialmente. (9,10) Se ha informado que el óxido nítrico (NO) tiene consecuencias perjudiciales en la presencia de especies reactivas de oxígeno, ya que se forman peroxinitritos.
Se ha reportado la activación de iNOS a través de las proteínas de VHC implicadas en la replicación; (11) sin embargo, el mecanismo sigue siendo poco definido. Cada vez hay mayor evidencia de la participación de óxido nítrico (NO) como uno de los mediadores más versátiles en el control de diversos virus. (12-14)
Hemos informado anteriormente que el ácido acetilsalicílico (AAS, aspirina), un fármaco antiinflamatorio no esteroideo, disminuye los niveles de proteína virales de VHC. (15) Además, se encontró que la actividad antiviral de AAS se media, al menos en parte, por sus propiedades antioxidantes y capacidad para regular la COX-2 y la expresión de SOD. (16) Sin embargo, los mecanismos aún no se han dilucidado. En este trabajo se investigó si la expresión de iNOS tiene un papel en la regulación inhibitoria de la expresión del VHC mediada por AAS. Nuestros hallazgos sugieren que el AAS reduce la expresión de iNOS, a través de la regulación negativa de su promotor génico y comprobación mediante un estudio de silenciamiento génico.
MATERIAL Y MÉTODOS
Cultivo celular y tratamiento con AAS
Se utilizó un sistema de cultivo celular Huh7 replicón subgenómico genotipo 1b del VHC (que alberga el replicón subgenómico de VHC I389/ NS3-3′).15 Previo al tratamiento, las células se sembraron 12 horas antes, y luego se expusieron a 4 mM de AAS durante 24, 48 y 72 horas. Los ensayos de viabilidad demostraron que no hay efectos citotóxicos del AAS en las concentraciones utilizadas.15 Posteriormente, se llevó a cabo la extracción del RNA y proteína total para realizar los ensayos de PCR en tiempo real (RT-qPCR) y western blot. AAS se adquirió de Sigma (St. Louis MO) con pureza química ~99%.
Western blot
Las proteínas aisladas de los cultivos celulares se cuantificaron como se describe en Rivas-Estilla et al.,20 50 ug de proteínas se separaron en 10% SDS-PAGE y fueron transferidas a membranas de PVDF (Amersham Biosciences, Freiburg, Alemania), las cuales se incubaron con uno de los siguientes anticuerpos: anticuerpo monoclonal de ratón anti-iNOS (1: 200) (Thermo Scientific, Rockford, EE.UU.); anticuerpo policlonal anti-nitrotirosina (1: 200) (Santa Cruz, California, EE.UU.); o antiactina MAb (dilución 1: 5000; MP Biomedicals, Aurora, Ohio, EE.UU.). La detección se realizó mediante un sistema de quimioluminiscencia (Amersham Biosciences, Freiburg, Alemania).
Extracción de RNA
El RNA total se aisló con Trizol (Life Technologies Corporation, Carlsbad, CA), de acuerdo con las especificaciones del fabricante. El RNA se precipitó con isopropaniol y lavado una vez con etanol a 70% ,y resuspendido en 30 uL de agua libre de RNAsas.
RT-qPCR para la cuantificación de iNOS-mRNA
El RNA aislado se sometió a transcripción inversa (RT); 1000 ng de cDNA se utilizaron para llevar a cabo la PCR, a partir de los siguientes parámetros: la configuración inicial a 50°C durante dos minutos y luego 95°C durante diez minutos, seguido por 45 ciclos de 95°C, durante 15 segundos, y 60°C durante 60 s. La fluorescencia se controló en la etapa de recocido, y se generaron las gráficas de amplificación. Un juego de oligonucleótidos, iNOS FW (5′-GTT CTC AAG GCA CAG GTC TC-3 ‘) y iNOS RV (5’-GCA GGT CAC TTA TGT CAC TTA TC-3′), se utilizó para amplificar un fragmento de 290- pb del gen de iNOS. La expresión del RNA de GAPDH se utilizó para normalizar la concentración del RNA en cada muestra analizada (Applied Biosystems, Foster City CA, número de pieza 4326317E) de acuerdo con las especificaciones del fabricante.
RT-qPCR para la cuantificación del VHC-mRNA
El cDNA fue sometido a PCR en tiempo real para cuantificar el VHC y GAPDH-mRNA. (15) Las amplificaciones se llevaron a cabo por triplicado con los siguientes oligonucleótidos: VHC FW (+75-93 nt) 5′-GCGTCTAGCCATGGCGTTA-3′; VHC RV (+138-157 nt) 5′-GGTTCCGCAGACCACTATGG-3 ‘ y la sonda TaqMan (+94-110 nt) 5’-FAM- CTGCACGACACTCATAC-NFQ-3′; las condiciones de amplificación fueron las siguientes: 50°C durante dos minutos, 95°C a diez minutos, seguido por 40 ciclos de 95°C por 15s y 60°C durante 60 segundos. Se utilizó GAPDH-RNA para normalizar la concentración de RNA de VHC; su cuantificación se realizó con el ensayo GAPDH (20X) (Applied Biosystems, Foster City, CA), de acuerdo con las especificaciones del fabricante.
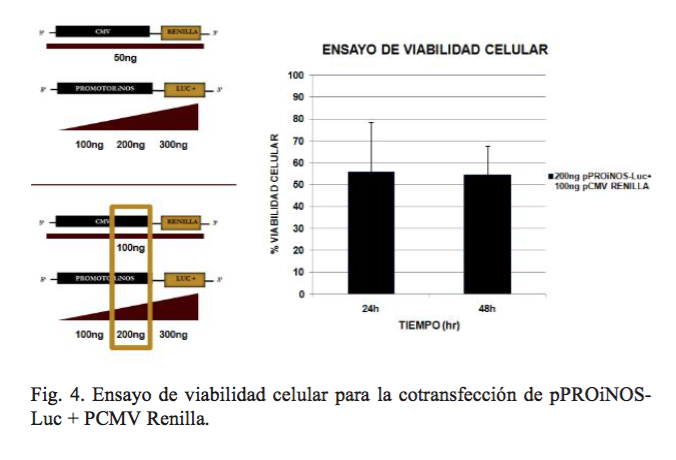
Ensayos de transfección transitoria con el vector pPROiNOs-Luc+
La región del nativa del promotor del gen iNOS se amplificó por PCR a partir de DNA genómico aislado de células Huh-7 con los oligonucleótidos iNOS FW 5′-TAA GGT ACC AAT GCC ACA CCA AGC AGA CGC-3′ y iNOS RV 5′- AAT CCC GGG GAA CAC ACT GGC AGC CAA GAA-3′. Posteriormente, el promotor de iNOS se clonó en el vector pGL3- luciferasa (Promega, Madison, WI), con las enzimas KpnI y SmaI. El vector con el promotor-iNOS bajo el control de la RNA polimerasa de T7 y que tiene río abajo del gen de la luciferasa (pPROiNOs-Luc+), se utilizó para ensayos de transfección transitoria. Las transfecciones se llevaron a cabo en placas de seis pozos (Corning), utilizando Lipofectamina (Life-Techologies). (18) Las células se incubaron en medio libre de suero a 37°C durante seis horas, seguido por la adición de medio suplementado e incubación durante 24 y 48 h, para la posterior cuantificación de luciferasa como reportero de la actividad del promotor de iNOS en presencia de AAS y siRNA-iNOS, como monoterapia o terapia combinada.
Cuantificación de Luciferasa (Luc+)
Células transfectadas transitorios se lisaron en tampón de lisis reportero, de acuerdo con las recomendaciones del fabricante (Promega), y se analizaron los lisados celulares de luciérnaga y renilla expresión de luciferasa con un luminómetro mediante el Dual-Glo sistema de ensayo de luciferasa (Promega).
Cuantificación nitritos
Los niveles de nitrito se determinaron por ensayo colorimétrico, basado en la reacción de Griess (Promega), mediante el uso de normas de nitrito de sodio.
Silenciamiento génico con siRNA-iNOS en Huh-7 VHC
Secuencias de RNAs de interferencia (siRNA), con longitud de 21-22 pb que inhiben específicamente iNOS y GAPDH, se utilizaron de acuerdo a las especificaciones del fabricante (Ambion, Austin, TX). Las células contaban con 30 y 50% de confluencia en el momento de la transfección. Los siRNAs se transfectaron a una concentración final de 150 nM, tanto para siRNA-iNOS como para siRNA-GAPDH (control positivo), con siPORT Lipid transfección Agent (Ambion); como control negativo se seleccionó un siRNA non sense (Ambion). Las células se incubaron durante 24, 48 y 72 horas; posteriormente, se aisló el RNA total para llevar a cabo la cuantificación de VHC mediante RT-qPCR.
Análisis estadístico
Los experimentos se realizaron por triplicado y las variables se evaluaron mediante ANOVA, de una vía y la prueba de Dunnet. Las diferencias se consideraron significativas con un valor de p ≤ 0.05.
RESULTADOS
AAS incrementa los niveles de NO en células Huh-7- VHC-replicón
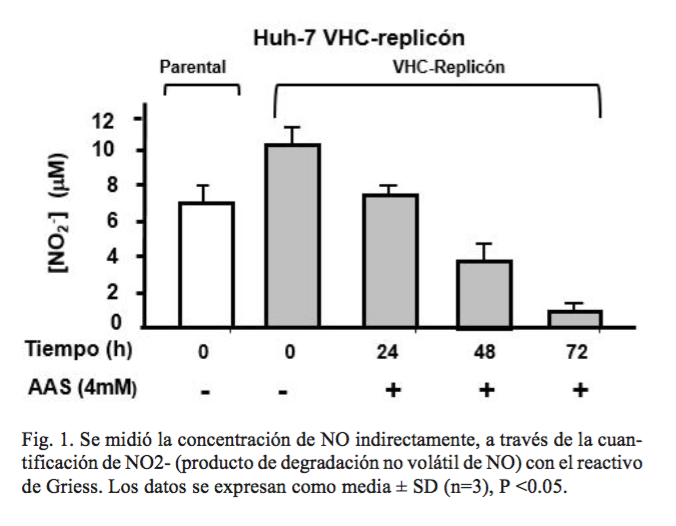
Para confirmar la funcionalidad de iNOS, en nuestro modelo de estudio se cuantificaron los niveles de nitritos (NO2-), para determinar la producción de óxido nítrico (NO) indirectamente en el sobrenadante del medio de cultivo de células Huh7 VHC-replicón postratamiento con AAS. La cantidad de nitritos y nitratos producidos a partir de células de VHC- replicón fue significativamente mayor que en células parentales (sin VHC-replicón) (figura 1). Como era de esperar, AAS disminuye los niveles de NO, conforme transcurre el tiempo (concentración de nitritos); la inhibición máxima se cuantificó a las 72 h (90%) después del tratamiento (*p <0,05). Como control positivo las células de VHC-replicón, se trataron con el inhibidor de NO, L-N6- (1-iminoetil)-lisina (L-NIL) (250uM), y se observó una disminución del nivel de nitritos, similares a los hallazgos con la exposición AAS (datos no mostrados). Los resultados antes mencionados sugieren la posibilidad de que el tratamiento AAS podría modificar la capacidad de las células Huh7 VHC-replicón para expresar la enzima iNOS y posteriormente los niveles de NO, cuyo efecto depende del tiempo.
AAS reduce la expresión de iNOS a nivel transcripcional
Se extrajo el RNA total de células Huh-7-VHC-replicón, expuestas a 4 mM de AAS, 1000 uM de arginina (donador de NO) o 100 uM de L-NIL (inhibidor de iNOS). Se llevó a cabo una retrotranscripción para generar cDNA, y posteriormente se realizó una PCR en tiempo real (sybr green) para el RNA derivado de células expuestas a AAS y PCR semicuantitativa con un juego de primers específicos para iNOS para el RNA aislado de los cultivos expuestos a arginina y L-NIL. Se normalizó cada valor correspondiente a iNOS con los valores de los productos de PCR de actina (gen constitutivo).
La expresión del RNA de iNOS en células Huh-7-VHC- replicón disminuyó significativamente a las 24, 48 y 72 h (p< 0.05) postratamiento (AAS), a diferencia de las células sin el principio activo. A las 24h, la arginina duplicó los niveles de RNA de VHC, con respecto al control negativo (p < 0.05), mientras que L-NIL disminuyó la síntesis del RNA del replicón en 70% (p<0.05). Por lo tanto, AAS ejerce un efecto semejante al de arginina al inducir la sobreexpresión de la enzima iNOS.
AAS estimula la nitración de proteínas con residuos de tirosina
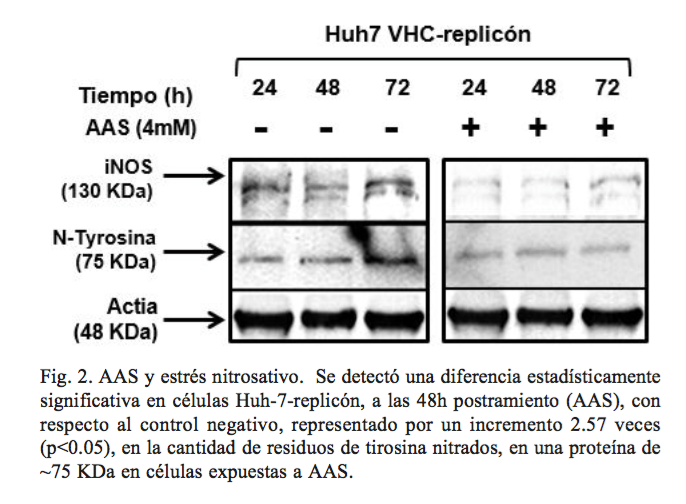
Para evaluar si AAS es capaz de crear estrés nitrosativo en células hepáticas, se preparó un ensayo de Western blot, con un anticuerpo monoclonal que reconoce residuos de nitrotirosina, los cuales sirven como marcadores de estrés generado por especies reactivas de nitrógeno. Se observó un aumento del 2.57 veces (p < 0.05), en la cantidad de residuos de tirosina nitrados, en una proteína de ~ 75 KDa, en células Huh-7-VHC-replicón, a las 48h postratamiento (AAS), versus al control negativo (figura 2). Estos resultados sugieren que AAS puede promover un incremento en la cantidad de especies reactivas de nitrógeno; sin embargo, a las 72 h el efecto se ve revertido, esto podría atribuirse a la activación de vía de proteosoma mediado por ubiquitina, ya que las proteínas oxidas y nitradas son altamente tóxicas y deben eliminarse.
Efecto del silenciamiento de iNOS sobre la expresión de VHC
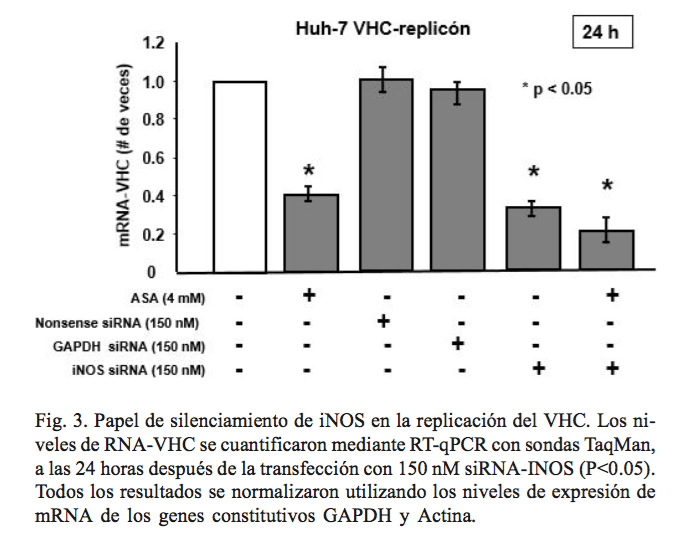
Para evaluar de fondo la participación de la enzima óxido nítrico sintasa inducible (iNOS), con la inhibición de la expresión de VHC, se seleccionó un siRNA dirigido contra iNOS-mRNA para ser transfectado en células Huh7 VHC-replicón en presencia y ausencia de AAS. Se aisló el RNA total, a las 24-36 horas postransfección para cuantificar los niveles de iNOS-mRNA y RNA-VHC, mediante RT-qPCR. Se validó que siRNA-iNOS disminuyera la expresión de iNOS-mRNA alrededor de 70% en nuestro modelo in vitro.
Satisfactoriamente, los niveles de RNA-VHC se redujeron en las células infectadas con el VHC (Huh7 VHC-replicón), mostrando una reducción importante en 24 h postransfección siRNA-iNOS (65%). Adicionalmente, se observó que las células silenciadas y tratadas simultáneamente con 4 mM de AAS, presentaron una mayor disminución de los niveles de RNA-VHC, en comparación con las células no tratadas con la terapia combinada (figura 3). El control positivo de transfección siRNA-GAPDH no tuvo ningún efecto en los niveles de expresión de iNOS-mRNA y ARN-VHC. El control negativo siRNA-non sense se utilizó como control de especificidad. En conjunto, estos resultados sugieren que la inactivación de iNOS inducida por VHC reduce su expresión e incrementa el efecto antiviral de AAS (80%).
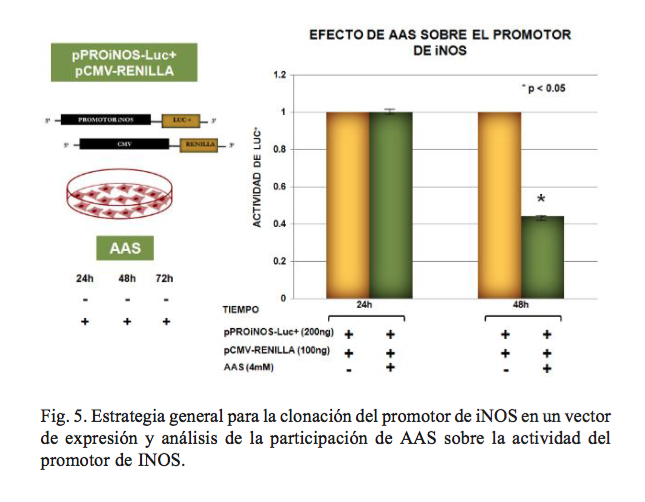
AAs inhibe la actividad del promotor de iNOS
Con el propósito de analizar la participación de AAs sobre la actividad del promotor de iNOS se amplificó la secuencia del promotor de iNO, y posteriormente se clonado en el vector expresión comercial pGL3 basic, el cual contiene el gen reportero de luciferasa (Luc+). Una vez clonado el promotor en el plásmido éste se contransfectó con un constructo que expresa el gen reportero de renilla cuya expresión es dirigida por el promotor de CMV.
La secuencia correspondiente al promotor de iNOS con una longitud de ~2Kb se amplificó con un juego de primers específicos, y el producto se purificó para después realizar una digestión con las enzimas de restricción KpnI y SmaI; de forma simultánea se digirió el vector pGL3.
Los productos se purificaron, y posteriormente se ligaron. Al terminar la clonación, se transformaron bacterias E. coli y se hizo la selección de clonas positivas para bacterias positivas para el plásmido con el pro-iNOS. El promotor se caracterizó con las enzimas, de restricción BclI y SspI cuyas bandas corresponden al patrón teórico esperado.
Una vez listo el plásmido se estandarizó la cantidad de constructo para renilla y luciferasa con seis juegos diferentes de concentraciones. Para renilla 50 y 100ng y para Luc 100, 200, 300ng. Al final se eligieron 100ng de renilla y 200ng de luciferasa, ya que con estas cantidades se obtuvo la mejor señal detectada por el luminómetro. Previo al experimento de cotransfección y a la exposición con AAS, se llevó a cabo un ensayo de viabilidad celular (figura 4).
Con base en los resultados hasta este punto, resumimos lo siguiente: AAS incrementa la concentración de NO y, paradójicamente, inhibe la expresión de iNOS a nivel de RNA y proteína. El silenciamiento de iNOS reduce los niveles de RNA de VHC.
DISCUSIÓN
En este estudio se evaluó la participación de la enzima iNOS en la regulación negativa de RNA del VHC inducida por AAS. Observamos que el AAS reduce iNOS, disminuye la expresión de iNOs a través de la actividad de su promotor; paralelamente, el mRNA y su proteína descienden junto con los niveles de expresión de VHC. Otros grupos de investigación han reportado que los salicilatos pueden suprimir la expresión de iNOS y COX-2, mediante su interacción con la proteína de unión C/EBP-b, la cual interactúa con promotores génicos para activar la transcripción. (17)
También se ha descrito la participación de AAS, a través de la vía de señalización de COX-2; bajo este contexto, fue importante para este estudio la evaluación de la transactivación del promotor de iNOS durante el efecto antiviral de AAS contra VHC, ya que iNOS alberga la secuencia de reconocimiento para C/EBP-b en su promotor. (18)
Además de la inhibición de la ciclooxigenasa, Machida et al. han indicado que la expresión de la proteína del VHC per se puede aumentar la expresión de iNOS. (11) Ellos demostraron que los hepatocitos infectados por el VHC generan un mayor nivel de mRNA de iNOS. Este trabajo sugiere que la infección por VHC estimula la producción de NO a través de la activación de la expresión de iNOS por las proteínas virales principales. (19) Estas observaciones sugieren que la producción de NO por la infección por VHC juega un papel importante en la iniciación y la promoción o la progresión de cáncer en los pacientes infectados por el VHC.
En conclusión, el AAS disminuye la expresión de iNOS a nivel trasncripcional y traduccional y también es capaz de reducir la actividad del promotor de iNOS; por otra parte, el silenciamiento de iNOS, mediante un sistema de RNA de interferencia (siRNA), induce un descenso en la replicación del VHC. Estudios en nuestro grupo de investigación sugieren un potencial efecto antioxidante del AAS, sustentado en la capacidad de este principio activo para incrementar la expresión de superóxido dismutasa (SOD). Por lo tanto, las especies reactivas de nitrógeno y oxígeno podrían considerarse como relevantes blancos terapéuticos para el desarrollo de nuevas estrategias antivirales contra VHC.
RESUMEN
En células de hepatocarcinoma infectadas con el virus de la hepatitis C (VHC), el ácido acetil salicílico (AAS) disminuye los niveles del óxido nítrico sintasa inducible (iNOS), tanto en mRNA como en proteína. La exposición a AAS también redujo la transactivación del promotor génico de iNOS en el modelo in vitro. Un ensayo de silenciamiento génico, con siRNA-iNOS descendió el RNA del VHC (65%), y este efecto antiviral se incrementó en presencia de AAS (80%) en comparación con las células-control. Estos hallazgos sugieren que el óxido nítrico (NO) participa en la regulación del efecto antiviral de AAS sobre VHC.
Palabras clave: VHC, siRNA-iNOS, AAS.
ABSTRACT
In hepatocarcinoma cells infected with the hepatitis C virus (HCV), acetylsalicylic acid (AAS) decreases the levels of mRNA and protein inducible nitric oxide synthase (iNOS). Exposure to AAS also reduced transactivation iNOS gene promoter in an in vitro model. An assay of gene silencing using siRNA-iNOS decreased HCV RNA (65%) and this increased the antiviral effect in presence of AAS (80%) compared to cells-control. These findings suggest that nitric oxide (NO) is involved in the regulation of the antiviral effect of AAS on HCV.
Keywords: VHC, siRNA-iNOS, AAS.
Agradecimientos
Los autores agradecen el apoyo financiero del Conacyt, número de concesión Salud-2008-C01-86996 y de BÁSICA- CB2010-01-155082 para A.M. Rivas.
Abreviaturas: AAS: ácido acetilsalicílico; VHC: virus de la hepatitis C; iNOS, de óxido nítrico sintasa inducible; NO: óxido nítrico; AINES: medicamentos antiinflamatorios, no esteroideos.
* Universidad Autónoma de Nuevo León, FM.
Contacto: amrivas1@yahoo.com
REFERENCIAS
1. Lok A., Seeff L., Morgan T. et al. (2009). Incidence of hepatocellular carcinoma and associated risk factors in hepatitis C-related advanced liver disease. Gastroenterology 136(1):138–148.
2. Bartenschlager R., Frese M., Pietschmann T. (2004). Novel insights into hepatitis C virus replication and persistence. Adv Virus Res 63(1):71–180.
3. Appel N., Schaller T., Penin F. et al. (2006). From structure to function: new insights into hepatitis C virus RNA replication. J Biol Chem 281(15):9833–9836.
4. Kagawa T., Keeffe E., Yu M. et al. (2010). Pegylated interferon and ribavirin treatment for hepatitis C virus infection. Hepat Res Treat 2010:275274.
5. Hoofnagle J., Seeff L. (2006). Peginterferon and ribavirin for chronic hepatitis C. N. Engl J. Med 355(23):2444–2451.
6. Modi A., Hoofnagle J. (2007). New therapies for hepatitis C. Hepatology 46(3):615–617.
7. García-Mediavilla M., Sánchez-Campos S., González-Pérez P. et al. (2005). Differential contribution of hepatitis C virus NS5A and core proteins to the induction of oxidative and nitrosative stress in human hepatocyte-derived cells. J Hepatol 43(4):606–613.
8. Majano P., García-Monzón C. (2003). Does nitric oxide play a pathogenic role in hepatitis C virus infection? Cell Death Differ 10(Suppl 1):S13–S15.
9. Vine C., Cole J. (2011). Nitrosative stress in Escherichia coli: reduction of nitric oxide. Biochem Soc Trans 39(1):213–215.
10. Mello E., Ribeiro S., Carvalho A. et al. (2011). Antifungal activity of PvD1 defensin involves plasma membrane permeabilization, inhibition of medium acidification, and induction of ROS in fungi cells. Curr Microbiol 62(4):1209–1217.
11. Machida K., Cheng K., Sung V. et al. (2004). Hepatitis C virus infection activates the immunologic (type II) isoform of nitric oxide synthase and thereby enhances DNA damage and mutations of cellular genes. J Virol 78(16):8835–8843.
12. Pautz A, Art J, Hahn S et al (2010) Regulation of the expression of inducible nitric oxide synthase. Nitric Oxide 23(2):75–93.
13. García-Monzón C., Majano P., Zubia I. et al. (2000). Intrahepatic accumulation of nitrotyrosine in chronic viral hepatitis is associated with histological severity of liver disease. J Hepatol 32(2):331– 338.
14. Mihm S., Fayyazi A., Ramadori G. (1997). Hepatic expression of inducible nitric oxide synthase transcripts in chronic hepatitis C virus infection: relation to hepatic viral load and liver injury. Hepatology 26(2):451–458.
15. Trujillo-Murillo K., Rincón-Sánchez A, Martínez-Rodríguez H. et al. (2008). Acetylsalicylic acid inhibits hepatitis C virus RNA and protein expression through cyclooxygenase 2 signaling pathways. Hepatology 47(5):1462–1472.
16. Rivas-Estilla A.M., Bryan-Marrugo O.L., Trujillo-Murillo K. et al. (2012). Cu/Zn superoxide dismutase (SOD1) induction is implicated in the antioxidative and antiviral activity of acetylsalicylic acid in HCV-expressing cells. Am J Physiol Gastrointest Liver Physiol 302(11):G1264–G1273.
17. Cieslik K., Zhu Y., Wu K. et al. (2002). Salicylate suppresses macrophage nitric-oxide synthase-2 and cyclo-oxygenase-2 expression by inhibiting CCAAT/enhancer-binding protein-beta binding via a common signaling pathway. J Biol Chem 277(51):49304–49310.
18. Akaike T., Maeda H. (2000). Nitric oxide and virus infection. Immunology 101(1):300–308.
19. De Lucas S., Bartolome J., Amaro M. et al. (2003). Hepatitis C virus core protein transactivates the inducible nitric oxide synthase promoter via NF-kappaB activation. Antiviral Res 60(2):117–124.
20. Rivas-Estilla A., Svitkin Y., López-Lastra M. et al. (2002). PKRdependent mechanisms of gene expression from a subgenomic hepatitis C virus clone. J Virol 76(21):10637–10653.
Recibido: 23/09/15
Aceptado: 23/10/15