ESTRATEGIAS PARA EL DIAGNÓSTICO DE SARS-COV-2
Hugo Leonid Gallardo Blanco*, Mayra Alejandra Castañeda Cataña**,
Celia Nohemí Sánchez Domínguez*
CIENCIA UANL / AÑO 23, No.102 julio-agosto 2020
Las pandemias han formado parte de la historia de la humanidad, la peste de Justiniano, la peste negra, la varicela-zóster (Herpesviridae), el sarampión (Paramyxoviridae), la gripe asiática y la gripe de Hong Kong (Orthomyxoviridae) y la pandemia de la inmunodeficiencia humana HIV (Retroviridae) son sólo algunos ejemplos.
La actual pandemia COVID-19 ha unido al ámbito científico para lograr mejorar las estrategias de detección temprana y tratamiento de la infección ocasionada por el virus SARSCoV-2, ya que el diagnóstico y manejo temprano son prioritarios y cruciales para contener el brote.
Cuando los signos y síntomas de un paciente hacen sospechar de COVID-19, el diagnóstico se basa en pruebas de detección de anticuerpos mediante pruebas serológicas (ELISA) y la confirmación de la presencia del virus. Sin embargo, el proceso comprendido desde la toma de la muestra hasta la entrega del resultado puede demorarse de uno hasta más de cuatro días. Además de que es vital la confirmación para el correcto tratamiento del paciente, la demora en éste puede afectar la respuesta y la posibilidad de recuperación, incrementando el riesgo de complicaciones hospitalarias. Por otra parte, una persona asintomática o presintomática tiene el riesgo de diseminar el virus y contagiar a otras personas, por lo que un diagnóstico temprano de la infección por SARS-CoV-2 es de vital importancia para el control de la enfermedad, identificar focos de infección y controlar su propagación.
La identificación de SARS-CoV-2 se basa en los siguientes principios: 1) detección del virus a través de la identificación de material genético, ARN o de antígenos virales, y 2) detección de los anticuerpos IgM e IgG generados en el organismo huésped infectado (test serológico). Las muestras pueden ser de varios orígenes como hisopos nasales, extractos de nasofaringe o tráquea, esputo o tejido pulmonar, sangre y heces, éstas se deben colectar para la prueba de manera oportuna (Wu et al, 2020).
DETECCIÓN DEL MATERIAL GENÉTICO DEL VIRUS ARN
Reacción en cadena de la polimerasa (PCR)
La Organización Mundial de la Salud estableció el uso de las técnicas moleculares como la reacción en cadena de la polimerasa con transcriptasa inversa (PCR-RT) cuantitativa y, en caso necesario, confirmando mediante secuenciación de ácidos nucleicos. Es una técnica establecida, empleada de manera rutinaria en la mayoría de los laboratorios clínicos (OMS, 2020). La PCR en tiempo real se considera el Gold Standard del diagnóstico, por ser la prueba más confiable y sensible, con al menos 20 kits desarrollados, implementados y validados a la fecha (Carter et al., 2020), con la que es posible detectar portadores asintomáticos y personas infectadas cuando aún no han montado una respuesta inmune.
La PCR se basa en la amplificación exponencial de fragmentos de ADN utilizando una ADN polimerasa termoestable y cebadores específicos para la secuencia blanco, empleando un programa de ciclos de temperaturas. Esto permite detectar la secuencia a partir de un número limitado de copias de ADN diana, lo cual puede observarse cualitativamente utilizando sondas fluorescentes (PCR cuantitativa). Debido a que el SARS-CoV-2 tiene ARN como material genético, éste debe ser convertido a su ADN complementario mediante transcripción reversa.
La ventaja que presenta esta técnica es una elevada especificidad, debido a la elección precisa de zonas del genoma exclusivas de la diana a detectar. Además de una elevada sensibilidad debido al proceso inherente de amplificación exponencial.
Las limitaciones del PCR tiempo real son tiempo, costos, requieren de equipo de laboratorio especializado, instalaciones con equipamiento de biología molecular, medidas de bioseguridad altas debido a que requiere transporte y manejo de muestras, procesamiento, cuantificación y análisis.
Amplificación isotérmica mediada por bucle (LAMP)
Es una técnica molecular que se ha desarrollado desde los años noventa. Funciona bajo el principio de multiplicar el número de copias de un determinado fragmento de ADN o ARN (que en este caso se aísla de la muestra respiratoria extraída al paciente). La gran diferencia es que toda la reacción tiene lugar bajo una misma temperatura, por lo que no se requiere un termociclador. Es una técnica de alta especificidad y eficiencia, que utiliza una DNA polimerasa termofílica con actividad de helicasa, y un grupo de primers novedosamente diseñados para amplificar la secuencia blanco (Yan et al. , 2020).
DETECCIÓN DE LOS ANTICUERPOS IgM E IgG EN PACIENTES
Las pruebas inmunológicas, por otro lado, son de utilidad para detectar anticuerpos, IgM e IgG; hay al menos unos 20 kits desarrollados, implementados y validados hasta la fecha (Carter et al., 2020). No obstante, no son de utilidad para identificar individuos infectados, asintomáticos o presintomáticos (en los primeros días de la infección). Existe también variabilidad en la sensibilidad de los mismos, que va de 50, 80 y algunas cercanas a 98% (CDC, 2020).
Las limitaciones para el desarrollo, validación y uso de anticuerpos son: costo, sensibilidad, especificidad, estabilidad térmica, tiempos y costos de producción.
Es necesario recalcar que no todos los que se han infectado montan una respuesta inmune detectable por los inmunoensayos. Es posible, además, que los componentes específicos del SARSCoV-2019 empleados para dichos estuches influyan en lo anterior, por lo que es un área de oportunidad para explorar con más detalle.
DESARROLLO DE NUEVAS ESTRATEGIAS DE DIAGNÓSTICO
Las pruebas ya mencionadas plantean grandes problemas técnicos para ser realizadas en trabajo de campo, con equipos portátiles, para realizarse en áreas de difícil acceso, con infraestructura poco desarrollada, además de exponer al personal de salud de múltiples formas, por exposición a fluidos corporales potencialmente biológico-infecciosos, riesgos de salud por ataque de gente molesta y con miedo, etc.
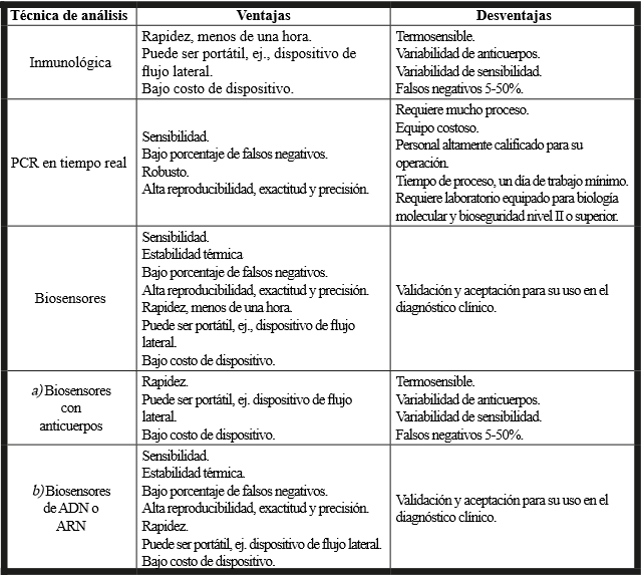
Debido a esto, es necesario desarrollar pruebas diagnósticas que sean altamente sensibles, específicas, exactas, de bajo costo, que no requieran equipo costoso y sofisticado, portables y rápidas (de preferencia tiempos menores a dos horas desde la toma de muestra hasta su análisis e interpretación). También, que requieran un manejo y manipulación mínima. La tabla I muestra una comparación de los métodos actualmente descritos para el diagnóstico de SARS-CoV-2 (Carter et al., 2020; CDC, 2020; Yan et al., 2020; Li et al., 2020; Chen et al., 2020; Qiu et al., 2020; Seo et al., 2020; Sportelli et al., 2020; Arons et al., 2020; Gandhi, Yokoe y Havlir, 2020).
En general, los métodos de diagnóstico basados en la proteína spike son los más utilizados. Esta glicoproteína suele ser un objetivo terapéutico y diagnóstico debido a que permite la unión y fusión del virus en la membrana del huésped para guiar la entrada del coronavirus. Spike se compone de dos subunidades: la subunidad S1 reconoce y se une a los receptores del huésped, y la subunidad S2 facilita la fusión entre la envoltura viral y la membrana de la célula del huésped. En cuanto a los métodos de diagnóstico, una ventaja para la detección específica de SARSCoV-2 utilizando spike es la diversidad en la secuencia de aminoácidos entre los distintos tipos de coronavirus (Sportelli et al., 2020).
EJEMPLOS DE DISPOSITIVOS NO CONVENCIONALES
Biosensores
Dispositivo biosensor FET de grafeno
Los dispositivos biosensores basados en transistores de efecto de campo (FET, por sus siglas en inglés) tienen varias ventajas: sus mediciones son altamente sensibles, instantáneas y requieren pequeñas cantidades de analitos, por lo que se consideran potencialmente útiles en el diagnóstico clínico como pruebas in situ. El grafeno es una lámina bidimensional de átomos de carbono dispuestos hexagonalmente, los cuales están expuestos en su superficie. Los biosensores FET basados en grafeno pueden detectar cambios circundantes en su superficie y proporcionar un entorno de detección óptimo para la detección ultrasensible y de bajo ruido.
Con la finalidad de detectar SARS-CoV-2 en muestras de pacientes, un grupo de trabajo creó un dispositivo biosensor que se basa en FET; éste se construyó utilizando láminas de grafeno recubiertas con un anticuerpo específico contra la proteína spike. Para comprobar el funcionamiento del sensor se utilizaron proteínas antigénicas, virus cultivados y muestras nasofaríngeas de pacientes con COVID-19. El dispositivo diseñado pudo detectar la proteína spike de SARS-CoV-2 en concentraciones tan bajas como 1 fg/ml en solución salina tamponada con fosfato, mientras que en medio de transporte clínico se logró la detección de hasta 100 fg/ml. Adicionalmente, el sensor FET detectó el SARS-CoV-2 en medio de cultivo con un límite de detección (LOD) de 1.6×101 pfu/ml), así cómo en muestras clínicas, con un LOD de 2.42×102 copias/ml (Seo et al., 2020).
Biosensor plasmónico dual PPT-LSPR
El efecto fototérmico plasmónico (PPT) y la detección de resonancia de superficie de plasmón localizada (LSPR) se combinaron en un biosensor de doble función.
LSPR representa una fuerte oscilación coherente de los electrones de conducción en la superficie, la cual es impulsada por fotones. Se puede modular cuando el acoplamiento se produce en la superficie de materiales plasmónicos. Debido al mejoramiento del campo plasmónico en la vecindad de las nanoestructuras, los sistemas LSPR son altamente sensibles a las variaciones locales, incluyendo el cambio de índice de refracción y la unión molecular. Debido a ello, LSPR es un candidato ideal para la detección de analitos a micro y nanoescala.
El biosensor propuesto por un grupo de trabajo consistió en nanoislas de oro bidimensionales (AuNI) funcionalizadas con receptores de ADN complementarios para realizar la detección de SARS-CoV-2, bajo el principio de hibridación de ácidos nucleicos. Ya que dos cadenas de ácidos nucléicos complementarias pueden hibridarse específicamente entre sí a una temperatura ligeramente menor que su temperatura de fusión, los desapareamientos influyen de manera dramática haciendo que la temperatura de fusión se altere significativamente. Las nanopartículas plasmónicas normalmente exhiben grandes secciones transversales ópticas y la luz absorbida se puede relajar generando una energía de calentamiento significativa. El calor termoplasmónico generado en el mismo chip AuNIs cuando se ilumina a su frecuencia de resonancia plasmónica contribuye a mejorar el rendimiento de detección. El calor PPT localizado es capaz de elevar la temperatura de hibridación in situ para facilitar la discriminación entre dos secuencias de genes similares, siendo altamente sensible para las secuencias de SARSCoV-2. En este trabajo el dispositivo presentó un límite de detección de 0.22 pM (Qiu et al., 2020).
DISPOSITIVOS DE FLUJO LATERAL PARA DETECTAR ANTICUERPOS IgG E IgM ANTISARS-COV-2
El diagnóstico de COVID-19 utilizando dispositivos de flujo lateral son una opción rápida y simple, con la ventaja adicional de que no se requiere equipo ni entrenamiento especializado, y puede utilizarse en el sitio de atención. Los dispositivos generalmente se diseñan para detectar anticuerpos IgM e IgG antiSARS-CoV-2 en suero de pacientes. En el caso de dispositivos que detectan ambos anticuerpos, dan información adicional sobre el estado de la infección. El principio general de los dispositivos es el reconocimiento de los anticuerpos del paciente hacia un antígeno particular del SARSCoV-2 que se fija en el dispositivo. Para la detección se utiliza un anticuerpo secundario que detecta los anticuerpos humanos, que previamente se conjugó con una nanopartícula que funciona como el principio de detección. En los dispositivos se incluye también un control, el cual suele ser otro anticuerpo no relacionado, pero marcado con el mismo principio de detección que sirve como control de que la técnica ha sido realizada correctamente. En cuanto a los nanomateriales, las nanopartículas de oro son muy utilizadas en estos dispositivos, sin embargo se han reportado otros materiales, como describimos a continuación.
Dispositivo de flujo lateral con nanopartículas de poliestireno
Un grupo de investigación desarrolló un material alternativo compuesto por nanopartículas de poliestereno dopadas con lantánidos (LNP). Una vez que la muestra de suero del paciente se coloca en la almohadilla y después de diez minutos de corrimiento, si existen anticuerpos IgG-SARV-CoV-2, éstos reconocerán la fosfoproteína nucleocápside recombinante de SARS-CoV-2 que se encuentra depositada sobre una membrana de nitrocelulosa. Posteriormente se lee la fluorescencia emitida por las líneas prueba y control con un fluorómetro portátil. El grupo de investigación validó el dispositivo utilizando 51 muestras de personas sanas para determinar un valor de corte. Se probaron siete muestras previamente positivas por RT-PCR y 12 negativas, pero clínicamente sospechosas de la presencia de IgG antiSARS-CoV-2. Además de la detección con este dispositivo de las siete previamene positivas, resultó positiva una de las 12 muestras sospechosas previamente negativas por RTPCR, sugiriendo una potencial aplicación del innovador dispositivo para diagnóstico y seguimiento de pacientes (Chen et al., 2020).
Dispositivo de flujo lateral con nanopartículas de oro.
Bajo un principio similar, se propuso un diseño que emplea nanopartículas de oro, empleando como molécula de reconocimiento una proteína que corresponde al dominio de unión al receptor de la proteína spike de SARS-CoV-2. La ventaja de este dispositivo frente al anterior, es que detecta tanto anticuerpos IgM como IgG. Este dispositivo se empleó en un número mayor de pacientes y controles (397 pacientes confirmados por PCR y 128 negativos), y reportó una sensibilidad de 88.66% y una especificidad de 90.63% (Li et al., 2020).
CONCLUSIONES
En la actualidad, la necesidad de enfrentar la nueva epidemia de COVID-19 ha disparado la investigación en las áreas de diagnóstico, con la finalidad de lograr una detección temprana y reducir los falsos negativos, tanto en pacientes portadores del virus sintomáticos como asintomáticos. La combinación de conocimientos en las áreas de la Inmunología, Biología molecular y Nanotecnología ha permitido el desarrollo de novedosos dispositivos que potencialmente pueden ser de utilidad, una vez validados, para hacerle frente a la pandemia COVID-19.
* Universidad Autónoma de Nuevo León.
** Universidad de Buenos Aires.
Contacto: hugo.gallardobl@uanl.edu.mx
REFERENCIAS
Arons, M.M., Hatfield, K.M., Reddy, S.C., et al. (2020). Presymptomatic SARS-CoV-2 Infections and Transmission in a Skilled Nursing Facility. New Engl J Medicine. 382-2081-2090. https://doi. org/10.1056/nejmoa2008457
Carter, L.J., Garner, L.V., Smoot, J.W., et al. (2020). Assay Techniques and Test Development for COVID-19 Diagnosis. Acs Central Si. 6:591-605. https://doi.org/10.1021/acscentsci.0c00501
CDC. (2020). COVID-19 Pandemic Planning Scenarios. Disponible en: https://www.cdc.gov/coronavirus/2019-ncov/hcp/planning-scenarios.html
Chen, Z., Zhang, Z., Zhai, X., et al. (2020). Rapid and Sensitive Detection of anti-SARS-CoV-2 IgG, Using Lanthanide-Doped Nanoparticles-Based Lateral Flow Immunoassay. Anal Chem. 92:72267231. https://doi.org/10.1021/acs.analchem.0c00784
Gandhi, M., Yokoe, D.S., y Havlir, D.V. (2020). Asymptomatic Transmission, the Achilles’ Heel of Current Strategies to Control Covid-19. New Engl J Medicine. 382:2158-2160. https://doi. org/10.1056/nejme2009758
Li, Z., Yi, Y., Luo, X., et al. (2020). Development and Clinical Application of A Rapid IgM-IgG Combined Antibody Test for SARSCoV-2 Infection Diagnosis. J Med Virol. https://doi.org/10.1002/ jmv.25727
OMS. (2020). Pruebas de laboratorio para el coronavirus causante del síndrome respiratorio de Oriente Medio (MERS-CoV). Disponible en: https://apps.who.int/iris/bitstream/handle/10665/188247/ WHO_MERS_LAB_15.1_spa.pdf?sequence=1
Qiu, G., Gai, Z., Tao, Y., et al. (2020). Dual-Functional Plasmonic Photothermal Biosensors for Highly Accurate Severe Acute Respiratory Syndrome Coronavirus 2 Detection. Acs Nano. 14:5268– 5277. https://doi.org/10.1021/acsnano.0c02439
Seo, G., Lee, G., Kim, M.J., et al. (2020). Rapid Detection of COVID-19 Causative Virus (SARS-CoV-2) in Human Nasopharyngeal Swab Specimens Using Field-Effect Transistor-Based Biosensor. Acs Nano. 14:5135-5142. https://doi.org/10.1021/acsnano.0c02823
Sportelli, M.C., Izzi, M., Kukushkina, E.A., et al. (2020). Can Nanotechnology and Materials Science Help the Fight against SARSCoV-2? Nanomater Basel Switz. 10:802. https://doi.org/10.3390/ nano10040802
Yan, C., Cui, J., Huang, L., et al. (2020). Rapid and visual detection of 2019 novel coronavirus (SARS-CoV-2) by a reverse transcription loop-mediated isothermal amplification assay. Clin Microbiol Infect Official Publ European Soc Clin Microbiol Infect Dis. 26:773-779. https://doi.org/10.1016/j.cmi.2020.04.001
Wu, D., Wu, T., Liu, Q., et al. (2020). The SARS-CoV-2 outbreak: what we know. Int J Infect Dis Ijid Official Publ Int Soc Infect Dis. 9:44–48. https://doi.org/10.1016/j.ijid.2020.03.004