Contribución al estudio de las neoplasias y pseudoneoplasias en el hurón
Rolando A. Silva Pérez*, Cecilia Ramírez Hernández*, Álvaro Barbosa Quintana**, Emilio Olivares Sáenz***, Yahaira Maciel Martínez*, Rafael Ramírez Romero*
CIENCIA UANL / AÑO 20, No. 86 octubre-diciembre 2017
Resumen
El hurón (Mustela putorius furo) se ha convertido en una mascota exótica muy popular. Las enfermedades neoplásicas de los hurones son una sección relevante en la patología quirúrgica veterinaria. En este trabajo se presentan la descripción morfológica y el diagnóstico de nueve neoplasias y tres pseudoneoplasias durante el periodo enero 2010-diciembre 2014. Los diagnósticos incluyen: tumor de células cebadas (2/12), linfoma (2/12), mesotelioma (1/12), epitelioma sebáceo (1/12), leiomiosarcoma (1/12), cordoma (1/12), carcinoma cortical adrenal (1/12). También se realizaron tinciones especiales e inmunohistoquímica (IHQ). Las lesiones pseudoneoplásicas resultaron: linfadenitis (1/12) esplenomegalia (1/12) y quiste de glándulas apócrinas (1/12).
Palabras clave: hurón, neoplasia, tumor, patología, inmunohistoquímica.
Abstract
The ferret (Mustela putorius furo) has become a very popular exotic pet. Neoplastic disease in ferrets is a relevant section in veterinary surgical pathology. This paper presents the morphological description and diagnosis of nine neoplasms and three pseudoneoplasms during the period of January 2010-December 2014. The diagnoses include: mast cell tumor (2/12), lymphoma (2/12) mesothelioma (1/12), sebaceous epithelioma (1/12), leiomyosarcoma (1/12), chordoma (1/12), adrenocortical carcinoma (1/12). Special stains and Immunohistochemistry (IHC) were also performed. The pseudoneoplastic lesions resulted in: lymphadenitis (1/12), splenomegaly and apocrine gland cyst (1/12).
Keywords: ferret, neoplasm, tumor, pathology, immunohistochemistry.
El hurón (Mustela putorius furo) es actualmente una mascota muy popular (Miwa et al., 2009; Bakthavatchalu et al., 2016). No obstante, su importancia va más allá de su inclusión como mascota exótica, dado que se le considera un modelo animal tanto para enfermedades infecciosas como metabólicas del hombre (Bakthavatchalu et al., 2016; Belser, Katz y Tumpey, 2011). Las neoplasias son también un área de mayor relevancia, dada la oportunidad de comparar el desarrollo de lesiones tumorales espontáneas en el hurón con tumores en el hombre (Beuschlein, Galac y Wilson, 2012; Di Cerbo et al., 2014; Chen, 2010).
Aunque en principio se consideró que las neoplasias eran raras en los hurones, ahora se sabe que, por el contrario, las neoplasias son frecuentes en el hurón geriátrico (Miwa et al., 2009; Bakthavatchalu et al., 2016; Chen, 2010; Avallone et al., 2016), e incluso la presentación espontánea de algunas de ellas ha sido tema de investigación en oncología y epidemiología comparadas (Beuschlein, Galac y Wilson, 2012; Di Cerbo et al., 2014). Por ejemplo, las neoplasias de las glándulas adrenales y el insulinoma ocurren frecuentemente en el hurón y su estudio ha sido extrapolado con los correspondientes tumores en el hombre (Beuschlein, Galac y Wilson, 2012; Di Cerbo et al., 2014; Chen, 2010). Actualmente existen varios informes sobre neoplasias espontáneas en el hurón (Miwa et al., 2009; Bakthavatchalu et al., 2016; Chen, 2010; Avallone et al., 2016).
La patología quirúrgica es el procedimiento de elección cuando se trata de caracterizar lesiones que aparecen en el cuerpo de un animal o del hombre y se requiere de una primera apreciación de su morfología. No hay procedimiento superior (incluyendo el diagnóstico molecular) a la histopatología para esta primera aproximación clínico-patológica (Rosai, 2007).
En este estudio se muestra la caracterización de aquellas neoplasias y pseudoneoplasias que se presentan de manera natural en el hurón, así como la determinación de su patrón inmunohistoquímico en caso de ser requerido.
Material y métodos
El registro de Patología Diagnóstica Veterinaria (empresa dedicada a diagnóstico mediante estudios de patología) se utilizó para recuperar los bloques de parafina que contienen lesiones que previamente fueron diagnosticadas como neoplasias o lesiones semejantes a neoplasias, durante el periodo comprendido entre 2010-2014. Las muestras se recibieron de clínicas particulares que atienden pequeñas especies y animales exóticos, localizadas en el área metropolitana de Monterrey, Nuevo León, México, cuya información del punto central corresponde a las siguientes coordenadas: Oeste 100°18´39.30´´; Norte 25°42´38.01´´; altura 520 msnm. El proceso histológico se realizó en su totalidad en el Departamento de Anatomía Patológica del Hospital Universitario de la Universidad Autónoma de Nuevo León (UANL). Los estudios de inmunohistoquímica (IHQ) se realizaron tanto en el Departamento de Anatomía Patológica de la UANL como en el Laboratorio de Patología del Hospital San José del Instituto Tecnológico de Monterrey.
Los bloques de parafina de los casos confirmados se procesaron por medio de la técnica de histopatología convencional. Además, se realizaron tinciones especiales de Ziehl-Neelsen, giemsa, mucicarmina y ácido peryódico de Schiff (PAS). En algunos casos también, azul de toluidina, azul alciano y tricrómica de Masson. También se utilizó la técnica de inmunohistoquímica en los casos que fue necesaria y posteriormente se fotografiaron sus características y se establecieron, conforme a la bibliografía especializada, aspectos comparativos de patología en otras especies incluyendo humanos.
El modelo estadístico implementado fue un muestreo simple de proporciones (Scheaffer, Mendenhall y Ott, 2007), con la finalidad de estimar la proporción o porcentaje de incidencia de los diferentes tipos de neoplasias que se presentan cuando un diagnóstico preliminar sugiere algún tipo de neoplasia o lesiones semejantes a las mismas.
El tamaño de muestra fue determinado mediante la siguiente ecuación:
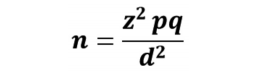
en donde z es el valor tabulado de la distribución normal estándar para una confiablidad de 95% en la estimación por intervalo (1.96), p es la proporción la cual fue de 50%, q es 1– p y d es la precisión la cual fue de 0.29. Por lo tanto, de acuerdo a estos valores se determinó el tamaño de la muestra, siendo ésta de 11 muestras, concordando con el número de animales (11 hurones), en uno de los cuales se presentaron dos lesiones, dando un total de 12 muestras.
Resultados
Los análisis histopatológicos de los 11 animales, todos mantenidos como mascotas, revelaron siete tipos diferentes de neoplasias; de las cuales las más frecuentes fueron el mastocitoma (2/12) y el linfoma (2/12), ambos con una proporción de 0.16, seguidos por el cordoma condroide, epitelioma sebáceo, mesotelioma, leiomiosarcoma (piloleiomiosarcoma) y carcinoma cortical de adrenales (1/12), cada uno con una proporción de 0.08. Las pseudoneoplasias fueron tres, quiste de glándulas apocrinas (1/12), esplenomegalia (1/12) y linfadenitis (1/12), teniendo una proporción 0.08 cada una.
En cuanto a los sistemas donde se presentaron las neoplasias y pseudoneoplasias, el de mayor incidencia fue el sistema tegumentario, con cuatro neoplasias (4/12; dos mastocitomas, un epitelioma sebáceo y un leiomiosarcoma), con una proporción de 0.33 y un pseudoneoplasia (1/12; un quiste de glándulas apócrinas), con una proporción de 0.08; 0.41 en total. El siguiente fue el sistema hemolinfático en donde se presentaron dos neoplasias (2/12; 2 linfomas), con una proporción de 0.16 y dos pseudoneoplasias (2/12; un esplenomegalia y un linfadenitis) con la misma proporción, 0.32 en total. En cambio, el sistema endocrino, músculo esquelético y cavidad abdominal presentaron un caso (1/12; carcinoma cortical adrenal, cordoma y mesotelioma, respectivamente), teniendo como proporción 0.08 cada uno de ellos. De acuerdo con estos resultados, no existe una neoplasia prevaleciente en la muestra estudiada, sin embargo, se encontró que el sistema tegumentario y el sistema hemolinfático presentaron una mayor incidencia.
Las neoplasias más características y representativas de este trabajo fueron el linfoma, el mastocitoma, el cordoma condroide, el carcinoma de corteza adrenal y el mesotelioma. La descripción de las neoplasias antes mencionadas se realizó de acuerdo a lo observado en cada caso; asimismo, se presentan imágenes representativas de algunas de ellas.
Linfoma
Macho de 4 años, castrado; el otro caso sin datos, respectivamente. En el riñón se observó una extensa infiltración multinodular coalescente de aspecto hipercelular denso que distorsiona la arquitectura renal, este infiltrado se extiende tanto en corteza como en médula renal y también hay extensas áreas de necrosis. Las células infiltrantes son linfocitos grandes neoplásicos que toman una forma elíptica y ocasionalmente poligonal con núcleo abierto granular y nucléolo prominente. Otros cambios incluyen descamación epitelial obliterando túbulos colectores y ocasional mineralización (figura 1). En el otro caso, del cual no se proporcionaron datos, la lesión fue intestinal y provocó infiltración linfoblásica en lámina propia de mucosa, exteníendose hasta submucosa. La muscular se mantuvo escasamente infiltrada, pero la serosa se encontró infiltrada por células neoplásicas. Ambos casos resultaron positivos a CD3. Los animales murieron al poco tiempo del diagnóstico.
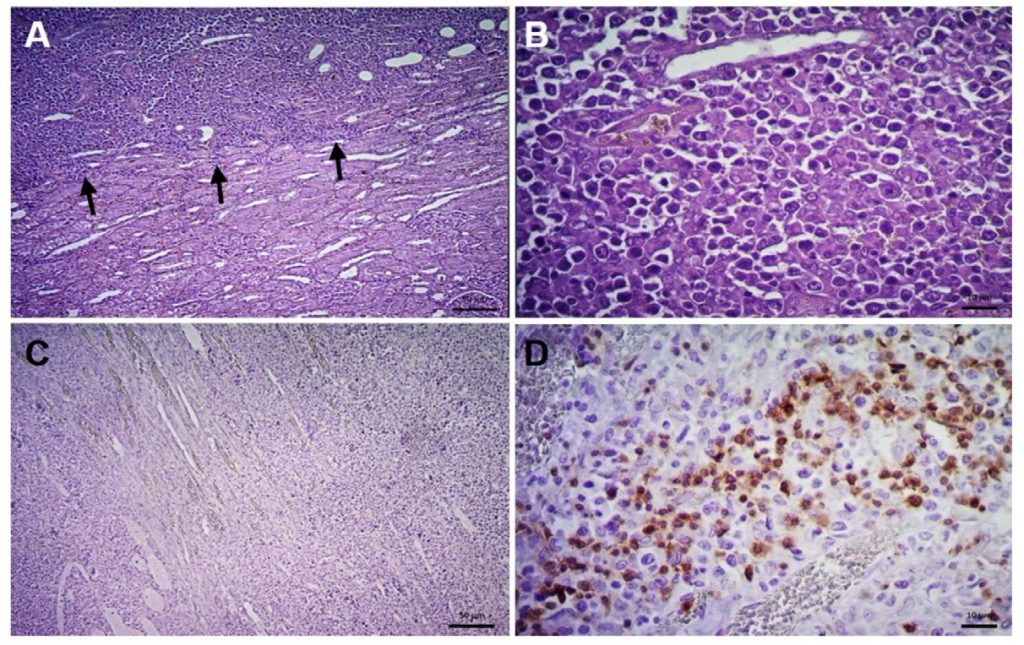
Figura 1. Linfoma renal. A, tejido linfoide neoplásico infiltrante (flechas) (H&E; barra: 50 µm). B, proliferación de linfocitos, nótese pleomorfismo, citomegalia y cariomegalia (H&E; barra: 10 µm). C, IHQ (marcador CD20) negativa (barra: 50 µm). D, IHQ (marcador CD3) positiva (barra: 10 µm).
Mastocitoma
Hembras de 3 y 5 años de edad, una de ellas castrada. Neoplasias muy celulares, compuestas por células cuboidales grandes con morfología histiocítica en ambas muestras. En la neoplasia más grande las células tumorales alcanzan casi el estrato basal de epidermis; en la neoplasia pequeña las células tumorales están delimitadas en dermis profunda e hipodermis. Las células neoplásicas en ambas son poligonales cuboidales o bien ovoides cuando se encuentran aisladas, con núcleo grande vacuolado o granular y nucléolo discernible, no se reconocieron mitosis. El citoplasma es basófilo y en la mayoría pueden distinguirse pequeños gránulos. Las células forman pequeños conglomerados y en algunas zonas cordones bien definidos, el estroma es escaso y forma trabéculas de tejido conectivo. Las neoplasias están limitadas, pero no hay una cápsula definida. La presencia de eosinófilos es escasa. En estos casos los animales sobrevivieron.
Cordoma condrioide
Macho de 5 años de edad. Neoplasia heterogénea con múltiples componentes tisulares. Se aprecia bien delimitada y en su mayoría encapsulada. Los componentes son: células oblongas o poligonales con citoplasma extensamente vacuolado y en menor proporción, células con citoplasma finamente vacuolado. Estas células muestran diferenciación adiposa en la mayor parte del tumor (posteriormente se confirmó que se trataba de células fisalíforas). Además, se apreció una extensa matriz colágena entreverada entre estas células. En algunas zonas se reconoce inclusive una diferenciación de cartílago y tejido óseo parcialmente diferenciado, todos estos elementos ocurren en diferentes zonas con participación preponderante del componente celular vacuolado. Ocasionalmente estas células presentan varios núcleos (multinucleadas) con aspecto megacariocítico, en algunas zonas demuestran un arreglo hemangioendotelial. No se apreciaron mitosis pero sus núcleos son altamente pleomórficos y muestran formas bizarras en su cromatina. Otros componentes en el tumor son zonas de hemorragia, necrosis y zonas de calcificación (figura 2). El animal murió poco después del diagnóstico.
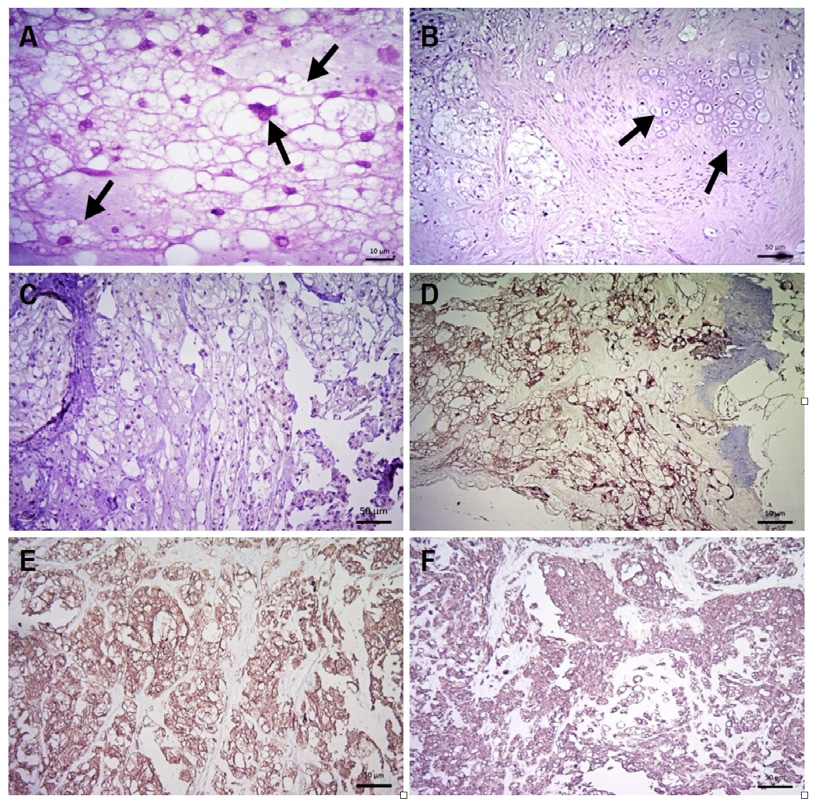
Figura 2. Cordoma condroide. A, células vacuoladas (fisalíforas) embebidas en una matriz mixoide (flechas) (H&E; barra: 10 μm). B, células vacuoladas coalecentes, además depósito condroide en osificación (flechas) (H&E; barra: 50 μm). C, IHQ (marcador TTF-1) negativa (barra: 50 μm). D, IHQ (marcador S-100) positiva (barra: 50 μm). E, IHQ (marcador citoqueratina) positiva (barra: 50 μm). F, IHQ (marcador vimentina) positiva (barra: 50 μm).
Carcinoma de corteza adrenal
Animal sin datos. En la glándula adrenal se observa un componente de aspecto cavitado formando dilataciones amplias llenas de sangre. Aquí las células tumorales son cuboidales y organizadas en cordones bien demarcados que tapizan las cavitaciones. En algunas zonas no hay sangre en el interior, sino un material proteináceo homogéneo. En otras zonas las células se vuelven más ovoides y se organizan de manera compacta sólida, aquí hay algunas mitosis. Las células muestran nucléolo prominente y un citoplasma grumoso eosinofílico (figura 3). No se tienen datos complementarios sobre la evolución del paciente.
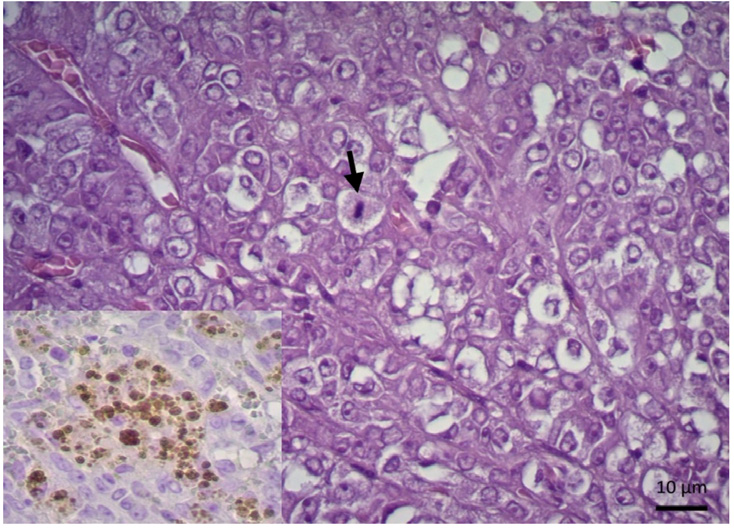
Figura 3. Glándula adrenal, carcinoma de corteza adrenal. Se aprecia una proliferación parcialmente organizada en cordones, células cuboidales pleomórficas, en ocasiones se aprecian mitosis (flecha) (H&E; barra: 10 µm). Inserto, IHQ (marcador calretinina) positiva, inmunoreacividad granular en citoplasma de algunas células neoplásicas (barra: 10 µm).
Mesotelioma
Animal sin datos. Se observó una proliferación de células cuboidales organizadas en estrato simple, con polarización en su base sobre membrana basal gruesa y hialina. Asimismo, muestran la misma proliferación que forma protrusiones polipoides o simplemente densas e hipercelulares en las que el estroma es escaso. Dentro de las partes más densas e hipercelulares se advierte mitosis eventual (1-2/10x) y zonas de necrosis en donde la necrosis individual y cariorrexis (apoptosis) es común. Hacia su exterior la neoplasia muestra una marcada proliferación de tejido conectivo fibroso y hemorragias, hay inclusive zonas hialinas extensas de tejido conectivo que se mineralizan (figura 4). No se obtuvieron datos sobre la evolución del paciente.
Pseudoneoplasias
En cuanto a las lesiones no neoplásicas, se incluye la descripción de la linfadenitis en linfonodo mesentérico y el hiperesplenismo, ambas por su forma y localización correspondieron al sistema hemolinfátio, sin embargo, se presenta únicamente imagen del hiperesplenismo. La primera lesión correspondió a una hembra castrada, de 1 año de edad. Se observó tejido linfoide con algunos remanentes de la arquitectura folicular, la cual se ha reemplazado por la formación de múltiples granulomas y extensas zonas de necrosis caseosa. Asimismo, hay áreas con una intensa proliferación de tejido conectivo fibroso y neovascularización. Los granulomas están compuestos predominantemente por neutrófilos y macrófagos activos epitelioides, pero no se apreciaron células gigantes. En su mayoría los piogranulomas muestran necrosis caseosa sin participación bacteriana, la formación de la cápsula es pobre, pero hay zonas con amplia vascularización. El animal murió al poco tiempo del diagnóstico. El caso de hiperesplenismo correspondió a una hembra de 5 años aproximadamente. En el fragmento de bazo se apreció una estructura histológica normal con atenuación de los folículos linfoides en la pulpa blanca y pequeños islotes celulares en la roja y depósitos de hemosiderina. Estos islotes contienen células precursoras hematopoyéticas (figura 5). El animal murió poco tiempo después, pero no se estableció el diagnótico post mortem.
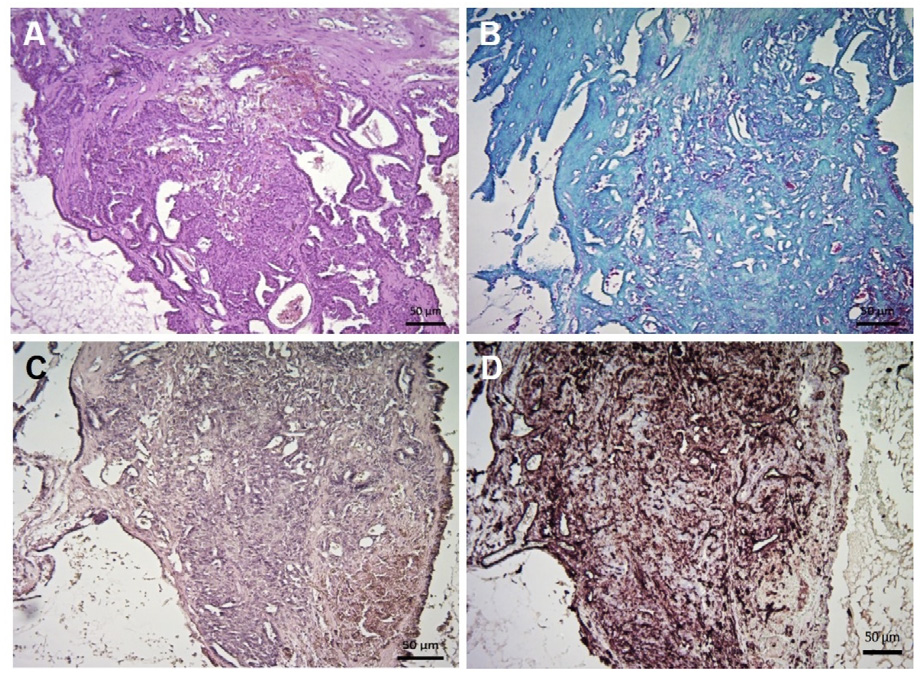
Figura 4. Masa sobre mesenterio, mesotelioma. A, proliferación adenomatoide con amplias cavitaciones y proyecciones polipoides (H&E; barra: 50 µm). B y C, tinciones azul alciano y mucicarmina, respectivamente, demuestran negatividad a componentes de secreción glandular (barra: 50 µm). D, IHQ (marcador vimentina) positiva (barra: 50 µm).
Discusión
Las neoplasias y pseuoneoplasias encontradas en el presente estudio fueron mesotelioma, linfoma, leiomiosarcoma, mastocitoma, epitelioma sebáceo, cordoma, carcinoma cortical adrenal, linfadenitis, hiperesplenismo y quiste de glándulas apócrinas. Sin embargo, no existe una neoplasia o pseudoneoplasia claramente prevalente en la muestra estudiada. Por otra parte, aunque no se tienen todos los antecedentes en cada caso, la mayoría de los animales con neoplasias fueron adultos entre 3 y 5 años de edad. A esta edad el hurón comienza a presentar problemas geriátricos incluyendo neoplasias (Bakthavatchalu et al., 2016). Las otras lesiones fueron variables, la linfadenitis en una hembra joven (1 año) y el hiperesplenismo en una adulta (5 años).
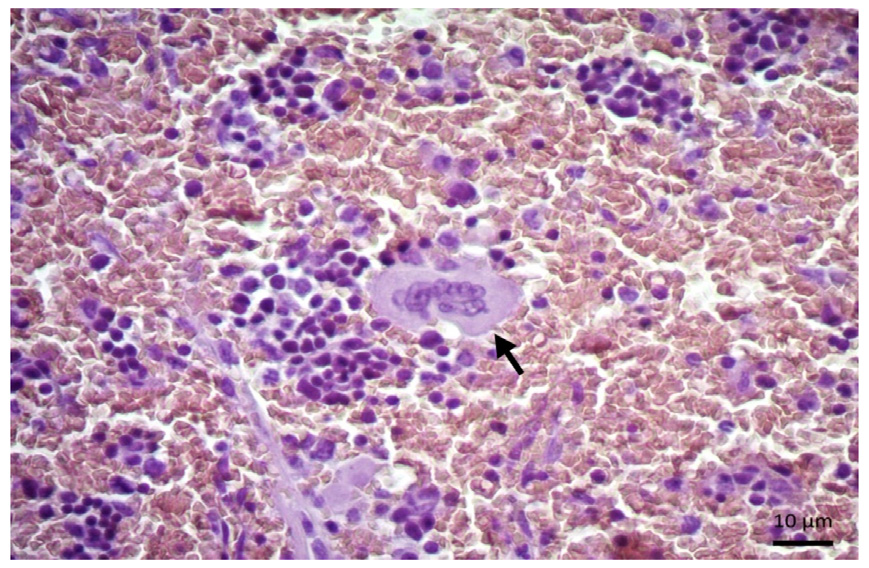
Figura 5. Bazo, hiperesplenismo. Extensión de la pulpa roja y depósitos de hemosiderina, folículos linfoides mal definidos y disminución de la pulpa blanca; se observa una célula multinucleada de gran tamaño, concordante con un megacariocito (flecha), característico de hematopoyesis extramedular en hiperesplenismo (H&E; barra: 10 µm).
En el presente estudio el sistema que presentó una mayor incidencia de neoplasias y pseudoneoplasias fue el sistema tegumentario, seguido por el sistema hemolinfático. Aunque el sistema endócrino ha resultado más afectado en otros estudios, también los sistemas tegumentario y hemolinfático se incluyen entre los sistemas más afectados (Miwa et al., 2009; Avallone et al., 2016). Asimismo, la neoplasia incluida en sistema endócrino fue el carcinoma de corteza adrenal. Por otra parte, el insulinoma, referido frecuentemente en la bibliografía (Miwa et al., 2009; Avallone et al., 2016), no se identificó en este trabajo, quizá por el escaso número de muestras incluidas.
En el sistema tegumentario los mastocitomas resultaron una neoplasia frecuente en piel, lo que ya se ha reconocido en otros estudios (Miwa et al., 2009; Avallone et al., 2016). También el adenoma sebáceo y el leiomiosarcoma han sido mencionados en el sistema tegumentario (Miwa et al., 2009; Avallone et al., 2016). El quiste apócrino aquí asociado a un mastocitoma en el mismo animal es una lesión comúnmente asociada a mastocitomas en el perro (Meuten, 2017).
En el sistema hemolinfático llama la atención una presentación de linfoma linfoblástico en riñón. Esta presentación es muy rara en perro, pero no así en gatos ni en hurones (Avallone et al., 2016; Meuten, 2017; Ammersbach et al., 2008). Por otra parte, los estudios de inmunohistoquímica demostraron en ambos casos que los linfocitos T (CD3 positivos) fueron las células neoplásicas con mayor población linfoide identificada en estas neoplasias. Con anterioridad se ha referido que, en el hurón, tanto los linfocitos T como B pueden ser poblaciones celulares neoplásicas (Ammersbach et al., 2008). Otra condición en el sistema hemolinfático es la esplenomegalia (hiperesplenismo) que aquí se reconoció; esta patología que no tiene una etiología específica no es rara en hurones (Miwa et al., 2009).
Otra neoplasia relevante de la que en principio se sospechó de carcinoma en tiroides, resultó un cordoma de probable origen esfenoidal, lo que no es común en el hurón, ya que el sitio más frecuente es la cola del animal (Avallone et al., 2016). La revisión posterior del caso y la negatividad al marcador TTF-1 descartó la posibilidad de que se tratara de un tumor tiroideo y se confirmó cordoma condroide.
El mesotelioma es un tumor poco común, tanto en medicina humana como en medicina veterinaria. En la patología médica el mesotelioma maligno se ha asociado a la influencia contaminante tóxica del asbesto, lo cual no está relacionado con mesoteliomas en animales domésticos (Williams, Garner y Kawasaki, 1994). En pequeñas especies es muy raro (Meuten, 2017); sin embargo, han sido referidos dos casos en el hurón con una presentación muy similar a la que aquí se registró (Williams, Garner y Kawasaki, 1994).
Finalmente, el carcinoma cortical adrenal es una complicación frecuente (endocrinopatía adrenal) en hurones castrados, tanto machos como hembras (Bakthavatchalu et al., 2016; Chen, 2010); sin embargo, en el presente estudio no se obtuvieron más datos en el caso correspondiente.
El presente trabajo contribuye al conocimiento sobre las neoplasias en hurones, particularmente sus características histopatológicas.
* Facultad de Medicina Veterinaria y Zootecnia.
** Facultad de Medicina.
*** Facultad de Agronomía.
Universidad Autónoma de Nuevo León.
Contacto: raramirez@prodigy.net.mx
Referencias
Ammersbach, M., et al. (2008). Laboratory findings, histopathology, and immunophenotype of lymphoma in domestic ferrets. Vet Pathol, 45(5), 663-673.
Avallone, G., et al. (2016). Neoplastic diseases in the domestic ferret (Mustela putorius furo) in Italy: classification and tissue distribution of 856 cases (2000-2010). BMC Vet Res, 5; 12(1), 275.
Bakthavatchalu, V., et al. (2016). Endocrinopathy and Aging in Ferrets. Vet Pathol, 53(2), 349-365.
Belser, J., Katz, J.M., y Tumpey, T.M. (2011). The ferret as a model organism to study influenza A virus infection. Dis Model Mech, 4 (5), 575-579.
Beuschlein, F., Galac, S., y Wilson, D.B. (2012). Animal models of adrenocortical tumorigenesis. Mol Cell Endocrinol, 351(1), 78-86.
Chen, S. (2010). Advanced diagnostic approaches and current medical management of insulinomas and adrenocortical disease in ferrets (Mustela putorius furo). Vet Clin Exot Anim, 13(3), 439-452.
Di Cerbo, A., et al. (2014). Onco-epidemiology of domestic animals and targeted therapeutic attempts: perspectives on human oncology. J Cancer Res Clin Oncol, 140(11), 1807-1814.
Miwa, Y., et al. (2009). Neoplastic diseases in ferrets in Japan: a questionnaire study for 2000 to 2005. J Vet Med Sci, 71(4), 397-402.
Meuten, D.J. (ed.). (2017). Tumors in domestic animals, 5th ed. Wiley Blackwell, Ames, Iowa.
Rosai, J. (2007). Why microscopy will remain a cornerstone of surgical pathology. Lab Invest, 87(5), 403- 408.
Scheaffer, R.L., Mendenhall, W., y Ott, L. (2007). Elementos de muestreo. Madrid, 6 ed., Paraninfo Ed., España.
Williams, B.H., Garner, M.M., y Kawasaki, T.A. (1994). Peritoneal mesothelioma in two ferrets (Mustela putorius furo). J Zoo Wildl Med, 25(4), 590-594.
Recibido: 26/05/2016
Aceptado: 26/07/2017
