Desarrollo de sistemas automatizados para el monitoreo de arsénico: fraccionamiento en suelo y bioaccesibilidad in vitro en cereales
José Martín Rosas Castor*, Jorge Luis Guzmán Mar*, Ma. Aracelí Hernández Ramírez* Laura Hinojosa Reyes*
CIENCIA UANL / AÑO 20, No. 83, ENERO-MARZO 2017
Resumen
El arsénico (As) es un metaloide altamente tóxico y representa un grave problema de salud pública. En este trabajo fueron desarrollados dos sistemas automatizados para la determinación del fraccionamiento de As en suelo agrícola (MAFAs), y el As bioaccesible en arroz y maíz (MABAs). La principales ventajas de MAFAs y MABAs fueron la enorme reducción del tiempo análisis (de 50 h a 6 h) y la alta sensibilidad (LODarroz: 1.3 µg kg-1 y LODmaíz: 1.90 µg/kg-1), respectivamente. MAFAs y MABAs representan una opción rápida y económica para la determinación del As potencialmente fitodisponible y la evaluación del riesgo asociado a la ingesta de As por consumo de cereales procedentes de zonas agrícolas contaminadas.
Palabras clave: suelo agrícola, fitodisponibilidad, bioaccesibilidad, extracción en punto nube, fraccionamiento de arsénico.
Abstract
Arsenic (As) is a highly toxic metalloid and it represents a serious public health problem. In this paper, two automated systems were developed to determine the As fractionation in agricultural soil (MAFAs), and bioavailable As in rice and maize (MABAs). The main advantages of MAFAs and MABAs were, the significant reduction in the analysis time (50 h to 6 h) and the high sensitivity (LODrice: 1.3 µg kg-1 y LODcorn: 1.90 µg/kg-1), respectively. MAFAs and MABAs represent a fast and inexpensive alternative for the evaluation of As phytoavailability and the risk assessment of As intake through agricultural products from polluted agricultural areas.
Key words: agricultural soil, cereals, phytoavailability, bioaccessibility, cloud point extraction, arsenic fractionation.
El arsénico (As) es un metaloide altamente tóxico cuya exposición crónica puede derivar en lesiones en la piel, defectos neurológicos, aterosclerosis y cáncer (Watts et al., 2010). La presencia de As en agua y el suelo representa un problema grave de salud pública en diversos países como India, México, Argentina, Taiwán y Chile (ATSDR, 1989). La solubilidad del As en suelo agrícola y su lixiviación hacia mantos freáticos puede variar de un lugar a otro en función de las condiciones del suelo. Algunos parámetros fisicoquímicos del suelo, como pH, potencial redox, contenido de materia orgánica, textura y concentraciones de algunos elementos (aluminio, hierro, manganeso y fósforo) pueden afec-tar dramáticamente la solubilidad de As (Carbonell, Burló y Mataix, 1995; Rosas et al., 1999; Zheng et al., 2011). Algunos métodos utilizados para el fraccionamiento y evaluación de la solubilidad de As como el propuesto por la European Community Bureau of Reference (BCR) presentan algunas limitaciones como la imposibilidad de determinar la cinética de extracción del proceso de lixiviación del elemento evaluado, una baja frecuencia de análisis y el riesgo de un sesgo en los resultados experimentales debido a fenómenos de readsorción de As en las superficies de las partículas de suelo (Boonjob et al., 2009).
El uso en suelos agrícolas de agua de irrigación contaminados con As para la producción de cereales y otros cultivos de alto consumo puede derivar en la acumulación del metaloide en concentraciones críticas que representen un riesgo para los seres humanos (Khan et al., 2009). El maíz (Zea mays L.) y el arroz (Oryza sativa) son los cereales más cultivados en el mundo (723 y 883 millones de toneladas por año en 2011, respectivamente; FAOSTAT, 2004) y constituyen la base de la alimentación en regiones como América Latina y Asia.
La estimación del riesgo de exposición a As a través del consumo de productos agrícolas es esencial en la evaluación de la salud pública. La investigación sobre el As total en muestras de arroz y maíz puede dar lugar a una sobreestimación de los riesgos de salud relacionados con la exposición a As. Para proporcionar una estimación más precisa del riesgo, la evaluación de la bioaccesibilidad de As es crítica (Caussy, 2003).
A la fecha existe poca información sobre la cuantificación y evaluación del As bioaccesible en cereales, y al parecer son inexistentes los métodos automatizados en flujo para la evaluación de la solubilidad y fitodisponibilidad de As en suelo agrícola. Debido a lo anterior, este trabajo se enfoca en el desarrollo de dos metodo-logías que tienen como objetivo: 1) el fraccionamiento automatizado de As en suelo agrícola (MAFAs) y 2) la determinación de la bioaccesibilidad de As en cereales como arroz y maíz (MABAs). Debido a sus múltiples ventajas como una amplia robustez, capacidad de ahorro de reactivos y muestras, y versatilidad para el diseño de métodos en flujo, en este proyecto, el análisis por inyección en flujo multijeringa (MSFIA) fue seleccionado como técnica en flujo para ambos métodos. El sistema MSFIAs fue acoplado a un detector de espectrofotómetro de fluorescencia atómica con sistema de generación de hidruros (HG/AFS), el cual presenta una alta sensibilidad comparable al ICP-MS y menores cos-tes de operación.
Metodología
Muestras de arroz, maíz y suelo agrícola
Las muestras de suelo agrícola y maíz (maíz 1-6) fue-ron obtenidas de zonas agrícolas cercanas a áreas mineras en Matehuala, San Luis Potosí, México. Las zonas fueron denominadas como A y B (N 23°39´57.2”, W 100°34´35.1” y N 23°43´05.0”, W 100°39´20.5”, respectivamente). Las muestras de arroz fueron adquiridos de un mercado local (arroz 1-3).
Ensayo gastrointestinal in vitro y extracción en punto nube de arsénico
En el caso de MABAs, previo a la determinación por MSFIA-HG/AFS, el As fue extraído en las muestras de arroz y maíz mediante un ensayo gastrointestinal in vitro de tres etapas (bucal, gástrica y duodenal) secuenciales descrito por Jovani et al. (2001); el As extraído en el jugo gastrointestinal fue preconcentrado mediante la metodología de CPE. En la preconcentración CPE, un volumen de 8 ml de extracto gastrointestinal artificial fue centrifugado a 3000 min-1 durante 10 min. El sobrenadante fue acidificado con 0.85 ml de HCl 12 mol L-1 y nuevamente centrifugado. Posteriormente, 50-150 µL de la disolución de tritón 10% m v-1, y de 200-600 µL de DDTP 50% m v-1 fueron añadidos al extracto. La suspensión fue incubada a 50°C (20-40 min) y centrifugada (3000 rpm durante 10 min). Después de 10 min en un baño de hielo, fue retirado el sobrenadante por decantación y el complejo micelar fue reconstituido en 1 ml de la mezcla de HCl 1 mol L-1-metanol 10% v v-1.
Sistema automatizado
El sistema MSFIA-HG/AFS utilizado para el desarrollo de las metodologías MAFAs y MABAs se muestra en la figura 1. En el caso de MABAs, sólo se consideró la parte posterior a los tanques de homogenización. Se utilizaron dos buretas multijeringa con velocidades programables (MicroBU 2030 Crison, Barcelona), siete jeringas de vidrio S1-S7 con capacidades de 2.5, 1.0, 1.0, 5.0, 1.0, 2.5 y 2.5 ml (Hamilton, Suiza). Cada jeringa tiene una válvula solenoide en la cabeza de tres vías E1-E7 (N-Research, Caldwell, Nueva Jersey, EE.UU.), lo que facilita la aplicación de los regímenes de multiconmutación. La tubería para la toma de reactivos fue construida con tubos de PTFE de 1.5 mm de diámetro interno. La columna con la muestra de suelo fue sumergida en un baño de ultrasonidos (P-Selecta). Las mediciones fueron realizadas en un AFS (PS Analytical Millennium System, Kent UK) equipado con una lámpara de cátodo hueco de As (Photron Super lamp, Victoria, Australia) con los siguientes parámetros: corriente primaria de 27.5 mA; corriente secundaria de 35.0 mA, y una longitud de onda de 193.7 nm.
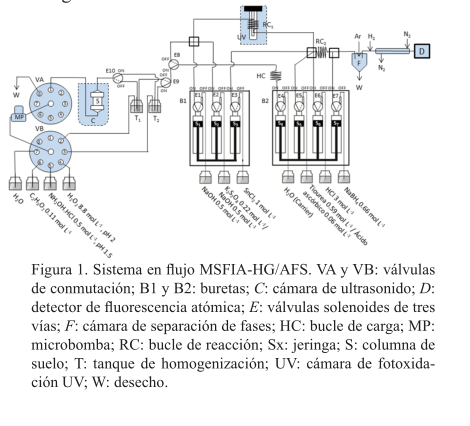
Configuración del sistema automatizado
El sistema MSFIA-HG/AFS fue adaptado para llevar a cabo de forma automática el fraccionamiento de As. Paso 1 (sólo para MAFAs). Extracción secuencial en línea: la disolución BCR en turno (F1, ácido acético 0.11 mol L-1; F2, NH2OH.HCl 0.5 mol L-1; F3, H2O2 8.8 mol L-1) fue conducida por medio de las válvulas de selección (VA y VB) e impulsada mediante la microbomba (MP) desde los contenedores a través de la columna (S) con las partículas del suelo. Un volumen de 10 ml del lixiviado del suelo fue recolectado y homogenizado (T1 o T2). Paso 2. Toma de alícuota: el volumen de 0.15-0.5 ml de muestra fue cargado dentro del HC. Paso 3. Proceso de fotoxidación: la solución fue mezclada con una disolución de un agente oxidante específico (K2S2O8 1.5% m v-1 con NaOH 0.5% m v-1 (F1), K2S2O8 5.4% m v-1 con NaOH 0.5% m v-1 (F2 y el reconstituido micelar) y NaOH 0.5% m v-1 (F3)), y transportada a la cámara de fotoxidación UV para la de-gradación de las especies orgánicas (tiempo stop flow: 2 min). Paso 4. Preparación para HG: la disolución fue prerreducida con una mezcla de tiourea-ácido ascórbico (F1, F2 y el reconstituido micelar) o NH2OH·HCl (F3) durante 1 min. El contenido de As fue posteriormente determinado por AFS para la obtención de la cinética de la extracción (MAFAs) o el contenido de As biodisponible (MABAs). En la metodología MAFAs, algunos pasos de la extracción de As fueron simultáneos para la reducción de la frecuencia de análisis: a) el drenaje del contenedor de lixiviado, b) el lavado del contenedor de lixiviado vacío con agua destilada y c) paso de extracción de As.
Análisis estadístico
Todas las muestras fueron analizadas por triplicado. Los métodos MAFAs y MABAs fueron evaluados utilizando un diseño factorial completo de dos niveles. Los valores críticos fueron obtenidos mediante el uso del diseño Doehlert. Todos los datos fueron procesados mediante el software Statistica (versión 8.0). En la optimización de CPE del método MABAs, la deseabilidad global (D) (Derringer y Suich, 1980) fue obtenida a partir de las deseabilidades individuales calculadas para arroz y maíz.
Resultados
Sistema automatizado para el fraccionamiento de As en suelo agrícola
Una cámara de fotoxidación UV fue incluida en el sistema MSFIA-HG/AFS para la degradación de las especies orgánicas (MMA y DMA) extraídas durante el método automatizado de extracción secuencial en línea. Por lo tanto, un tiempo de dos minutos dentro de la cámara UV con los reactivos oxidantes pertinentes (K2S2O8 1.5% m v-1 con NaOH 0.5% m v-1 para F1, K2S2O8 5.4% m v-1 con NaOH 0.5% m v-1 para F2 y NaOH 0.5% m v-1 para F3) fue utilizado para convertir cuantitativamente el DMA (la especie orgánica más termorresistente; Chatterjee, 1999) en As(V) por la ruptura del enlace As-grupo metilo.
El caudal del eluente fue estudiado entre 0.7 y 4.5 ml min-1. Caudales del eluente menores a 1 ml min-1 permitieron una mayor concentración de As en la primera subfracción. Dado que las velocidades de flujo entre 0.7 y 1.0 ml min-1 no mostraron diferencias significativas (p > 0.05), una velocidad de flujo del eluente de 1 ml min-1 fue seleccionado para experimentos posteriores.
Los factores potenciales que podrían afectar las eta-pas del sistema MSFIA-HG/AFS fueron estudiados por el diseño factorial completo (2k + 3 puntos centrales) y el diseño Doehlert. Utilizando las condiciones óptimas mencionadas en las secciones anteriores, los parámetros analíticos fueron determinados para cada fracción. De acuerdo con las curvas de calibración, la intensidad de la señal varió considerablemente para las diferentes fracciones (F2 > F1> F3). Los límites de detección (LOD) y de cuantificación (LOQ) (Currie, 1999) fueron calculados para F1, F2 y F3 (LOD: 4.0, 3.4 y 23.6 µg L-1; LOQ: 13.4, 11.6 y 78.8 µg L-1, respectivamente). El valor superior de LOD para F3 puede ser atribuido a la menor e¿ciencia HG debido a la prevalencia de condiciones oxidantes y al menor volumen del lixiviado utilizado (0.15 ml para F3 en lugar de 0.5 ml utilizados para F1 y F2) durante la determinación de As. La precisión de la determinación de As en cada eluente fue evaluada usando la RSD de diez inyecciones sucesivas de 200 µg L-1 de una disolución estándar de As(V) para las tres fracciones (5.6, 7.8 y 8.4% para F1, F2 y F3, respectivamente).
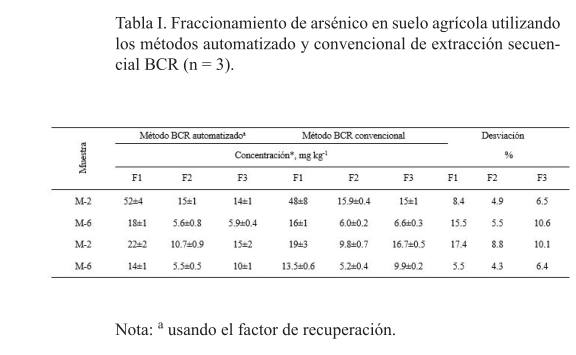
La validación del método automatizado de extracción secuencial en línea fue realizada mediante la comparación con el método BCR convencional (tabla I). En primer lugar, con el ¿n de comparar las e¿ciencias de extracción, una muestra de cada lote fue seleccionada y analizada mediante el método BCR automatizado y el BCR convencional. El contenido de As en las tres fracciones obtenidas por el método MAFAs y calculado utilizando el factor de recuperación previamente estimado no mostraron diferencias estadísticamente significativas con el método BCR (nivel de confianza del 95%).
Método propuesto para la determinación de As bioaccesible en arroz y maíz
La metodología para la cuantificación del As que es liberado bajo condiciones que simulan la digestión gastrointestinal fue basada en la determinación de As total por MSFIA-HG/AFS después de un proceso de digestión gástrica in vitro y preconcentración por CPE. La preconcentración de As por CPE se basa en la formación de un complejo hidrófobo con DDTP, que fue atrapado posteriormente en la fase micelar de un tensoactivo no iónico (tritón X-114). La etapa de CPE fue optimizada en condiciones ácidas, pH <1, mediante la adición de HCl 1 mol L-1 con de metanol 10% v v-1. Por lo tanto, los parámetros que intervienen en la preconcentración de As por CPE como las concentraciones de DDTP y de tritón X-114, así como la temperatura de equilibrio, fueron optimizados por enfoque multivariante. Estos parámetros fueron evaluados por un diseño factorial completo (Screening 2k + 3 puntos centrales) y el diseño Doehlert. El incremento en la concentración de tritón X-114 y DDTP mostraron una reducción de la señal analítica, que puede ser atribuida a las burbujas generadas durante la etapa de generación de hidruros y a la alta relación de DDTP/tritón X-114 en la solución (la fracción de DDTP que no fue capaz de atrapar cuantitativamente el complejo hidrófobo), respectivamente. El análisis de la respuesta utilizando D indicó que el punto crítico máximo fue obtenido en DDTP 0.83% m v-1 y tritón X-114 0.098% m v-1.
La recuperación de las especies As(V), As(III), DMA y MMA de los jugos gastrointestinales artificiales fue evaluada después de preconcentración por CPE. Los porcentajes de recuperación de las especies As(V), As(III), DMA y MMA indicaron que estas fueron casi cuantitativamente removidas de la solución acuosa mediante el complejo micelar (95±6%, 96±3%, 87±6% y 90±8% para el arroz y 92±3%, 101±5%, 88±7%, y el 94±13% para el maíz, respectivamente). La alta afinidad de formas inorgánicas en el complejo micelar se puede atribuir al hecho de que As(III) y As(V) (una vez reducido a As(III)) pueden formar un complejo con DDTP, aumentando así su hidrofobicidad. Las especies orgánicas (DMA y MMA) también fueron eficientemente removidas y adsorbidas por el complejo micelar. Comparado con otros estudios en los que se ha preconcentrado As en muestras de agua por CPE o ex-tracción líquido-líquido (Yan et al., 2005; Shemirania, Baghdadia y Ramezanib, 2005; Baig et al., 2009a), las recuperaciones altas de las especies orgánicas por CPE en el extracto gastrointestinal podrían ser atribuidas al mayor contenido de sales en el fluido gastrointestinal artificial, que promueve la transferencia de las especies de As orgánico a la fase micelar.
La tabla II resume los parámetros analíticos del método propuesto. Las curvas de calibración fueron preparadas por dilución de As en el jugo gastrointestinal artificial elaborado a partir de las muestras de arroz y maíz. El método mostró una buena linealidad en el intervalo de concentración de 4.6-248.0 y 6.2-248.0 µg kg-1 en arroz y maíz, respectivamente (n = 11). El efecto de la matriz fue evaluado mediante la comparación de las pendientes de las curvas de calibración con soluciones patrón preparadas en agua destilada y en los extractos del complejo micelar reconstituido. Los valores de la pendiente en el agua y en el extracto gastrointestinal de arroz no mostraron diferencias significativas (p > 0.05, valores de pendiente: 1106±95 y 1169±111, respectivamente). Por otra lado, la pendiente de la curva de calibración en el extracto de maíz fue 38% menor (pendiente: 685±73) que la pendiente obtenida a partir del agua destilada. El efecto de la matriz para la determinación As bioaccesible en el maíz se puede atribuir a la alta coextracción y preconcentración (el efecto de la matriz solamente fue apreciado después de la CPE) de la materia orgánica durante la etapa de CPE. Es conocido que el maíz contiene una mayor cantidad de proteínas y lípidos que el arroz (Nuss y Tanumihardjo, 2010). Los límites de detección (LOD) y de cuantificación (LOQ) calculados de acuerdo a lo reportado por Curie (1999) así como la repetibilidad y la reproducibilidad, expresados como desviación estándar relativa (RSD), fueron ligeramente superiores a los obtenidos para el arroz. Lo anterior puede ser atribuido a los efectos de la matriz detectados en las muestras de maíz, lo cual incrementó la incertidumbre de las mediciones. Los valores de LOD en las muestras de maíz y de arroz fueron hasta seis veces mayores que en agua, posiblemente debido al mayor contenido de materia orgánica en la matriz. Estudios previos de preconcentración de As en muestras de agua por CPE (Yan et al., 2005; Shemirania, Baghdadia y Ramezanib, 2005; Baig et al., 2010) mostraron un LOD comparable o uno 80 veces más alto (Ulusoy, Akcay y Gürkan, 2011) que el obtenido en el método propuesto para la matriz de agua. De acuerdo con el factor de enriquecimiento (EF), el uso de CPE incrementó 15.4 y 10.9 veces la concentración de As en los fluidos gastrointestinales artificiales procedentes de las muestras de arroz y maíz, respectivamente. Este EF permitió un LOD para As en el arroz y el maíz de 1.34 µg kg-1 y 1.90 µg kg-1, respectivamente. En contraste con el ex-tracto gastrointestinal de maíz (EF: 10.9), el valor de EF para el fluido gastrointestinal artificial de arroz y el obtenido a partir de la muestra de agua fueron muy similares (15.4 y 16.0, respectivamente). Este resultado puede ser asociado con el bajo efecto de las interferencias de la matriz procedentes de granos de arroz durante la etapa de preconcentración. Aunque en otros estudios de determinación de As, los EF calculados para la CPE fueron más altos que los encontrados en este estudio, el método propuesto permitió la cuantificación exacta de niveles de trazas de As bioaccesible en cereales como el arroz utilizando sólo 1 g de la muestra.
La exactitud del método para la determinación de As bioaccesible en maíz y arroz fue evaluada utilizando el material de referencia certificado ERM BC-211. El residuo sólido procedente de la etapa de extracción in vitro del material ERM BC-211 fue digerido usando las condiciones descritas en el método EPA 3052. Entonces, el As total contenido en ambas fracciones fue cuantificado por HG/AFS. El As total en ERM BC-211 fue determinado como la suma del As bioaccesible (211±48 µg kg-1) y el As total en el residuo sólido (75±11 mg kg-1). La suma de ambas fracciones (286±49 µg kg-1) no mostró una diferencia significativa (p> 0.05) con el valor certificado (260±6 µg kg-1).
Aplicación de los métodos automatizados propuestos
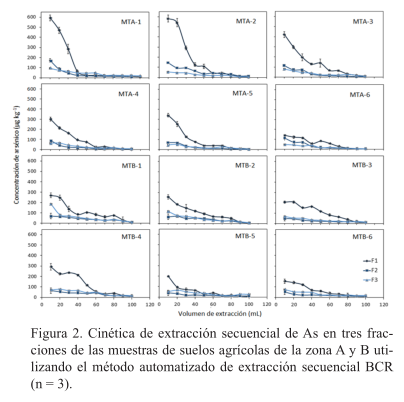
El método automatizado propuesto fue aplicado para el fraccionamiento en el suelo de dos zonas agrícolas de Matehuala, zonas A y B. La cinética de extracción secuencial de As de las 12 muestras de suelos agrícolas se muestra en la figura 2. F1 y F2 son las fracciones potencialmente biodisponible en el suelo (Baig et al., 2009b). La suma de F1 y F2 fue > 50% del contenido de As total en el suelo de ambas zonas de agrícolas (65-83% y 55-60% para las zonas A y B, respectivamente); estos valores son más altos que los reportados en los sedimentos de ríos y lagos (43-50%) (Baig et al., 2009b).
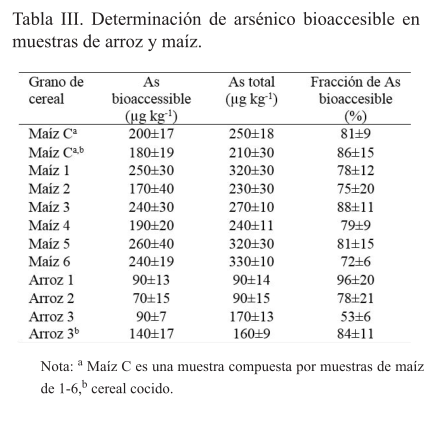
El método propuesto fue aplicado para determinar el contenido de As bioaccesible en muestras de maíz y arroz procedentes de zonas rurales y el mercado local, respectivamente (tabla III). La concentración de As total en muestras de arroz y maíz varió desde 90 hasta 170 µg As kg-1 y 210 a 330 µg As kg-1, respectivamente. Las concentraciones de As en maíz fueron incluso más altas que los reportados en otras regiones, como Mongolia, China (Neidhardt et al., 2012) e Hidalgo, México (Prieto et al., 2007) (60 y 120 µg As kg-1, respectivamente). En el estudio realizado por Marwa et al. (2012), el contenido de As total en el maíz varió de 10 a 170 µg kg-1.
Sin embargo, el contenido de As total en las muestras de arroz fue comparable a los reportados en estudios previos: 63-303 µg As kg-1 (China) (Zhu et al., 2008), 120-270 µg As kg-1 (oeste de Bengal, India) (Mondal et al., 2010). En todas las muestras, el As bioaccesible fue la fracción predominante representando más de 50% del As total (tabla III). El alto contenido de As bioaccesible en los granos es un motivo de preocupación debido a que el As extraído durante la etapa gastrointestinal in vitro está esencialmente relacionada con la cantidad de contaminante que pudiera ser absorbida y entrar en el torrente sanguíneo.
Conclusiones
Un método automatizado de extracción secuencial en flujo y detección por HG/AFS fue desarrollado para evaluar el As extraíble y potencialmente disponible para los cultivos. La principal ventaja del método propuesto es la enorme reducción en el tiempo de análisis, de 50 h (método BCR convencional) comparado con seis horas (método automatizado), por lo que es una herramienta eficaz para el análisis de un gran número de muestras en un corto tiempo. Además, permitió un conocimiento de la cinética de lixiviación del As. Por otro lado, un nuevo método para la determinación de la bioaccesibilidad de As en muestras de maíz y arroz fue desarrollado basado en 1) un ensayo de bioaccesibilidad in vitro, 2) la extracción en punto nube, y 3) el sistema MSFIA-HG/AFS. El método propuesto mostró un límite de detección bajo y rango lineal amplio. Esta metodología versátil y de bajo costo puede ser utilizada para la determinación de As a nivel de traza como una alternativa a la herramienta de análisis ICP-MS.
Universidad Autónoma de Nuevo León
Contacto: laurahinojosary@uanl.edu.mx
Referencias
ATSDR. (1989). Toxicological Pro¿le for Arsenic. ATSDR/TP-88/02. GA: Agency for Toxic Substances and Disease Registry.
Baig, J.A., et al. (2009a). Optimization of cloud point extraction and solid phase extraction methods for speciation of arsenic in natural water using multi-variate technique. Analytica Chimica Acta. 28: p. 57-63.
Baig, J.A., et al. (2009b). Arsenic fractionation in sediments of different origins using BCR sequential and single extraction methods. Journal of Hazardous Materials. 167(1-3): p. 745-751.
Baig, J.A., et al. (2010). Evaluating the accumulation of arsenic in maize (Zea mays L.) plants from its growing media by cloud point extraction. Food and Chemical Toxicology. 48(11): p. 3051-3057.
Boonjob, W., et al. (2009). Critical evaluation of novel dynamic flow-through methods for automatic sequential BCR extraction of trace metals in fly ash. Anal Bioanal Chem. 394: p. 337-349.
Carbonell Barrachina, A.A., F.M. Burló Carbonell, y J.J. Mataix Beneyto. (1995). Arsénico en el sistema suelo-planta: significado ambiental. Ed. U.d. Alicante., España: Espagrafic.
Caussy, D. (2003). Case studies of the impact of understanding bioavailability: arsenic. Ecotoxicology and Environmental Safety. 56 p. 164-173.
Chatterjee, A. (1999). Behaviour of anionic arsenic compounds in microwave system with nitric acid and hydrogen peroxide preliminary laboratory study. The Science of the Total Environment. 228: p. 25-34.
Currie, L.A. (1999). Detection and quantification limits: origins and historical overview. Analytica Chimica Acta. 391: p. 127-134.
Derringer, G. and R. Suich. (1980). Simultaneous Optimization of Several Response Variables. Journal of Quality Technology, 12: p. 214-219.
FAOSTAT. (2004). Food and Agriculture Organization of the United Nations, in b.
Jovanı, M., et al. (2001). Calcium, iron, and zinc uptake from digests of infant formulas by Caco-2 cells. Journal of Agricultural and Food Chemistry. 49: p. 3480-3485.
Khan, N.I., et al. (2009). Human arsenic exposure and risk assessment at the landscape level: a review. 31(S1): p. 143-166.
Marwa, E.M.M., A.A. Meharg, y C.M. Rice. (2012). Risk assessment of potentially toxic elements in agricultural soils and maize tissues from selected districts in Tanzania. Science of the Total Environment. 416: p. 180-186.
Mondal, D., et al. (2010). Comparison of drinking water, raw rice and cooking of rice as arsenic exposure routes in three contrasting areas of West Bengal, India. Environmental Geochemistry and Health. 32(6): p. 463-477.
Neidhardt, H., et al. (2012). Impact of irrigation with high arsenic burdened groundwater on the soil–plant system: Results from a case study in the Inner Mongolia, China. 163: p. 8-13.
Nuss, E.T. y S.A. Tanumihardjo. (2010). Maize: A Paramount Staple Crop in the Context of Global Nutrition. Comprehensive Reviews in Food Science and Food Safety. 9(4): p. 417-436.
Prieto G., F., et al. (2007). Presencia de metales pesados en cultivos del Valle del Mezquital, México. Revista Latinoamericana de Recursos Naturales. 3(2): p. 100-110.
Rosas, I., et al. (1999). Arsenic concentrations in water, soil, milk and forage in Comarca Lagunera, México. Water, Air & Soil 112(1/2): p. 133-149.
Shemirania, F., M. Baghdadia, y M. Ramezanib. (2005). Preconcentration and determination of ultra trace amounts of arsenic(III) and arsenic(V) in tap water and total arsenic in biological samples by cloud point extraction and electrothermal atomic absorption spectrometry. Talanta. 65: p. 882-887.
Ulusoy, H.I., M. Akcay, y R. Gürkan. (2011). Development of an inexpensive and sensitive method for the determination of low quantity of arsenic species in water samples by CPE–FAAS. Talanta. 85: p. 1585-1591.
Watts, M.J., et al. (2010). Field based speciation of arsenic in UK and Argentinean water samples. Environmental Geochemistry and Health. 32(6): p. 479-490.
Yan, X.H., et al. (2005). Cloud point extraction for the determination of As (III) in water samples by electrothermal atomic absorption spectrometry. Talanta. 67(5): p. 942-946.
Zheng, M.Z., et al. (2011). Spatial distribution of arsenic and temporal variation of its concentration in rice. New Phytologist. 189(1): p. 200-209.
Zhu, Y.G., et al. (2008). High percentage inorganic arsenic content of mining impacted and nonimpacted chinese rice. 42: p. 5008-5013.
RECIBIDO: 18-08-2016
ACEPTADO: 05-09-2016
