Desarrollo de un sistema celular murino para el análisis antitumoral de adenovirus oncolíticos
Elvis Marơnez Jaramillo*, Jorge G. Gómez Gutiérrez**, María de Jesús Loera*, Odila Saucedo Cárdenas*, Roberto Montes de Oca Luna*
CIENCIA UANL / AÑO 20, No. 83, ENERO-MARZO 2017
Resumen
Los adenovirus oncolíticos (AdOs) se multiplican y destruyen selectivamente células cancerosas. El modelo para evaluar su eficiencia ha sido un ratón inmunosuprimido, ya que en células de ratón se multiplican ineficientemente, por lo cual se usan células tumorales humanas donde sí son eficientes. Sin embargo, este modelo es inadecuado, no considera el efecto del sistema inmune. Los genes E6 y E7 del HPV-16 facilitan la multiplicación del adenovirus en células murinas. Las células tumorales murinas TC-1 poseen estos genes. Aquí demostramos que los AdOs se multiplican en células TC-1 y pueden ser usadas para evaluar AdOs en un modelo inmunocompetente.
Palabras clave: adenovirus oncolíticos, cáncer de pulmón,TC-1, oncólisis.
Abstract
Oncolytic adenovirus (AdOs) multiplies and selectively kills cancer cells. An immunosuppressed mouse has been the model used to assess its efficiency, since they multiply inefficiently in mouse cells, human tumor cells are used where AdOs multiply efficiently. However, this model is inadequate, since it doesn’t consider the immune system’s effect. HPV-16 E6 E7 genes help in the multiplication of adenovirus in murine cells. TC-1 Murine tumor cells possess these genes. Here we show that the AdOs multiply in TC-1 cells and can be used to evaluate AdOs in an immunocompetent model.
Key words: oncolytic adenovirus, lung cancer,TC-1, oncolysis
Los adenovirus oncolíticos (AdOs) son una modalidad de terapia génica contra el cáncer, se caracterizan por multiplicarse y destruir selectivamente células cancerosas mediante oncólisis viral. La evaluación preclínica de los AdOs se ha limitado al uso de ratones inmunosuprimidos, porque este modelo permite implantar células tumorales humanas sin problemas de rechazo. La razón por la cual se utilizan ratones inmunosuprimidos es que los AdOs se replican de manera ineficiente en células tumorales de ratón en comparación con células tumorales humanas. A pesar de lo anterior, se han hecho importantes progresos en el desarrollo de virus oncolíticos que pueden replicarse en células murinas (células de ratón) (Eggerding y Pierce, 1986; Ginsberg et al. 1991; Silverstein y Strohl, 1986). Por ejemplo, un adenovirus murino oncolítico fue desarrollado con alto nivel de citotoxicidad en amplia variedad de células murinas tumorales (Robinson et al., 2009).
El problema con el uso de ratones inmunosuprimidos es que no representan un modelo adecuado para evaluar la eficacia terapéutica de los AdOs en ensayos preclínicos. Esto debido a que, en este modelo, no se toma en cuenta la participación de la respuesta del sistema inmune en la distribución del virus y los efectos colaterales. Por lo tanto, es urgente desarrollar un modelo inmunocompetente en el que los AdOs se puedan dividir e inducir oncólisis, y de esta forma evaluar el impacto del sistema inmune en la eficiencia terapéutica de los AdOs y los efectos secundarios de esta terapia.
Los AdOs con deleciones del gen E1 podrían dividirse selectivamente en células tumorales que expresan los genes E7 del HPV-16. El marco abierto de lectura (ORF) de E7 del HPV-16 codifica funciones para transactivación transcripcional y transformación celular que es análoga a las de las proteínas E1 del adenovirus. La proteína E7 ha mostrado transactivar el promotor E2 del adenovirus y cooperar con la activación del oncogén ras para la transformación de células de riñón de cachorro de ratón primarias (Phelps et al., 1988). Se ha demostrado previamente que células que expresan E6 y E7 del HPV facilitan la replicación de DNA de vectores adenovirales con deleción de E1A y E1B (Steinwaerder, Carlson y Lieber, 2000; 2001).
En el presente trabajo evaluamos la capacidad de un adenovirus oncolítico de multiplicarse en células murinas de cáncer de pulmón TC-1 que expresa los genes E6 y E7 del HPV-16.
Metodología
Líneas celulares
Las células HeLa provienen de cáncer cervical humano, fueron usadas como control positivo para la replicación de los virus; las células TC-1 son células cáncer de pulmón de ratón C57BL6 que poseen los genes E6 y E7 del HPV, y las células Lewis Lung Carcinoma (LLC-1), usadas como control negativo, provienen de cáncer de pulmón sin expresión de los genes E6 y E7 del HPV-16. Las células HeLa, TC-1 y HEK-293 se obtuvieron en ATCC (Rockville, MD). Las células HeLa y TC-1 fueron cultivadas en medio RPMI-1640 suplementado con suero bovino fetal inactivado (FBS) y penicilina/estreptomicina (100 U/ml); las líneas HEK-293 y LLC-1 con medio DMEM. Los medios de cultivo fueron obtenidos por VWR (Mediatech). Las células se incubaron en CO2 5% a 37ºC; el medio se cambió cada 2-3 días.
Evaluación de morfología celular
Se sembraron 5X105 células/pozo en una caja de seis pozos las líneas HeLa, TC-1, LLC-1. Se incubaron en CO2, 5% a 37ºC por 24 h. Se infectaron con el Adhz60 con una multiplicidad de infección (MOI) de 10 y se evaluaron los cambios en la morfología a las 0, 24, 48 y 72 h con el microscopio de luz (Olympus Microsystems, Redwood City, CA).
Tinción con cristal violeta
Se sembraron 5×104 células/pozo en cajas de 24 pozos las líneas HeLa, TC-1 y LLC-1. Al día siguiente se infectaron con los adenovirus Adwt, Adhz60, Adhz63 y AdLacZ con MOI de 1, 2.5, 5 y 10. Se incubaron en CO2, 5% a 37ºC. Después de 72 h se retiró el medio y células flotantes, las células adheridas se fijaron con 300 μL de formaldehído a 3.7% por tres minutos a temperatura ambiente. Se eliminó el fijador usando vacío y se incubó con 300 μL de cristal violeta a 1%. Se retiró el cristal violeta usando vacío y se agregaron 500 μL de PBS (Mg+ y Ca+), se retiró y dejó secar. La caja se digitalizó usando el HP Scanjet 4070.
Ensayo de viabilidad celular con MTT
Se sembraron 5×104 células/pozo en cajas de 12 pozos las líneas HeLa, TC-1 y LLC-1. Se incubaron con CO2, 5% por 24 h. Se infectaron con Adwt, Adhz60, Adhz63 y AdLacZ con un MOI de 1, 2.5, 5 y 10. Se incuba-ron con CO2 5% a 37ºC por 72 h. Se repitió el mismo procedimiento para células sin infectar. Se agregaron 100 μL de MTT en cada pozo a 37ºC y se incubó por 4hrs. Se agregaron 50 μl de Buffer de lisis (10% SDS en 0.01N HCl) y se dejó a 37˚C toda la noche. Se evaluó la proliferación celular midiendo la conversión de sales de tretazolio a formazán, de acuerdo a instrucciones del proveedor (Boehringer Mannheim, Indianapolis, IN) como se reportó previamente (Gómez Gutiérrez et al., 2010). Se leyó a 570 nm en el espectrofotómetro como porcentaje de células vivas.
Detección de proteína e1a
Se sembraron 5×105 células/pozo en cajas de seis pozos las líneas HeLa, TC-1 y LLC-1. Se incubaron en CO2, 5% por 24 h. Se infectaron con el Adhz60 a un MOI de 10. Se incubaron con CO2, 5% a 37ºC y se realizaron extractos de proteínas utilizando Buffer RIPA a las 0, 24, 48 y 72 h. Se cuantificaron las proteínas con el kit BCA Protein Assay (Pierce, Rockford, IL), se cargaron cantidades iguales de proteínas por carril en un SDS-PAGE a 10%, luego se trans¿rieron a una membrana de PVDP (Amersham, Arlington Heights, IL). Se usó anticuerpo de ratón anti-E1A Adenovirus tipo 5 (BD Pharmingen, San Diego, CA), anticuerpo de conejo policlonal anti-a-actin humana (Sigma-Aldrich, St. Louis, MO). Después la membrana se incubó con inmunoglobulina antirratón o anticonejo. Los reactivos de electroquimioluminiscencia se usaron de acuerdo al manual del proveedor (GE Healthcare Bio-Sciences, Pittsburgh, PA).
Inmunocitoquímica para hexón
Se siguieron las instrucciones del manual del kit Ade-noX Rapid Titer Kit (Clontech, Mountain View, CA). Fueron sembradas 5×104 células de las líneas celulares HeLa, TC-1 y LLC-1 en una caja de 24 pozos, al siguiente día fueron infectadas con el Adhz60 y AdLacZ con un MOI de 10, se incubaron a 37ºC con CO2, 5% por 48 h. Cada pozo con células fue fijado con 0.5 ml de metanol 100% frío por 10 min a -20ºC. Se retiró el me-tanol y se lavó tres veces con 0.5 ml de buffer de lavado (solución salina amortiguada por fosfatos (PBS) con albúmina de suero bovino (BSA) a 1%). Se agregaron 0.25 ml a cada pozo de anticuerpo antihexón 1:1000 en buffer de lavado. Se incubó 1 h a 37ºC. Se aspiró el anticuerpo y se lavó tres veces con 0.5 ml de buffer de la-vado. Se agregaron 0.25 ml a cada pozo de anticuerpo antirratón de conejo conjugado a peroxidasa de rábano (HRP) diluido 1:500 en buffer de lavado. Se incubó 1 h a 37ºC. Se aspiró el anticuerpo secundario y se lavó tres veces con 0.5 ml de buffer de lavado. Se agregaron 0.25 ml de diaminobencidina (DAB) e incubó 10 min a temperatura ambiente. Se aspiró el DAB y se agregaron 0.5 ml de PBS en cada pozo.
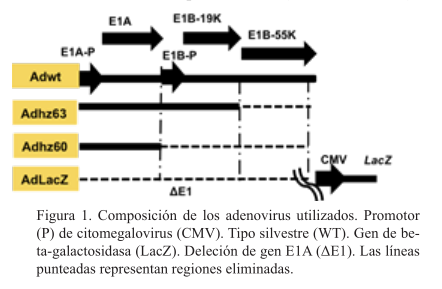
El ADHZ60 induce efecto citopático similar en células HeLa Y TC-1
El Adhz60 indujo a las 72 h efecto citopático (CPE) evidente en células TC-1 (que poseen los genes E6 y E7 del HPV-16) y las células HeLa. Las células pierden la adherencia a la superficie, adquieren una forma más redonda, llegando a fusionarse con otras células. Las células LLC-1 presentan un CPE muy disminuido. En las líneas celulares HeLa y TC-1, la cantidad de células a lo largo del tiempo se observó disminuida mientras que en la línea celular LLC-1 no se observó disminución importante (figura 2).
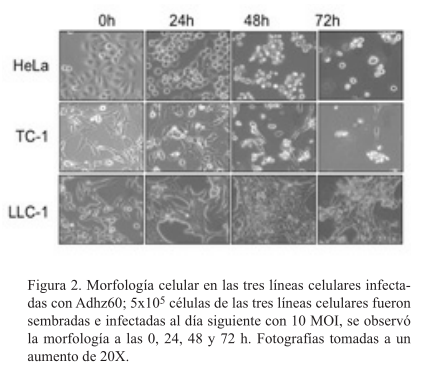
Las células TC-1 son lisadas por los ADHZ60, ADHZ63 y ADHZWT
La línea celular HeLa fue la más lisada por Adhz60, Adhz63 y Adwt, efecto no presentado con AdLacZ. En la línea LLC-1 se observó en general muy poca lisis incluso a MOI de 10 para todos los adenovirus. La línea TC-1 sí mostró un grado importante de lisis a un MOI de 10 para los adenovirus Adhz60, Adhz63 y Adwt (figura 3).
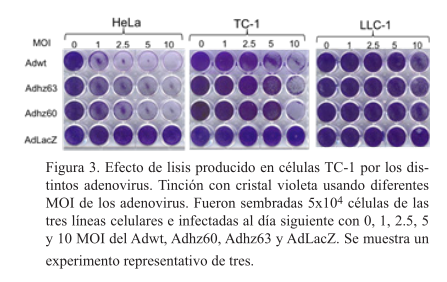
El adenovirus con deleción total o parcial para e1b disminuyen la viabilidad de las células TC-1
Los efectos observados a 10 MOI fueron los siguientes: el adenovirus Adwt disminuyó significativamente la sobrevivencia en células HeLa (4.25%), las células TC-1 fueron afectadas de forma importante (20%) mientras que las LLC-1 no disminuyeron en forma significativa su sobrevivencia (52%). El Adhz60 disminuyó la viabilidad de las células TC-1 a 28.56%, en las células HeLA 19.34% y las LLC-1 a 80%. El adenovirus Adhz63 disminuyó la viabilidad de las células TC-1 a 35%, en las células HeLA 31% y las LLC-1 a 68%. El AdLacZ no afectó la sobrevida en ninguna línea celular (figura 4).
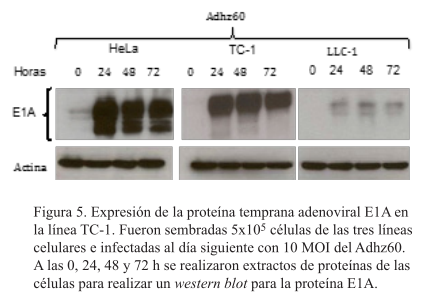
Las células TC-1 infectadas por ADHZ60 producen la proteína temprana E1A
La proteína adenoviral E1A fue expresada altamente en la línea celular HeLa. Las células LLC-1 expresaron escasamente la proteína E1A, mientras que la línea TC-1 presentó buena expresión de la proteína (figura 5).
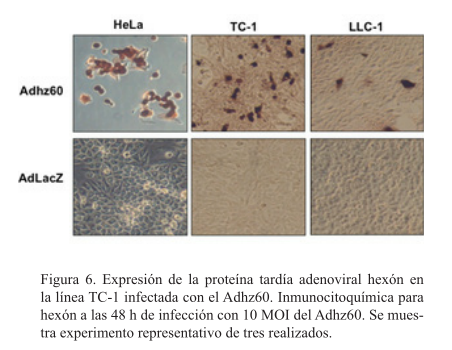
Las células TC-1 infectadas por ADHZ60 producen la proteína tardía hexón
La línea celular HeLa infectada con Adhz60 mostró positividad para todas las células, la línea LCC-1 mostró muy poca positividad mientras que en la línea TC-1 se observó mayor positividad que en la línea LLC-1. Las tres líneas infectadas con el AdLacZ no mostraron positividad para la proteína (figura 6).
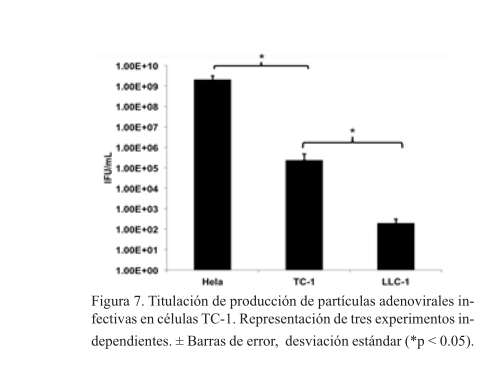
La línea celular TC-1 favorece la producción de partículas virales infectivas
La línea celular HeLa produjo 1×109 ifu/ml, TC-1 1×105 ifu/ml y la línea LLC-1 1×102 ifu/ml (figura 7).
Discusión
Se ha reportado que células tumorales que expresan E6 o E7 del HPV favorecen la multiplicación del DNA de adenovirus con deleción de E1A y E1B (Steinwaerder, Carlson y Lieber, 2000; 2001). Además, el marco abierto de lectura (ORF) de E7 del HPV codi¿ca funciones de transactivación transcripcional y transformación celular análogas a las de las proteínas E1 adenovirales.
El propósito de este estudio fue determinar si las células de ratón con cáncer de pulmón TC-1 podrían favorecer la multiplicación de AdOs con deleción parcial o completa del gen E1B. Encontramos que el Adhz60 (que posee deleción de E1B/55K) fue capaz de inducir niveles similares de CPE e inhibición de la viabilidad celular en células HeLA y TC-1 en un MOI de 10 (20 y 28% de viabilidad celular respectivamente) (figuras 5-7).
Previamente, un vector del virus vaccina que expresa interferón beta (IFNβ) fue evaluado en células TC-1. El estudio encontró que a infección con el virus a 1 MOI resultó en 40% de células viables. La eficiencia de la destrucción de las células tumorales pudo ser causado por dos mecanismos simultáneos: la multiplicación y expresión de IFNβ. Por lo tanto, es difícil de-terminar el rol de la multiplicación de los AdOs en estas condiciones experimentales (Wang et al., 2012). Sin embargo, otros estudios reportaron que un adenovirus que posee E1A mostró ligeramente mayor citotoxicidad cuando infectaba células TC-1 a un MOI de 100 que un adenovirus que expresa proteínas de choque de calor sgp96 o mgp96 (Di Paolo et al., 2006). Estos resultados contrastantes hacen difícil determinar la eficacia real de la multiplicación de AdOs en células TC-1. En nuestro estudio, Adhz60 (que posee deleción de E1B/55K) a un MOI de 10 indujo niveles similares de CPE y citotoxicidad en células HeLa y TC-1. Y a diferencia de los dos estudios previos mencionados arriba, nuestra construcción no expresa un gen terapéutico.
En otro estudio, nueve líneas tumorales murinas fueron examinadas para la captura del adenovirus (Ad5), expresión génica, multiplicación y efectos citopáticos. En siete de estas líneas celulares murinas, la infectividad y CPE producidos fueron similares a los mostrados en las líneas tumorales humanas (Hallden et al., 2003). Sin embargo, la aplicación del Ad5 en ensayos clínicos podría ser considerada controversial debido a que Ad5 también puede multiplicarse en células normales.
Algunas publicaciones han reportado resultados contradictorios en cuanto a la capacidad de los AdOs para multiplicarse en células murinas. Por ejemplo, en-sayos in vitro de síntesis de DNA viral en fibroblastos de rata y ratón revelaron expresión de hexón, pero no de ¿bra (Eggerding y Pierce, 1986; Silverstein y Strohl, 1986). En contraste, la expresión de hexón y ¿bra fue-ron detectadas en algunos tumores de células murinas (Hallden et al., 2003). Estos reportes y nuestro estudio indican que la capacidad de los AdOs para multiplicarse en células murinas podría ser especifica de tejido.
Conclusiones
La línea celular murina TC-1 es semipermisiva para la multiplicación del adenovirus oncolítico. Esta línea puede ser usada en un modelo murino inmunocompetente para evaluar adenovirus oncolíticos.
*Universidad Autónoma de Nuevo León.
**Universidad de Louisville.
Contacto:elvismtzj@gmail.com
Referencias
Di Paolo, N.C., et al. (2006). Effect of adenovirus-mediated heat shock protein expression and oncolysis in combination with low-dose cyclophosphamide treatment on antitumor immune responses. Cancer research, 66, 960-969.
Eggerding, F.A., y Pierce, W.C. (1986). Molecular biology of adenovirus type 2 semipermissive infections. I. Viral growth and expression of viral replicative functions during restricted adenovirus infection. Virology, 148, 97-113.
Ginsberg, H.S., et al. (1991). A mouse model for investigating the molecular pathogenesis of adenovirus pneumonia. Proceedings of the National Academy of Sciences of the United States of America, 88, 1651-1655.
Gómez Gutiérrez, J.G., et al. (2010). Developing adenoviral vectors encoding therapeutic genes toxic to host cells: comparing binary and single-inducible vectors expressing truncated E2F-1. Virology, 397, 337-345.
Hallden, G., et al. (2003). Novel immunocompetent murine tumor models for the assessment of replication-competent oncolytic adenovirus efficacy. Molecular therapy: the journal of the American Society of Gene Therapy, 8, 412-424.
Rao, X.M., et al. (2004). E1A-induced apoptosis does not prevent replication of adenoviruses with deletion of E1b in majority of infected cancer cells. Cancer gene therapy, 11, 585-593.
Robinson, M., et al. (2009). Novel immunocompetent murine tumor model for evaluation of conditionally replication-competent (oncolytic) murine adenoviral vectors. Journal of virology, 83, 3450-3462.
Sandig, V., et al. (2000). Optimization of the helper-dependent adenovirus system for production and potency in vivo. Proceedings of the National Academy of Sciences, 97, 1002-1007.
Silverstein, G. y Strohl, W.A. (1986). Restricted replication of adenovirus type 2 in mouse Balb/3T3 cells. Archives of virology, 87, 241-264.
Steinwaerder, D.S., Carlson, C.A. & Lieber, A. (2000). DNA replication of first-generation adenovirus vectors in tumor cells. Human gene therapy, 11, 1933-1948.
Steinwaerder, D.S., Carlson, C.A. y Lieber, A. (2001). Human papilloma virus E6 and E7 proteins support DNA replication of adenoviruses deleted for the E1A and E1B genes. Molecular therapy: the journal of the American Society of Gene Therapy, 4, 211-216.
Wang, L.C., et al. (2012). Treating tumors with a vaccinia virus expressing IFNbeta illustrates the complex relationships between oncolytic ability and immunogenicity. Molecular therapy: the journal of the American Society of Gene Therapy, 20, 736-748.
RECIBIDO: 18-08-2016
ACEPTADO: 05-09-2016
