Nanovectores superparamagnéticos y su uso potencial en quimioterapias selectivas
Carlos Luna Criado*, Raquel Mendoza Reséndez* y Alberto Gómez Treviño*
CIENCIA UANL / AÑO 20, No. 83, ENERO-MARZO 2017
Resumen
Las principales limitaciones de las quimioterapias en el tratamiento del cáncer están relacionadas con su baja biodisponibilidad, per¿les fármaco-cinéticos desfavorables y una citotoxicidad poco selectiva. El acarreamiento sitio-dirigi-do de fármacos empleando vectores superparamagnéticos guiados con campos magnéticos podría resolver estas limitaciones. En la presente investigación se estudió la localización y subsiguiente diseminación de nanoformulaciones superparamagnéticas Fe3O4/Paclitaxel frente a líneas celulares neoplásicas cultivadas en uno o dos niveles bajo la acción de un campo magnético. Los resultados mostraron que se puede reducir significativamente la viabilidad de células cancerosas con concentraciones muy bajas de paclitaxel mediante su acarreamiento controlado usando nanovecto-res superparamagnéticos. Además, se encontró que una vez localizadas estas nanoformulaciones en la región diana, la aplicación discontinua del campo magnético promueve su diseminación controlada entre líneas celulares, factor esencial para obtener una difusión intratumoral y una quimioterapia efectiva.
Palabras clave: superparamagnetismo, nanopartículas, cáncer, quimioterapia, paclitaxel
Abstract
The main limitations of cancer chemotherapies are due to their low bioavailability, unfavorable pharmacokinetic profiles and poor selectivity. These limitations could be solved through magnetic vectoring of drugs using superparamagnetic platforms. In the present investigation, the localization and subsequent dissemination of superparamagnetic Fe3O4/Paclitaxel nanoformulations on neoplastic cell lines grown at one or two levels were studied under the effects of a magnetic field. The results showed that ultralow concentrations of paclitaxel significantly reduce the viability of neoplastic cells when they are delivered with control using superparamagnetic vectors. Moreover, it was shown that after the localization of the nanoparticles in the targeted region, a discontinuous application of the magnetic field promotes controlled dissemination of the nanoparticles between cellular layers. This is a crucial factor to obtain intratumoral diffusion and an effective chemotherapy.
Keywords: superparamagnetism, nanoparticles, cancer, chemotherapy, paclitaxel.
Uno de los principales problemas de salud es el conjunto de enfermedades relacionadas con la división des-controlada de células del cuerpo, conocido como cáncer. Las células cancerosas forman tumores que si no son tratados eficazmente pueden dañar tejidos, afectar a funciones vitales y causar la muerte. A veces estas células se separan de los tumores mediante el proceso denominado metástasis y se diseminan mediante el torrente sanguíneo o por el sistema linfático, pudiendo formar nuevos tumores en otras partes del cuerpo.
En la actualidad, el cáncer sigue siendo una de las principales causas de muerte a nivel mundial, a pesar de los grandes esfuerzos invertidos en investigación durante más de seis décadas buscando entender las causas que lo originan y mejorar su detección y tratamiento (American Cancer Society, 2013). Este último consiste usualmente en quimioterapias combinadas con radioterapia y cirugía, y su eficacia está limitada principalmente por la pobre solubilidad de los fármacos antineoplásicos en soluciones acuosas, por lo que el sistema fagocítico mononuclear (SFM) y la filtración renal los eliminan rápidamente del sistema circulatorio, dando lugar a perfiles fármaco-cinéticos desfavorables, pobres distribuciones de los fármacos en los tejidos enfermos y una baja biodisponibilidad (Lammers et al., 2012; Patravale y Kulkarni, 2004). Por otra parte, la citotoxicidad de estos agentes químicos es poco selectiva y su aplicación indiscriminada tanto en tejidos sanos como enfermos provoca efectos secundarios devastadores que pueden ser severos y crónicos.
Con la finalidad de solventar estas limitaciones, se han propuesto nuevas formulaciones de agentes antineoplásicos y vectores moleculares para lograr quimioterapias guiadas a sitios específicos sin causar daños en los tejidos sanos colindantes, intentando llevar a la práctica el concepto de “bala mágica” introducido por Paul Ehrlich hace más de un siglo (Strebhardt y Ullrich, 2008).
El suministro de estas formulaciones en la región diana es favorecido por una guía pasiva debido al efec-to de retención y permeabilidad enaltecida (EPR por sus siglas en inglés), que consiste en la acumulación preferencial de los complejos nanométricos en los tejidos tumorales, ya que éstos generan una mayor densidad de vasos sanguíneos en comparación con los tejidos sanos (Iyer et al., 2006). Para lograr, además, una quimioterapia dirigida activamente hacia la región diana, el vector molecular debe presentar propiedades fisicoquímicas muy sensibles a los cambios de su entorno que permitan diferenciar los tejidos enfermos de los sanos. Algunos tejidos patológicos presentan temperaturas ligeramente diferentes al resto del cuerpo, de modo que se pueden emplear moléculas termosensibles y estímulos externos, como la radiación de ultrasonidos focalizada, que favorezcan la diferencia de temperatura de los tejidos diana (Dromi et al., 2007). También se encuentra en estudio el uso de micelas poliméricas sensibles a cambios de pH para producir un acarreamiento de fármacos selectivo en tejidos que presenten acidosis (Lee, Na y Bae, 2005), o bien, anticuerpos, proteínas, hormonas, moléculas cargadas, ácido fólico, mono-, oligo- y polisacaridos buscando un reconocimiento molecular mediante interacciones de tipo ligando-receptor (Torchilin, 2010).
La mayor dificultad encontrada en la guía activa de fármacos es que las diferencias entre los tejidos cancerosos y los sanos son muy sutiles, por lo que los resultados obtenidos no han sido contundentes. Esto ha llevado a cambiar la estrategia de una autoguía del complejo fármaco/vector por una guía teledirigida con campos excitadores. Al respecto, el uso de nanopartículas coloidales superparamagnéticas es muy prometedor (Sun, Lee y Zhang, 2008; Wahajuddin, 2012).
Estas partículas de materiales ferromagnéticos o ferrimagnéticos tienen dimensiones más pequeñas que el ancho de una pared de dominio magnético, por lo que presentan un único dominio en contraposición con la estructura multidominio de sus análogos en bulto. Las propiedades de anisotropía del material tienden a alinear su magnetización en una de las dos orientaciones definidas a lo largo de alguna dirección preferencial. De acuerdo con el modelo de Stoner-Wohlfarth (Stoner y Wohlfarth, 1948), estos dos estados de equilibrio equivalentes están separados por una barrera de energía, ∆E, proporcional al volumen V de la nanopartícula. El superparamagnetismo surge cuando V es lo suficientemente pequeño como para que la energía térmica, ET, que es proporcional a la temperatura T, sea mayor que ∆E. En estas condiciones y en ausencia de un campo magnético, la imanación de la partícula se invierte espontánea y repetidamente entre las dos orientaciones estables, y su coercitividad y remanencia se hacen nulas. Dado que este comportamiento es muy similar al paramagnetismo, Bean (Bean y Livingston, 1959) lo denominó “superparamagnetismo” y se puede describir con la teoría del paramagnetismo de Langevin (Mornet et al., 2004). No obstante, el momento magnético que Àuctúa por la agitación térmica no es el de cada átomo individual, como en el caso de los materiales paramagnéticos, sino que es el de toda la partícula, el cual es del orden de 102-105 magnetones de Bohr. En consecuencia, la susceptibilidad magnética resultante es mucho mayor que la asociada al paramagnetismo.
Dado que en ausencia de campos magnéticos la orientación de su magnetización no es estable, estas nanopartículas no se agregan debido a sus interacciones magnéticas y es fácil dispersarlas en una solución coloidal. Además, como exhiben tamaños mil veces más pequeños que el de un leucocito, exhiben una gran resistencia a la actividad del SFM, pudiendo circular por el torrente sanguíneo durante largos periodos de tiempo. Estas propiedades junto a su alta direccionalidad ante la presencia de un campo magnético convierten las nanopartículas superparamagnéticas en excelentes vectores de transporte para el acarreamiento de fármacos controlado por campos magnéticos (Sun, Lee y Zhang, 2008).
Por otra parte, estas nanopartículas pueden desempeñar otras funciones de interés médico. Por ejemplo, son excelentes agentes de contraste de resonancia magnética nuclear (Mornet et al., 2004), siendo varios de los agentes de contraste comerciales nanopartículas superparamagnéticas de óxido de hierro (SPION por sus siglas en inglés), las cuales son biocompatibles y eficaces en el diagnóstico de metástasis clínicamente oculta en los ganglios linfáticos (Lübbe et al., 1996). Asimismo, los SPION pueden irradiar calor bajo la excitación de un campo magnético alterno de altas frecuencias, por lo que pueden emplearse en tratamientos localizados de hipertermia (Asin, et al., 2012).
Las estrategias de formulación de fármacos con SPION han arrojado resultados prometedores. Fármacos poco solubles en agua se han incorporado exitosamente a nanopartículas de magnetita (Jain et al., 2008) y ensayos in vivo han probado su localización aplicando campos magnéticos, incluso después de superar la barrera hematoencefálica aumentando decenas de veces la biodisponibilidad del fármaco en tumores cerebrales (Chertok, David y Yang, 2010). No obstante, los resultados en ensayos clínicos no han sido suficientemente contundentes como para alcanzar su aprobación reglamentaria (Sun, Lee y Zhang, 2008), encontrando una pobre penetración y difusión del fármaco dentro de los tumores (Sun, Lee y Zhang, 2008; Lübbe et al., 1996; Lübbe, Alexiou y Bergemann, 2001). Por esto es necesario establecer condiciones que conduzcan a una difusión intratumoral efectiva.
En la presente investigación se han sintetizado y caracterizado formulaciones SPION/fármaco, y se ha evaluado la eficacia de penetración y difusión de estas nanoformulaciones a través de varias líneas celulares bajo diferentes configuraciones experimentales.
Metodología
Formulación SPION/fármaco
En la presente investigación se sintetizaron nanopartículas superparamagnéticas de magnetita (Fe3O4) funcionalizadas con paclitaxel; un fármaco antimicrotubular hidrófobo empleado ampliamente en el tratamiento de diversos tipos de cáncer. Dado que este fármaco no presenta afinidad con la superficie de la magnetita, se empleó ácido oleico en su anclaje con las nanopartículas, ya que sus moléculas presentan una cabeza hidrófila afín a la magnetita y una cola hidrófoba afín al paclitaxel. El complejo hidrófobo resultante se estabilizó en agua mediante la adhesión de Pluronic® F-127, que es un copolímero tribloque con dos bloques hidrófilos en los extremos y uno hidrófobo en el centro. La figura 1 muestra un esquema representativo de la estructura resultante.
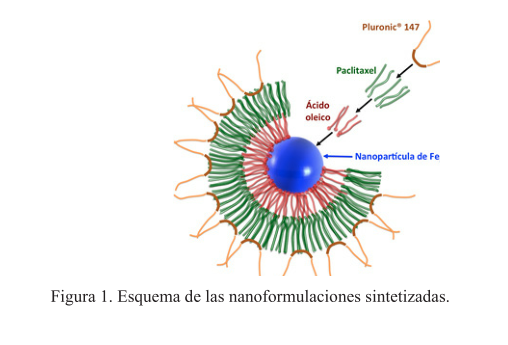
En una síntesis típica se disolvieron 6.2 mmol de cloruro férrico anhídrido y 3.0 mmol de cloruro ferroso tetrahidratado en 12 ml de agua destilada a 80°C bajo agitación mecánica durante diez minutos. Después, se añadieron 9.5 mmol de ácido oleico con agitación vigorosa durante cinco minutos. A continuación se añadieron 4 ml de una solución de hidróxido de amonio (14 M) a la solución de reacción a 80°C para producir partículas de magnetita. Después de cinco minutos en agitación, se añadieron 5.85 µmol de paclitaxel, y transcurridos diez minutos más se agregaron 2 g de Pluronic® F-127 y 5 ml de agua calentada a 80ºC. Las nanopartículas resultantes se separaron de la solución mediante centrifugación y se purificaron con agua, etanol y centrifugación. El sobrenadante se desechó y el sólido negro precipitado se volvió a dispersar en agua en presencia de Pluronic® F-127 (1%) mediante sonicación. Este proceso de purificación se repitió al menos tres veces. Finalmente, la muestra se filtró con una membrana Millipore de 0.2 µm. El contenido de paclitaxel en las nanoformulaciones se determinó mediante espectroscopia UV-Visible usando un espectrofotómetro Thermo scientific Evolution 60S UV-Vis. El ferrofluido resultante se almacenó en atmósfera de N2 y se denominó muestra A. Estas síntesis se repitieron sin la adicción de paclitaxel para tener muestras sin portar fármacos confines comparativos, la cuales se llamaron muestra B.
Caracterización de las muestras
Se empleó un microscopio electrónico FEI-TITAN 80-300 kV operado a un voltaje de 300 kV para obtener imágenes de microscopía electrónica de transmisión (MET) y patrones de difracción de electrones. También se realizaron estudios estructurales mediante difracción de rayos X (DRX) con un difractómetro Em-pyrean diffractometer (PANalytical) y radiación Cu Ka (![]() =1.5418 Å). Las caracterizaciones de espectroscopia de infrarrojos por transformada de Fourier (IRTF) se hicieron con un espectrómetro IRTF Nicolet IS10 y los estudios magnéticos con un magnetómetro de muestra vibrante MPMS-7 T de la compañía Quantum Design.
=1.5418 Å). Las caracterizaciones de espectroscopia de infrarrojos por transformada de Fourier (IRTF) se hicieron con un espectrómetro IRTF Nicolet IS10 y los estudios magnéticos con un magnetómetro de muestra vibrante MPMS-7 T de la compañía Quantum Design.
Ensayos biológicos
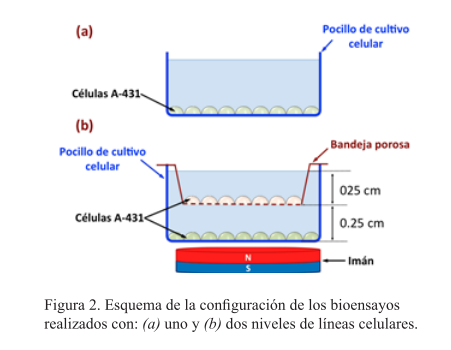
Se estudió la actividad antiproliferativa de las nanoformulaciones y su posible localización y difusión a través de varias líneas celulares de carcinoma humano A-431 (ATCC-1555) bajo diferentes configuraciones experimentales, empleando placas de cultivo con 24 pocillos y 500 μl de medio de cultivo Eagle modificado/medio Eagle modificado de Dulbecco (MEM/DMEM) durante tiempos de incubación de 24, 48 y 72 horas a 37°C. Se dispersaron en cada pocillo diferentes cantidades de nanopartículas, dejando las células de uno de ellos sin tratar para ser utilizado como cultivo de referencia. La viabilidad celular se determinó mediante la prueba de rojo neutro. Estos ensayos se realizaron por triplicado empleando líneas celulares distribuidas en uno (figura 2a) o dos niveles (figura 2b). En el caso último, una línea celular se cultivó en el fondo de los pocillos y otra en bandejas colocadas sobre los pocillos cuya porosidad (con un tamaño de poro de alrededor de 1 mm) permitió el intercambio de nutrientes y la difusión de las nanopartículas entre los dos niveles de cultivo. En algunos experimentos se ubicaron imanes redondos de neodimio de 3,800 Gauss en la parte inferior de los pocillos para evaluar el potencial de un acarreamiento de paclitaxel controlado magnéticamente.
Resultados y discusión
La figura 3a muestra una imagen MET representativa de la muestra A en la que se pueden distinguir claramente puntos oscuros correspondientes solamente a la proyección bidimensional del núcleo inorgánico de las nanoestructuras, dado que las moléculas surfactantes tienen muy baja absorción de electrones. Estos núcleos aparecen dispersos en la rejilla MET, lo que confirma su funcionalización con ligandos. La figura 3b muestra una imagen MET de alta resolución en campo oscuro donde se observan franjas correspondientes a planos cristalográficos de la magnetita. Los patrones de difracción de electrones (figura 3c) y de rayos X (figura 3d) también fueron consistentes con la presencia de una única fase cristalina de Fe3O4 (JCPDS 19-0629). El tamaño de cristal estimado a través de la fórmula de Scherrer y el pico (311) del patrón de DRX fue 8±1 nm, mismo valor dentro del margen de error que el tamaño promedio de los núcleos de magnetita obtenidos por MET (6±2 nm). Las caracterizaciones de la muestra B (datos no mostrados) presentaron resultados similares, indicando que el proceso de adición del paclitaxel no incluyó en el tamaño, morfología y propiedades estructurales de los SPION.
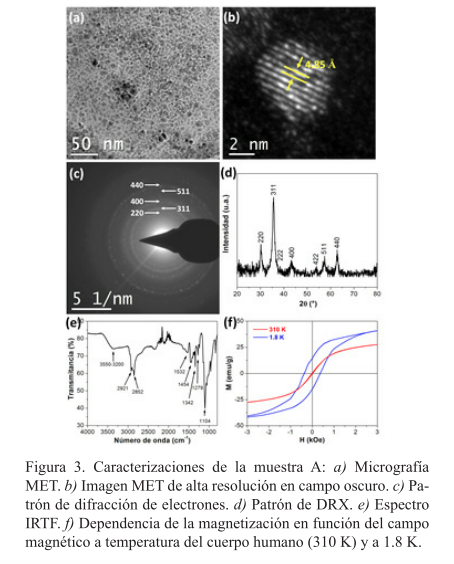
La figura 3e muestra el espectro IRTF de la muestra A, el cual no presentó diferencias significativas con el espectro de la muestra B puesto que no se observaron bandas típicas de paclitaxel, debido a la pequeña cantidad del fármaco empleada y a que sus moléculas están con¿nadas entre las capas de ácido oleico y Pluronic® F-127. En ambos espectros se observaron bandas representativas de ácido oleico (3550-3200, 2921 y 2852 cm-1) (Du, Wu y Wu, 2012); sin embargo, no se detectó la banda asociada a la vibración de estiramiento C=O del grupo carboxilo, indicando una coordinación bidentada con la magnetita (De Berti et al., 2013). De acuerdo con esta hipótesis, aparecieron bandas adicionales a 1532 y 1636 cm-1 asociadas a las vibraciones asimétricas Vas de COO-. Las bandas observadas a 1454, 1342, 1279, 1104, 962 y 842 cm-1 son atribuidas al Pluronic® F-127 (Du, Wu y Wu, 2012).
La figura 3f muestra la dependencia isotérmica de la magnetización frente al campo magnético (M vs. H) medida a temperatura del cuerpo humano (310 K) y a 1.8 K. Se observa que esta muestra presenta histéresis magnética a 1.8 K con un campo coercitivo de 365 Oe, mientras que exhibe un comportamiento superparamagnético a 310 K.
Los ensayos biológicos se llevaron a cabo con nanopartículas cargadas con pequeñas cantidades de paclitaxel (0.1 %peso) con la finalidad de poder detectar diferencias sutiles en la viabilidad de las líneas celulares bajo diferentes condiciones experimentales. Los resultados de los ensayos de citotoxicidad en función de la concentración de partículas y el tiempo de incubación en los experimentos con un solo nivel de líneas celulares se muestran en la figura 4a. Se observa que la viabilidad celular decayó considerablemente con pequeñas concentraciones de partículas cargadas de fármaco, siendo más marcado el efecto con el aumento del tiempo de incubación, mientras que la viabilidad celular solamente se vio afectada por la presencia de la muestra B a tiempos largos de incubación (72 h), con una disminución de hasta 10%. Esto indica que los SPION estabilizados con ácido oleico y Pluronic® 147 son altamente biocompatibles y su efecto antineoplásico es debido a la carga de fármaco.
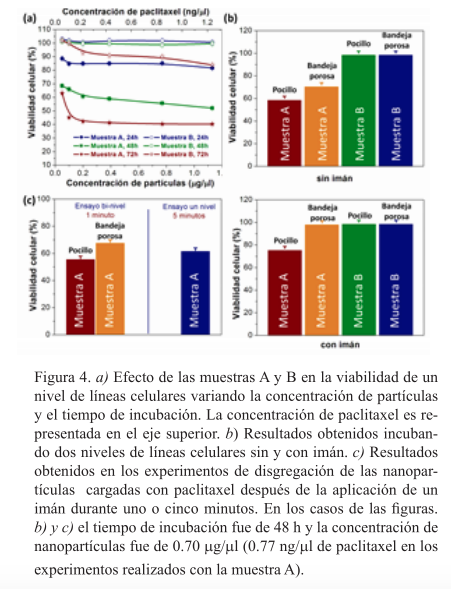
La figura 4b presenta los resultados obtenidos en los experimentos de dos niveles en la presencia y en ausencia de un imán. Se observa que la muestra B no tuvo ningún efecto sobre la viabilidad de las células en ninguno de los casos. Por el contrario, cuando la in-cubación de las células se llevó a cabo después de la inyección de partículas de la muestra A en ausencia de campos magnéticos, la viabilidad de las dos líneas celulares disminuyó significativamente. Esto indica que las nanoestructuras se dispersan en el medio acuoso atravesando la membrana porosa de la bandeja. Esta disgregación es un factor crucial en la difusión intratumoral de las nanoformulaciones. Al ubicar un imán debajo de los pocillos de la placa de cultivo durante el proceso de incubación, la relación de supervivencia de las células en el fondo del pocillo se redujo 26%, mientras que la viabilidad de las células en la bandeja porosa no fue alterada (figura 4b). Estos resultados indican que las nanopartículas pueden ser magnéticamente recolectadas y su actividad antiproliferativa se puede dirigir a regiones diana usando campos magnéticos. Además, esto confirma que el fármaco se mantuvo unido a las nanoestructuras durante los experimentos. Curiosamente, a pesar de haber dirigido las nanopartículas hacia las células que se encuentran en el fondo del pocillo, la viabilidad de estas líneas celulares fue mayor que en la encontrada en los mismos ensayos realizados sin el uso de un imán. Esta reducción de la capacidad antiproliferativa probablemente se deba a la aglomeración de las partículas y a la pérdida de su movilidad bajo la fuerza de atracción del imán, reduciendo la e¿ciencia de la liberación del fármaco sobre las células. Esto explica la limitada difusión intratumoral reportada en los ensayos in vivo y estudios clínicos anteriormente citados.
La figura 4c muestra los resultados de los experimentos de viabilidad celular después de la aplicación de un campo magnético durante unos pocos minutos. En el caso del experimento con células crecidas solamente en un nivel, la viabilidad celular fue similar a la obtenida en experimentos sin campo magnético bajo las mismas condiciones de incubación. En el caso de los experimentos de dos niveles, la viabilidad se redujo notablemente en ambos niveles (sus valores fueron 57% en la placa de cultivo y 67% en la bandeja porosa). Esto indica que después de concentrar las partículas en las células que se encuentran en el fondo del pocillo con la aplicación del campo magnético, las nanoformulaciones se propagan en el medio e interaccionan con las células de la bandeja porosa, reduciendo su viabilidad. Esta disgregación de las partículas después de retirar el imán es debida al comportamiento superparamagnético y alta estabilidad coloidal de las nanoformulaciones. Por otra parte, es interesante observar que la viabilidad de las células en el fondo del pocillo fue menor que cuando se mantuvo constante el campo magnético durante todo el proceso de incubación. Estos resultados sugieren que, una vez localizadas las nanoformulaciones en la región diana, se puede favorecer su acción terapéutica y su difusión intratumoral al retirar el campo magnético. Por tanto, una aplicación del campo magnético discontinua o pulsada podría incrementar la eficacia de las quimioterapias asistidas con vectores superparamagnéticos.
Conclusiones
La entrega guiada de pequeñas cantidades de agentes antineoplásicos usando nanoplataformas superparamagnéticas y campos magnéticos se ha investigado empleando líneas celulares cultivadas en uno o dos niveles. Los resultados mostraron que, en medios acuosos, estas nanoestructuras superparamagnéticas se pueden localizar rápidamente en un sitio específico con la aplicación de un campo magnético continuo, produciendo efectos antiproliferativos controlados sin afectar a otras líneas celulares que se encuentren en la vecindad. No obstante, la actividad antiproliferativa de las nanoformulaciones se reduce cuando su movilidad está limitada por la fuerza de atracción ejercida por el campo magnético. La aplicación discontinua de este campo favorece la subsiguiente diseminación de las nanopartículas entre capas celulares. Éste es un hallazgo importante que debería ser considerado en ensayos clínicos futuros.
Agradecimientos
Los autores agradecen al Dr. Enrique D. Barriga Castro su valiosa colaboración en las caracterizaciones realizadas por MET. Asimismo, agradecen a la Secretaría de Educación Pública de México (SEP) por su apoyo a la formación de la Red temática de colaboración “Sis-temas de baja dimensionalidad con aplicaciones biotecnológicas”.
* Universidad Autónoma de Nuevo León
Contacto: carlos.lunacd@uanl.edu.mx
Referencias
American Cancer Society: Cancer Facts and Figures. 2013. Atlanta, Ga: American Cancer Society.
Asin, L., et al. (2012). Pharmaceutical research, 29(5), 1319-1327.
Bean, C.P., Livingston, J.D. (1959). J. Appl. Phys., 30 120S.
Chertok, B., David, A.E., y Yang, V.C. (2010). Bioma-terials, 31(24), 6317-6324.
Cullity B.D. (1972). Introduction to magnetic materials. Addison-Wesley Publishing Company.
De Berti, I.P., et al. (2013). Nanotechnology, 24(17), 175601.
Dromi, S., et al. (2007). Clinical Cancer Research, 13(9), 2722-2727.
Du, C.H., Wu, C.J., y Wu, L.G. (2012). Journal of Applied Polymer Science, 124(S1).
Iyer, A.K., et al. (2006). Drug discovery today, 11(17), 812-818.
Jain, T.K., et al. (2008). Biomaterials, 29(29), 4012-4021.
Lammers, T., et al. (2012). Journal of controlled relea-se, 161(2), 175-187.
Lee, E.S., Na, K., y Bae, Y.H. (2005). Journal of Con-trolled Release, 103(2), 405-418.
Lübbe, A.S., et al.. (1996). Cancer research, 56(20), 4686-4693.
Lübbe, A.S., Alexiou, C., y Bergemann, C. (2001). Journal of Surgical Research, 95(2), 200-206.
Mornet, S., et al. (2004). Journal of Materials Chemistry, 14(14), 2161-2175.
Patravale, V.B., y Kulkarni, R.M. (2004). Journal of pharmacy and pharmacology, 56(7), 827-840.
Stoner, E.C., Wohlfarth, E.P. (1948). Phil. Trans. Roy. Soc. London, A240 599.
Strebhardt, K., & Ullrich, A. (2008). Nature Reviews Cancer, 8(6), 473-480.
Sun, C., Lee, J.S., y Zhang, M. (2008). Advanced drug delivery reviews, 60(11), 1252-1265.
Torchilin, V.P. (2010). In Drug delivery (pp. 3-53). Springer Berlin Heidelberg
Wahajuddin, S. A. (2012). International journal of na-nomedicine, 7, 3445.
RECIBIDO: 18-08-2016
ACEPTADO: 05-09-2016
