LETICIA M. TORRES MARTÍNEZ*, CHRISTIAN GÓMEZ SOLÍS*, ISAÍAS JUÁREZ RAMÍREZ*, JUAN CARLOS BALLESTEROS PACHECO*, DANIEL SÁNCHEZ MARTÍNEZ*
CIENCIA UANL / AÑO 18, No. 76, NOVIEMBRE-DICIEMBRE 2015
Artículo en PDF
El desarrollo de fuentes renovables de energía amigables con el medio ambiente se ha convertido en un tema de atención prioritaria en los últimos cuarenta años. (1-3) A partir del trabajo reportado por Fujishima y Honda, en 1972, para la fotoconversión del agua con el TiO2 como fotoánodo, muchos investigadores han desarrollado diversos sistemas fotocatalíticos o fotoelectroquímicos que usen luz solar con la finalidad de producir hidrógeno de manera eficiente. (4,5) Varios semiconductores se han empleado en la producción de hidrógeno vía fotocatalítica, entre éstos se encuentran los tantalatos, los cuales consisten en aniones TaO3 – y Ta2 O6 2- enlazados con cationes metálicos que serían metales alcalinos, alcalinotérreos, metales de transición y otros metales de grupos principales, los cuales se sintetizan por diferentes métodos: estado sólido, sol-gel, hidrotermal y coprecipitación, entre otros. Su empleo como catalizadores para la producción de hidrógeno ha mostrado una alta actividad debido a su estructura tipo perovskita, que facilita la migración de los portadores de carga. (6) A los tantalatos con estructura tipo perovskita de fórmula ATaO3 (A = Li, Na, K) los forman octaedros unidos por las esquinas. Entre éstos, el NaTaO3 , asistido con cocatalizadores como el NiO y el RuO2 presenta la mayor actividad fotocatalítica hasta ahora reportada. Nuestro grupo de investigación ha estudiado el sistema RuO2/NaTaO3 en la reacción de producción de hidrógeno a partir de agua con alta actividad fotocatalítica. (7) De acuerdo con los resultados, el material La:NaTaO3 sintetizado por sol-gel y modificado con 1% de RuO2 produjo alrededor de 4,108 µmoles h-1 g-1 de H2 , lo cual es mucho mayor que lo reportado previamente por Kudo et al. (8) para este mismo material, pero sintetizado por reacción de estado sólido. Por otra parte, se han empleado estrategias para mejorar la actividad catalítica de los materiales para la producción de hidrógeno, como: a) diseñar el método de síntesis; b) la incorporación de un cocatalizador, y c) a través de la incorporación de otro elemento como dopante. Por tal motivo, las investigaciones se orientan sobre el desarrollo de materiales semiconductores con diferentes rutas de síntesis de química suave para su preparación, con la finalidad de modificar la morfología del material y tener mayor área de superficie expuesta. (9-15)
En los últimos años se ha observado un gran interés en el desarrollo y optimización de los métodos de síntesis, entre ellos los de química suave como el sol-gel, solución-combustión, hidrotermal y precipitación asistida, ya que permiten principalmente la obtención de la fase de interés del fotocatalizador a menor temperatura y menor tiempo de reacción, en comparación con el método cerámico tradicional. (16-19) En este sentido, la selección correcta del método de síntesis para la preparación de fotocatalizadores adecuados es una de las tareas más importantes en el campo de la fotocatálisis. La modificación de los semiconductores mediante el uso de cocatalizadores es una práctica que favorece de manera significativa la actividad fotocatalítica. (20-23) La función principal del cocatalizador es promover la transferencia del par hueco/ electrón hacia la superficie, con esto, no sólo se consigue incrementar la velocidad y la eficiencia de la reacción, sino que en algunos casos ayuda a estabilizar la estructura del fotocatalizador; también ayudan a reducir la energía de activación para producir el hidrógeno.
En este trabajo se presenta y discute el aumento significativo en la actividad fotocatalítica del NaTaO3 para la producción de hidrógeno a partir de la conversión del agua, empleando para ello el material preparado a través de una nueva ruta de síntesis de química suave, llamada solvo-combustión, la cual es una modificación del método de solución-combustión. Además, con este método se busca que el producto presente un alto valor de área superficial y alto grado de cristalinidad, así como características estructurales y morfológicas específicas. Se busca que la sinergia de estas propiedades favorezca el incremento en la eficiencia de la reacción para la producción de hidrógeno a partir de la conversión de la molécula del agua.
METODOLOGÍA EXPERIMENTAL
Síntesis del óxido tipo perovskita NaTaO3 mediante solvo-combustión
La síntesis se llevó a cabo utilizando como reactivos químicos el etóxido tántalo (V) (99.98% Aldrich) y acetato de sodio (98% DEQ). Primero, las cantidades estequiométricas de etóxido de tántalo y acetato de sodio se colocaron en un matraz y se disolvieron en acetilacetona y etanol. La mezcla se agitó y se calentó moderadamente a reflujo hasta que la temperatura alcanzó los 70°C. Después se añadió el HNO3 y el matraz se colocó inmediatamente en una plancha de calentamiento a 180°C para provocar la combustión. Posteriormente, el producto obtenido se dividió en cuatro porciones, una se mantuvo tal cual (fresco) y las otras tres porciones se calcinaron a 400, 600 y 700°C durante dos horas.
Caracterización
Todos los materiales semiconductores se caracterizaron térmica, estructural, morfológica y ópticamente, a través de diversas técnicas como análisis térmico simultáneo (DTA/TGA), difracción de rayos-X en polvos (DRX), microscopía electrónica de barrido (MEB), microscopía electrónica de transmisión (MET), fisisorción de nitrógeno (N2), energía de banda prohibida (Eg) y espectroscopia de impedancia electroquímica.
Producción de hidrógeno a partir de la reacción de fotoconversión del agua en hidrógeno y oxígeno vía HPC y PEC
El NaTaO3 sintetizado por la nueva ruta de solvo-combustión se empleó para la producción de hidrógeno. La actividad de producción de este material se evalúo y comparó bajo tres aspectos: el nuevo método de síntesis, producción en modo HPC, en modo PEC y la incorporación del cocatalizador RuO2.
Vía fotocatalítica
Las pruebas se efectuaron en un sistema de reacción de un dispositivo de vidrio adaptado a un cromatógrafo de gases marca Varian CP 3380, con un detector de conductividad térmica, para analizar los gases generados en la reacción de conversión del agua. La reacción de conversión del agua se efectuó en un reactor adaptado con una celda de inmersión de cuarzo. (24) Como fuente de luz se utilizó una lámpara de mercurio de alta presión de 400 W, modelo HL400EH-5 de SEN Lights Corporation. (25)
Vía fotoelectroquímica
Una vez sintetizados y caracterizados los materiales, fueron preparados como electrodos para las pruebas fotoelectroquímicas. La preparación de los electrodos se llevó a cabo mediante el método de electrodepositación. Las pruebas de actividad fotoelectroquímica se llevaron a cabo en una celda de cuarzo que consta de un sistema convencional de tres electrodos: un electrodo de platino, el electrodo de referencia de Ag/ AgCl y el electrodo de trabajo que fue el material sintetizado. Los experimentos fueron monitoreados en un potenciostato/ galvanostato AUTOLAB PGSTAT 302N.
RESULTADOS Y DISCUSIÓN
Síntesis del NaTaO3 por solvo-combustión
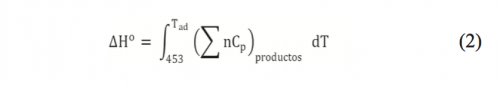
Con la finalidad de entender el proceso de solvo-combustión en el cual ocurre la reacción, se realizó el balance de energía teórico y se consideraron valores reportados en la bibliografía de entalpía de formación y capacidad calorífica de las especies químicas involucradas. Con base al principio de química de propulsión, (26) para reacciones redox estequiométricas entre un combustible y el agente oxidante nitrato, los gases principales involucrados en la reacción de combustión son N2 , CO2 y H2O. La proporción nitratos/acetilacetona se varió en el rango 1-9. Para efectuar el cálculo de la temperatura adiabática, se tomaron datos termodinámicos de capacidad calorífica y entalpías de reacción reportados en la bibliografía. (27) A partir de éstos, fue posible calcular la entalpía de combustión utilizando la ecuación (1).

Los resultados de la entalpía liberada por el proceso de combustión, con los datos de entalpía de formación en la bibliografía y con la ecuación 2, revelaron que la temperatura adiabática fue de 1470°C.
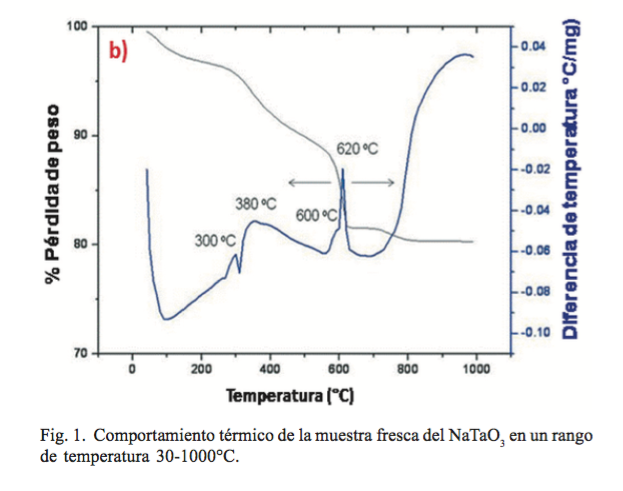
Por otra parte, en la figura 1 se muestra el comportamiento térmico del polvo obtenido del proceso de solvo-combustión. Se observa que la muestra tiene una pérdida en peso de aproximadamente 20% entre los 100 y 700°C, asociada a los picos endotérmicos, que corresponden al proceso de deshidratación y a la pérdida de la materia orgánica residual.
Además, se observa que por encima de los 600°C se presenta un pico exotérmico que corresponde a la recristalización del NaTaO3 y la presencia de la fase secundaria (Na2 Ta4 011), que también comienza a aparecer a esta temperatura. La presencia de esta fase secundaria se debe a que probablemente esté ocurriendo la volatilización del óxido de sodio durante el proceso de síntesis, como se ha reportado en otros procesos de síntesis. (7,28)
Caracterización estructural, morfológica, óptica y electroquímica del NaTaO3 obtenido por solvo-combustión
Difracción de rayos X
En la figura 2 se muestran los patrones de difracción de rayosX en polvos del NaTaO3 , tanto para la muestra fresca como para los materiales tratadas térmicamente a 400, 600 y 700ºC.
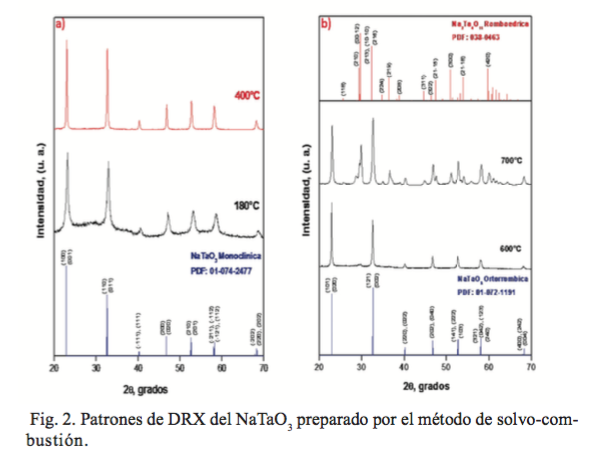
Los difractogramas de la figura 2a corresponden al polvo obtenido directamente del proceso de solvo-combustión (180°C), y el polvo tratado térmicamente a 400°C, en ambos difractogramas se observa la presencia de la fase NaTaO3 con aceptable cristalinidad. Los resultados indican que tanto la muestra fresca como la calcinada a 400°C presentan la fase del NaTaO3, con una estructura cristalina monoclínica (PDF No. 01-074-2477). Importa resaltar que la síntesis del NaTaO3 a 180°C es la temperatura más baja hasta ahora reportada para esta fase. Por otro lado, los difractogramas de la figura 2b muestran que los materiales calcinados a 600 y 700°C, presentan una mayor cristalinidad, y cristalizan en una estructura de simetría ortorrómbica (PDF No. 01-072-1191). Asimismo, se observaron algunos pequeños picos adicionales, los cuales corresponden a la fase secundaria Na2 Ta4 011, cuya presencia es alrededor de 5% (PDF No. 038-0463). En la muestra calcinada a 700°C se observó un incremento en más de 50% de la segunda fase. Como se mencionó anteriormente, la presencia de esta fase secundaria se debe a la volatilización parcial del Na2O.
Análisis de la morfología
En las figuras 3a y 3b, se observa que las partículas del NaTaO3 presentan un tamaño menor a una micra, y unidas forman una estructura tipo esponja; esta morfología se atribuye al método de síntesis de solvo-combustión, ya que durante el proceso de combustión ocurre la liberación de gases y se evita el crecimiento del tamaño de partícula del NaTaO3 . Por otro lado, al analizar los materiales calcinados, no se observaron diferencias importantes en la morfología, y se mantuvieron las cavidades observadas en la muestra fresca.
Estos resultados muestran que la combustión de compuestos poliméricos provoca estructuras de morfología similar a una esponja con alta área superficial.
Asimismo, las micrografías obtenidas del análisis por microscopía electrónica de transmisión (MET) del NaTaO3 preparado por solvo-combustión muestran que las partículas del NaTaO3 presentan una morfología de cubos con un tamaño menor a 100 nm (figura 3c). La nanoestructura de estas partí- culas obtenidas a 600°C se forma por partículas apiladas en forma de nanoescalones, los cuales son sitios con energía adecuada para la disminución de la energía libre de Gibbs de la reacción de manera que la reducción de protones se ve favorecida.
Valores de área superficial específica (SBET)
Los resultados de área superficial para el NaTaO3 obtenido a 180, 400, 600 y 700°C fueron 118, 75, 41 y 35m2 .g-1, respectivamente. Estos resultados indican que conforme se incrementa la temperatura, el área superficial disminuye como una consecuencia del proceso de sinterizado de las partículas de NaTaO3 obtenidas por solvo-combustión a 180°C.
Un análisis comparativo de estos resultados con los reportados en la bibliografía para NaTaO3 , sintetizado por estado sólido (0.6m2 .g-1, estructura ortorrómbica) y sol-gel (23m2 .g-1 , estructura ortorrómbica y monoclínica) indica que en este trabajo el nuevo método de solvo-combustión permitió obtener un valor de área superficial 68 veces superior para el caso de NaTaO3 con estructura ortorrómbica (600°C) y el doble, con respecto a la fase ortorrómbica obtenida por sol-gel.
Desempeño del NaTaO3 en la producción de hidrógeno
Sistema de fotocatálisis heterogénea usando NaTaO3 y NaTaO3 -RuO2
La actividad del NaTaO3 como fotocatalizador para la producción de hidrógeno se determinó a partir de la conversión de agua, con un sistema de fotocatálisis heterogénea (HPC) irradiado con luz UV.
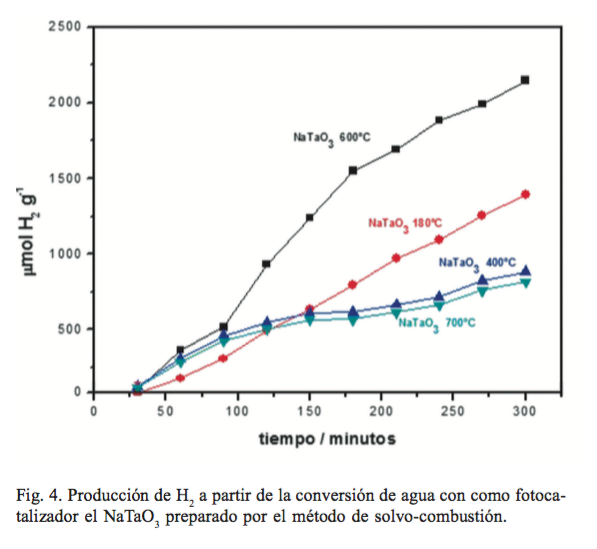
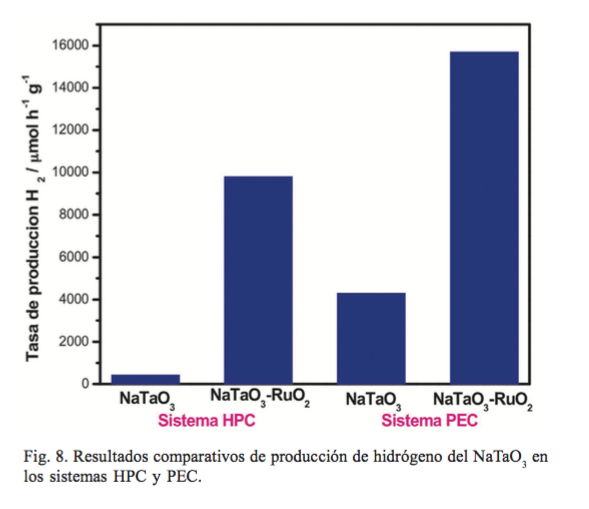
En la figura 4 se muestran los resultados de la evolución de hidrógeno de las muestras de NaTaO3 preparadas: la fresca y las tratadas térmicamente a 400, 600 y 700°C. En este caso, la tendencia en la producción de hidrógeno fue la siguiente: NaTaO3 -600 > NaTaO3 -Fresca (180°C) > NaTaO3 -400 > NaTaO3 -700.
De acuerdo a los resultados, la fase con estructura ortorrómbica (NaTaO3 calcinado a 600°C) presentó la mayor actividad fotocatalítica, aun y cuando en la bibliografía está reportado que la fase monoclínica debería ser la más activa por el ángulo de enlace Ta-O-Ta cercano a 180°, que le permite una mayor deslocalización de los portadores de carga fotogenerados, los cuales incrementan su movilidad para alcanzar la superficie en menor tiempo y evitar la recombinación.
La producción de hidrógeno alcanzada por el NaTaO3 calcinado a 600°C fue de 430 µmol h-1.g-1, resultado cuatro veces superior a los reportados en la bibliografía para este óxido, los cuales son 166 y 110 µmol h-1.g-1 con NaTaO3 obtenido por sol-gel y estado sólido, respectivamente, (7,8) este último con metanol como agente de sacrificio.
La actividad presentada por el NaTaO3 se atribuye a la morfología en forma de nanoescalones, la cual favoreció la presencia de sitios activos para la reacción de evolución de hidrógeno y oxígeno, así como una alta área superficial (41 m2 .g-1), la cual genera una mayor cantidad de los mismos en la superficie donde ocurren las reacciones redox. Asimismo, la presencia de la fase secundaria (Na2 Ta4 011), la cual contribuye al incremento de la actividad al actuar como un cocatalizador, captura los electrones y retarda la recombinación de par hueco-electrón.
El NaTaO3 tratado térmicamente a 600°C se seleccionó para impregnarlo con RuO2, al evaluar la producción de H2 bajo irradiación solar. En este caso, la muestra de NaTaO3 al contener 0.5% de RuO2, incrementó ligeramente la cantidad de H2 producido en comparación con el NaTaO3 solo. Por otro lado, los resultados obtenidos indican que la muestra con 1% en peso de RuO2 presentó la mayor actividad fotocatalítica. Después de cinco horas de reacción, se produjeron cerca de 50,000 micromoles de hidrógeno por gramo, esto es 25 veces más que la cantidad obtenida con solo el NaTaO3 . Cuando se incorpora 1.5% de RuO2 sobre el NaTaO3 , produce menos de 25,000 micromoles por gramo. Esta disminución se atribuye a la aglomeración del RuO2 en la superficie del NaTaO3 , que limita la absorción de luz en la superficie del material y, por lo tanto, disminuye la generación del par hueco–electrón en el NaTaO3 . La cantidad de hidrógeno obtenido (9,800 µmol h-1.g-1) con el NaTaO3 preparado por el método de solvo-combustión, calcinado a 600°C e impregnado con RuO2 , fue dos veces más grande en este trabajo en comparación con otros reportados para este mismo óxido (4,108 y 147 µmol h-1.g-1), preparado por sol-gel (7) y estado sólido,(29) respectivamente, este último con incluso metanol como agente de sacrificio.
En este caso, se asume que la morfología en forma de nanoescalones que presenta la fase ortorrómbica del NaTaO3 obtenida por el método de solvo-combustión influye considerablemente en el incremento de la actividad, debido a que en los nanoescalones formados se deposita el RuO2, y genera más sitios activos para la evolución de hidrógeno. Asimismo, se presenta un efecto sinérgico entre la fase secundaria y el cocatalizador RuO2 , al actuar ambos como colectores de electrones, y favorece la actividad fotocatalítica al retardar la recombinación del par hueco-electrón.
Sistema fotoelectroquímico usando NaTaO3 y NaTaO3 – RuO2
Para la evaluación de la producción de hidrógeno fotoelectroquímico, el polvo de NaTaO3 se preparó en forma de película, a partir de la metodología empleada por nuestro grupo de investigación,30 en el que como sustrato conductor se utilizó una cinta adhesiva de cobre (marca 3M), y sobre ella se colocaron 0.1 mg de NaTaO3 , de manera que la superficie de cobre quede completamente cubierta y adherida con el polvo NaTaO3 . Para la incorporación de RuO2 se utilizó esta película de NaTaO3 como electrodo de trabajo por la técnica de electrodeposición a partir de una solución 0.1 M RuCl3 + 1.0 M HNO3 , previamente reportada en la bibliografía (31)
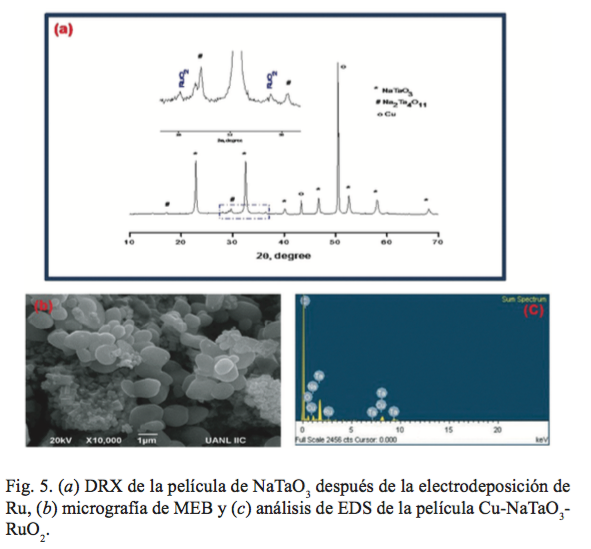
La figura 5a muestra el espectro de DRX de la película de NaTaO3 después de la electrodeposición de RuO2 , en donde se identifican las señales correspondientes a la cinta de cobre, NaTaO3 y RuO2 . La figura 5b muestra la imagen MEB correspondiente con la película Cu-NaTaO3 -RuO2 , se observa la presencia de granos semiesféricos agrupados en forma de racimo, así como la morfología característica del NaTaO3 obtenida en este trabajo. La composición elemental de la película Cu-NaTaO3 -RuO2 se obtuvo por análisis EDS (figura 5c), en el espectro se observa la presencia de cobre, tántalo, rutenio y oxígeno. El análisis químico indicó que existe 2.2% de rutenio.
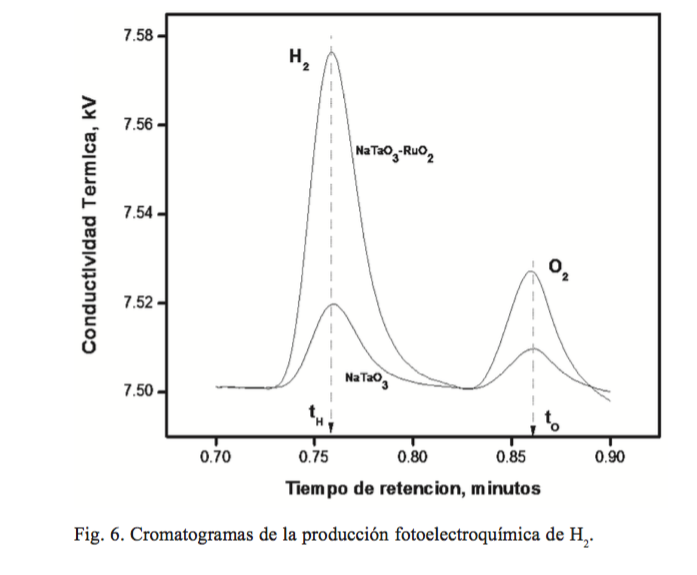
La producción fotoelectroquímica de hidrógeno sobre CuNaTaO3 y Cu-NaTaO3 -RuO2 se llevó bajo irradiación durante 1 h a un valor de -0.5 V. La cantidad de hidrógeno y oxígeno se midió en un cromatógrafo de gases. La figura 6 muestra la comparación de los cromatogramas relacionados con la producción de hidrógeno y oxígeno para ambos fotoelectrodos, los cuales corresponden con una cantidad de 4,300 y 15,700 µmol g-1.h-1 para Cu-NaTaO3 y Cu-NaTaO3 -RuO2 , respectivamente. La comparación de estos resultados con los obtenidos en el proceso fotocatalítico indican que en el sistema PEC es diez y dos veces mayor la cantidad de hidrógeno producido para el NaTaO3 y NaTaO3 -RuO2 , respectivamente.
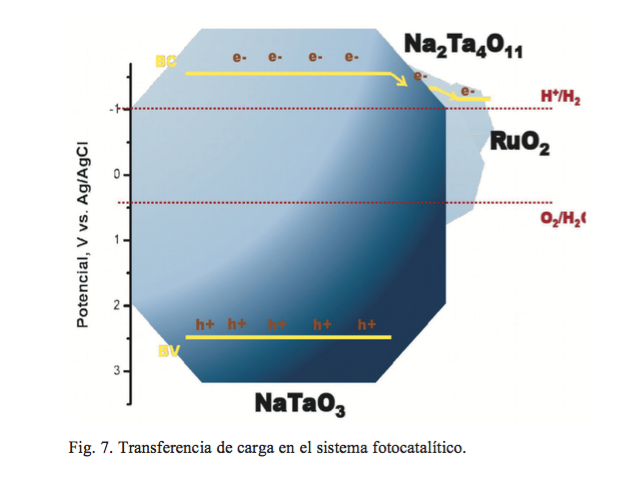
Propuesta del mecanismo de transferencia de carga
Con la finalidad de dar una explicación a los resultados de producción de hidrógeno con NaTaO3 obtenido por solvocombustión, diagramas de banda fueron construidos para este fin. La figura 7 corresponde con el diagrama de bandas con la incorporación de RuO2 , el cual presenta una banda de conducción más positiva que el Na2 Ta4 011, lo que provoca que actúe como un colector de electrones.
Estos resultados muestran la efectividad de acoplar materiales semiconductores para lograr un mayor aprovechamiento de las cargas fotogeneradas. De tal forma que la probabilidad de recombinación se vea disminuida, debido a que el RuO2 y la fase Na2 Ta4 011 proporcionan nuevos niveles de energía permitidos para que los electrones no regresen a su estado basal.
La figura 8 muestra un comparativo de los mejores resultados de producción de hidrógeno en el sistema HPC y PEC presentados en este trabajo. A partir de estos resultados, es claro observar que la cantidad de hidrógeno producido es mayor en el sistema PEC. Adicionalmente, podemos afirmar que estos resultados son superiores a los reportados hasta ahora en la bibliografía para este material. Estas altas actividades las hemos atribuido a este nuevo método de síntesis al que le hemos nombrado solvo-combustión, el cual confiere propiedades morfológicas, estructurales y químicas al NaTaO3 , las cuales tienen un efecto sinérgico capaz de incrementar la tasa de producción de hidrógeno.
CONCLUSIONES
Se desarrolló un innovador método termoquímico (solvocombustion) de síntesis a través del cual se obtuvo por vez primera la fase del tantalato de sodio (NaTaO3) a la temperatura más baja (180°C) hasta ahora reportada y en un tiempo muy corto (10 minutos). El método de solvo-combustión permite obtener partículas con una morfología en forma de cubos enlazados por nanoescalones, al favorecer la actividad catalítica del NaTaO3 en la producción de hidrógeno en los procesos fotoinducidos, debido a que se generan sitios activos para la evolución del hidrógeno. El NaTaO3 con estructura cristalina ortorrómbica presentó una mayor actividad fotocatalítica, comparada con los resultados de la fase monoclínica, lo cual contradice a lo reportado en la bibliografía. Este resultado se asocia con la presencia de la fase secundaria Na2 Ta4 011 que cristaliza a una temperatura de 600°C, la cual actúa como un colector de electrones que ayuda a evitar la recombinación del par hueco-electrón.
Se encontró en este trabajo que la alta actividad de la fase ortorrómbica del NaTaO3 obtenida se asocia con la sinergia de la elevada área superficial, la presencia de los nanoescalones en las partículas del NaTaO3 y la presencia de la segunda fase Na2 Ta4 011 en bajas concentraciones. Además, el acoplamiento de las bandas energéticas.
El uso de RuO2 como cocatalizador incrementa la actividad catalítica del NaTaO3 en procesos fotoinducidos en la producción de hidrógeno, y logra obtener 9,800 µmol.g-1.h-1, lo cual es 23 veces más grande que la cantidad obtenida con sólo el NaTaO3 reportado en bibliografía y sin emplear metanol como agente de sacrificio. Se asume que el incremento en la actividad se debe a que en los nanoescalones formados se deposita el RuO2, y genera más sitios activos para la evolución de hidrógeno; además, actúa como un colector de electrones y junto con la segunda fase Na2 Ta4 011 retarda la recombinación del par hueco-electrón.
La producción fotoelectroquímica de H2 por el NaTaO3 se incrementó por efecto del potencial interfacial controlado que disminuye la velocidad de recombinación del par huecoelectrón, de manera que un mayor número de electrones llegan a la superficie para la reducción de protones.
La transferencia de electrones en el sistema electroquímico se aceleró al mantener el sistema bajo irradiación, ya que se disminuyó la recombinación del par hueco-electrón. Además, la presencia de RuO2 aumentó la cantidad de cargas fotogeneradas y provocó un incremento en la reducción de H+ para generar mayor cantidad de H2.
AGRADECIMIENTOS
Los autores agradecen al Paicyt-UANL 2011-2012, Conacyt FOINS 75/2012, Conacyt CNPq México-Brasil 2012-174247, y Conacyt-CB168730, por el apoyo financiero otorgado para la realización de este proyecto.
RESUMEN
En el presente trabajo se presenta una nueva ruta de síntesis termoquímica de la perovskita NaTaO3 , a la cual se le evaluó el desempeño fotocatalítico en la producción de hidrógeno, sin agente de sacrificio. La fotoproducción de hidrógeno se llevó a cabo en un reactor fotocatalítico y fotolectroquímico, respectivamente, bajo irradiación de luz UV-vis. Los resultados de producción de hidrógeno en el sistema fotocatalítico fueron 430 y 9,800 µmol g-1.h-1 sin y con RuO2 , respectivamente; en el caso del sistema fotoelectroquímico se obtuvieron 4,300 y 15,700 µmol g-1.h-1 sin y con RuO2 , que indican que el NaTaO3 es diez y 1.6 veces más fotoactivo en el sistema fotoelectroquímico. La alta actividad se atribuye a las características morfológicas, ópticas, estructurales y químicas del NaTaO3 , obtenidas por la nueva ruta de síntesis. La temperatura de ignición de la mezcla comburente fue de 180°C; no obstante, los cálculos termoquímicos arrojaron una temperatura adiabática máxima de 1470°C. Los resultados de DRX indicaron que el NaTaO3 obtenido a 180ºC presenta una buena cristalinidad, pero ésta aumenta cuando el polvo se somete a tratamiento térmico entre 400-700°C. Además, dos fases cristalinas fueron encontradas en función de la temperatura; entre 180-400°C se obtuvo la monoclínica y entre 600- 700°C la ortorrómbica.
Palabras clave: Tantalato de sodio, Solvo-combustión, Hidrógeno, Fotocatálisis, Fotoelectroquímica.
ABSTRACT
In the present work a novel thermochemical synthesis route for NaTaO3 , which was evaluated in the water splitting reaction without sacrificial agent, is reported. Hydrogen production tests were conducted in photocatalytic and photoelectrochemistry reactors under UV light irradiation. Results showed that the amount of hydrogen produced in the photocatalytic systems was 430 and 9,800 µmol g-1.h-1 with and without RuO2 , respectively; while in the photoelectrochemical systems the amount of hydrogen produced was 4,300 and 15,700 µmol g-1.h-1 with and without RuO2 , indicating that NaTaO3 is 10 and 1.6 times more photoactive in the photoelectrochemical system. This activity is attributed to the morphological, optical, structural, and chemical characteristics of NaTaO3 obtained by the novel synthesis route. The ignition temperature was 180°C, nevertheless the thermochemical calculations indicated a maximun adiabatic temperatura of 1470°C; which reduces in more than 550% the energy consumption used for the synthesis of NaTaO3 by solid-state reaction. XRD results indicated that NaTaO3 obtained at 180ºC shows a good crystallinity, which increases when the powder is thermally treated from 400 to 700°C. Also 2 crystalline phases were detected as a function of the temperature; the monoclinic phase was obtained between 180-400°C and the orthorhombic phase was obtained between 600-700°C.
Keywords: Sodium tantalate, Solvo-combustion, hydrogen, Photocatalysis, Photoelectrochemical.
* Universidad Autónoma de Nuevo León.
Contacto: lettorresg@yahoo.com
REFERENCIAS
1. J.R. Bartels, M.B. Pate, N.K. Olson. Int. J. Hydrogen Energy 35 (2010) 8371-8384.
2. S. Verhelst. Int. J. Hydrogen Energy, 39, 2014, 1071-1085.
3. C.J. Winter. Int. J. Hydrogen Energy 34 (2009) S1-S52.
4. R. Abe, Journal of Photochemistry and Photobiology C: Photochemistry Reviews 11 (2010) 179-209.
5. A. Fujishima, K. Honda. Nature 238 (1972) 37-38.
6. J. Gong et al. Chem Soc Rev. 43, 4271-4896 (2014).
7. L.M. Torres-Martínez, R. Gómez, O. Vázquez-Cuchillo, I. JuárezRamírez, A. Cruz-López, F.J. Alejandre-Sandoval. Catal Commun 12 (2010) 268-272.
8. H. Kato, A. Kudo, Chem. Phys. Lett. 295 (1998) 487-492.
9. F.E. Osterloh. Chemistry of Materials. 20 (2008) 35-54.
10. W. Yao, C. Huang, J. Ye. Chemistry of Materials 22 (2010) 1107- 1113.
11. R.J. Braham and A.T. Harris. Industrial & Engineering Chemistry Research. 48 (2009) 8890-8905.
12. W.J. Youngblood, S.H. Anna-Lee, K. Maeda, T.E. Mallouk. Accounts of Chemical Research 42 (2009) 1966-1973.
13. X. Hu, G. Li, and J.C. Yu. Langmuir 26 (2010) 3031-3039.
14. M. Nan-Chong, B. Jin, C. W. K. Chow, C. Sain. Water Research 44 (2010) 2997-3027.
15. A. Kudo, Y. Miseki, Chem. Soc. Rev. 38 (2009) 253-278.
16. C.C. Tsai, H.S. Teng, J. Am. Ceram. Soc. 87 (2004) 2080-2085.
17. X. Li and J. Zang, J. Phys. Chem. C 2009, 113, 19411-19418.
18. L.M. Torres-Martínez, M. A. Ruiz-Gómez, M.Z. Figueroa-Torres, I. Juárez-Ramírez, E. Moctezuma, E. López Cuellar. Materials Chemistry and Physics 133 (2012) 839-844.
19. L.M. Torres-Martínez, M.A. Ruiz-Gómez, M.Z. Figueroa-Torres, I. Juárez-Ramírez, E. Moctezuma. International Journal of Photoenergy, Article ID 939608 (2012) 7 pages.
20. A. Kudo, H. Kato, I. Tsuji. Chemistry Letters 33 (2004) 1534.
21. K. Maeda. Journal of Photochemistry and Photobiology C 12 (2011) 237.
22. X. Chen, S. Shen, L. Guo, S.S. Mao. Chemical Reviews 110 (2010) 6503.
23. A. Kudo, Y. Miseki, Chem. Soc. Rev. 38 (2009) 253-278.
24. J.C. Luna Urzúa. Tesis de Maestría. FCQ-UANL. 2005.
25. http://www.senlights.com/lamp/lplamp/lamp.htm
26. S.R. Jain, K. C. Adiga, V.R. Pai Verneker, Combus. Flame 40 (1981) 71.
27. Fisicoquímica, Gilbert W. Castellan, Pearson (1987).
28. L.M. Torres-Martínez, A. Cruz-López, I. Juárez- Ramírez, Ma. E. Meza-de la Rosa. Journal of Hazardous Materials 165 (2009) 774- 779.
29. H. Kato, A. Kudo, J. Phys. Chem. B 105 (2001) 4285-4292.
30. I. Juárez-Ramírez, L.M. Torres-Martínez, C. Gómez-Solís and J.C. Ballesteros, J. Electrochem. Soc. (2015) 162, H287-H293. 31. K.M. Kim, J.H. Kim, Y.Y. Lee, K.Y. Kim. Int. J. Hydrogen Energy 37(2012) 1653.
Recibido: 23/09/15
Aceptado: 23/10/15