Desarrollo de un proceso libre de cianuros para la electrodeposición de películas de cobre-zinc con aplicaciones en la producción de hidrógeno y latón comercial
J.C. BALLESTEROS*, L.M. TORRES MARTÍNEZ, I. JUÁREZ RAMÍREZ, C. GÓMEZ SOLÍS, A.M. HUERTA FLORES
CIENCIA UANL / AÑO 18, No. 76, NOVIEMBRE-DICIEMBRE 2015
Las aleaciones de cobre-zinc, como el latón, se emplean ampliamente en nuestra vida cotidiana. Los latones son aleaciones binarias de cobre y zinc, en las cuales el contenido de Zn varía entre 10 y 42% en masa. Cuando el contenido de éste es mayor a 46%, sólo se consideran como aleaciones de cobre-zinc. El latón, con un color amarillo brillante, por su gran parecido al oro, se aplica en bisutería y en elementos decorativos, así como para promover la adherencia entre el acero y el caucho. Los latones pueden ser electrodepositados sobre una variedad de superficies metálicas, pero en la práctica se realiza principalmente sobre zinc, acero, níquel y aluminio. Comercialmente, los recubrimientos decorativos de latón son electrodepositados sobre sustratos metálicos en forma de capas delgadas, con un espesor de alrededor de 5 µm a partir del uso de cianuros. (1,2)
En la bibliografía (3-9) se ha reportado que para el sistema cobre-zinc la formación de los compuestos intermetálicos CuZn5 y Cu5 Zn8 , corresponden con la fase-γ; sin embargo, esta fase se ha reportado a partir de la formación de latones por métodos metalúrgicos.
Las desventajas industriales del uso de cianuros es el alto costo en el tratamiento de los efluentes, generación de lodos tóxicos, pago excesivo de multas por impacto a la flora y fauna. La sustitución de los cianuros de este tipo de baños debe ser una alternativa que facilite el tratamiento de los efluentes y sea capaz de eliminar los gases tóxicos y lodos residuales peligrosos. Entre las alternativas propuestas para la sustitución de los cianuros de los baños electrolíticos alcalinos para electrodepositar latón, (1-6) se encuentran principalmente el uso de tartratos, citratos, amoniaco, EDTA, glicerol, trietanolamina, tiousulfatos, pirofosfatos, entre otros. Sin embargo, ningún baño no cianurado se ha aplicado comercialmente, debido a que cada una de estas alternativas tiene desventajas comparadas con los baños cianurados. Otro de los agentes complejantes utilizados en los últimos años es la glicina, la cual se ha usado para la electrodeposición de aleaciones Zn-Ni, Cu-Co y Zn-Co. (10-18) Estos estudios han mostrado que los recubrimientos obtenidos a partir de soluciones alcalinas que contienen a la glicina como agente complejante son de alta calidad, los cuales presentan potencialidad para aplicarse a nivel industrial. Además de que no existen reportes sobre el uso de la glicina para la electrodeposición de CuZn en medio alcalino, por lo que este resultado representa un área de oportunidad.
Las investigaciones actuales sobre la producción, almacenamiento y el uso de hidrógeno como combustible o como portador de energía se realizan en varios laboratorios alrededor del mundo. Algunas de ellas están enfocadas en la síntesis de nuevos materiales electrocatalizadores, que puedan servir en la producción de hidrógeno a partir de la electrólisis del agua, o en celdas de combustible, así como de materiales que puedan utilizarse en el almacenamiento químico de hidrógeno. (19-21)
Los materiales que se consideran buenos candidatos como electrocatalizadores para la reacción de evolución de hidrógeno (REH) son los metales Pt, Ir, Ru, etc., sin embargo, su alto costo y poca abundancia natural ha provocado la búsqueda de nuevos materiales. De esta manera, el Ni y sus aleaciones son los electrocatalizadores más importantes ampliamente estudiados y aplicados como electrocatalizadores con altas actividades, buena estabilidad química y bajo costo. (22-25) Una de las estrategias para incrementar la actividad electrocatalítica de estos materiales con base en níquel ha sido la combinación con metales como Co, Fe, Mo, W, La, (26-28) NiFe, (29-31) NiMo, (29,32,33) NiW, (29,34,35) NiLa. (36-38)
En otros estudios se ha reportado la aplicación de compuestos intermetálicos, como buenos electrocatalizadores para diversas reacciones electroquímicas. (38) Las características que han mostrado los compuestos intermetálicos son alta durabilidad y electroactividad en su desempeño como catalizadores para las reacciones de evolución de oxígeno, hidrógeno y oxidación de compuestos orgánicos, entre otros. (39-41)
En este proyecto de investigación se pretende realizar la electrodeposición de latón o compuestos intermetálicos sobre sustratos metálicos de níquel, variando las condiciones en las cuales se llevó a cabo el electrodepósito.
METODOLOGÍA
Electrodeposición de Cu-Zn
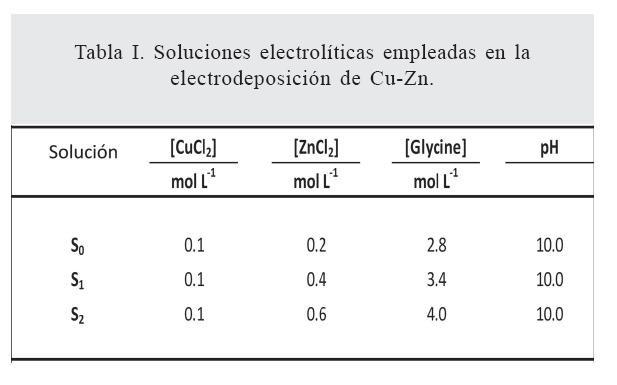
El proceso de electrodeposición de Cu-Zn se llevó en una celda electroquímica convencional de tres electrodos. El electrodo de trabajo usado en la experimentación fue un disco de níquel (99.99% Sigma-Aldrich) pulido a espejo, el cual se montó sobre un electrodo rotatorio de la marca Tacussel. El electrodo de referencia está destinado a la medición del potencial del electrodo de trabajo. El electrodo de referencia utilizado fue el calomel saturado con KCl (ECS). Como contraelectrodo se utilizó una barra de grafito. Los experimentos se controlaron con un potenciostato/galvanostato marca AUTOLAB302N, el cual se encontraba acoplado a una computadora para el control de los experimentos electroquímicos. La adquisición de datos y las técnicas electroquímicas se condujeron a través del software Nova 1.10. Los reactivos químicos utilizados en la preparación de estas soluciones electrolíticas fueron de grado reactivo (SigmaAldrich): CuCl2 •2H2O, ZnCl2 •2H2O, Glicina y KOH. Las soluciones electrolíticas utilizadas se muestran en la tabla I.
La electrodeposición de cobre y zinc en la celda electroquímica de dos electrodos se llevó a cabo sobre una placa de acero AISI-1018, previamente niquelada a partir del baño watts clásico. La composición del baño watts utilizado fue 1.52 M NiSO4 •7H2O + 0.25 M NiCl2 •6H2O + 0.73 M H3 BO3. Las condiciones para realizar la electrodeposición fueron 50°C de temperatura, agitación mecánica, ánodo de níquel, pH = 3 y una densidad de corriente de 5 A cm-2.
Caracterización electroquímica de los recubrimientos Cu-Zn en medio alcalino
Las técnicas electroquímicas empleadas para el estudio de la codeposición electroquímica de cobre y zinc sobre substratos de níquel consisten en voltamperometría lineal y cíclica (acopladas a electrodo de disco rotatorio), métodos de pulso de potencial y métodos de corriente controlada.
Caracterización estructural y morfológica de los recubrimientos Cu-Zn obtenidos en medio alcalino
La caracterización de los compuestos obtenidos se efectuó mediante análisis topográfico, microscopía electrónica de barrido (MEB) y difracción de rayos-X (DRX).
RESULTADOS Y DISCUSIÓN
Evaluación electroquímica del uso de la glicina como agente complejante para la electrodeposición de Cu-Zn
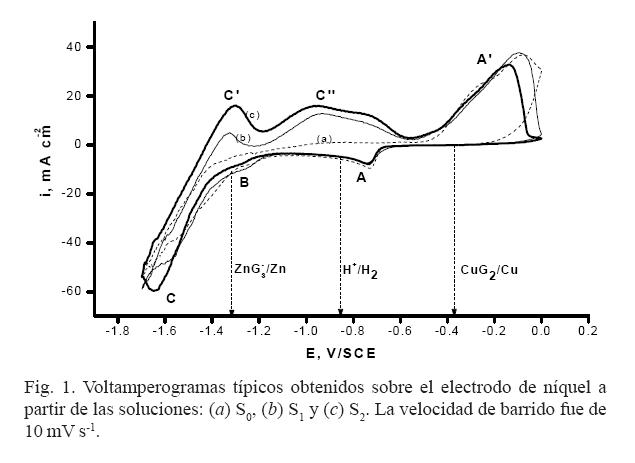
Mediante el análisis del estudio electroquímico fue posible determinar los potenciales de electrodeposición de los recubrimientos de Cu-Zn en cada uno de los sistemas desarrollados. Los voltamperogramas correspondientes a la electrodeposición de Cu-Zn sobre el electrodo de níquel se muestran en la figura 1. Las curvas (a), (b) y (c) se obtuvieron a partir de las soluciones S0, S1 y S2 , respectivamente. Las flechas verticales en la figura 1 indican las posiciones de los potenciales de equilibrio de los pares redox CuG2 /Cu, H+ /H2 y (ZnG3 – )/Zn calculados en el estudio termodinámico.
Durante el barrido de potencial en dirección negativa es posible notar que todos los voltamperogramas presentan las siguientes características: una corriente catódica despreciable se observa a partir de EOCP (H•-0.52 V) hasta -0.65 V, lo cual indica que no existe reacción electroquímica en esta región de potencial. Al continuar con el barrido de potencial en dirección negativa es posible observar la aparición de tres picos catódicos, A, B y C, con valores de potencial de pico en aproximadamente -0.74 V, -1.25 V y -1.65 V, respectivamente (este valor depende de la composición de la solución). Un análisis comparativo entre los resultados mostrados en la figura 1 sugiere que el pico A se asocia con la electrodeposición de cobre a partir de CuG2 a Cu(0), y el pico B con la electrodeposición de Cu y la aleación Cu-Zn rica en cobre. En la bibliografía se ha reportado (46) que el depósito de Zn puede ocurrir a potenciales más positivos con respecto al potencial de equilibrio del par redox ZnG3–/Zn(0), el cual se conoce como depósito a subpotencial (UPD), en el que este pico se asocia con la deposición Zn UPD; sin embargo, en la figura 1 se observa que este pico inicia en valores de potencial más positivos que el valor reportado en la bibliografía. (46) Este desplazamiento de potencial puede asociarse a diferentes factores como (1), diferentes substratos donde se lleva a cabo el proceso de Zn UPD, (2) la presencia de los iones Cu2+ y el aumento de la concentración de iones cloruro y moléculas de glicina en solución. Resultados similares han reportado Juskenas et al. (47) y Carlos et al., (48) durante la electrodeposición de la aleación Cu-Zn en medio alcalino. En adición, importa mencionar que los picos A y B no fueron significativamente afectados por la composición de las soluciones, como se observa en la figura 1.
El pico C puede atribuirse con la formación de aleaciones Cu-Zn, con diferentes fases ricas en Zn o depósito masivo de Zn. (49,50) También es posible observar que la forma creciente de la corriente catódica para potenciales más negativos que – 1.60 V puede asociarse con la reacción de evolución de hidrógeno (REH) (ver curvas (a) y (b)). Sin embargo, la curva (c) muestra un comportamiento opuesto para la corriente catódica, la cual disminuye para potenciales más negativos que -1.60 V, como resultado de incrementar la concentración de zinc tanto en solución como en el depósito. La curva c en la figura 1 indica un efecto de inhibición de la reacción REH, la cual implicará que el proceso de electrodeposición a partir de la solución tendrá un alto valor de eficiencia en la corriente catódica.
Evaluación a escala semipiloto de los recubrimientos de Cu-Zn para el sector industrial de la galvanoplastia
En el sector industrial es común que los recubrimientos de latón se obtengan a corriente constante, por lo que electrodepósitos de la aleación Cu-Zn a corriente controlada se obtuvieron en una celda de placas paralelas a partir de la soluciones S0, S1 y S2 . Los recubrimientos se obtuvieron sobre placas de acero AISI 1018 previamente niqueladas con un baño comercial tipo watts, con una área geométrica de 6 cm2.
Las condiciones de depósito electrolítico de Cu-Zn fueron a corriente constante en el rango 15-60 mA cm-2, durante 300 segundos bajo agitación, en una celda electrolítica de 300 mL, en un arreglo de dos electrodos con un ánodo de latón comercial.
La figura 2 muestra una fotografía donde es posible comparar la coloración de los recubrimientos de Cu-Zn obtenidos a partir de la solución S2. Es claro observar que para el rango de densidades de corriente estudiadas en este trabajo, una coloración dorada y homogénea se logró para los recubrimientos de Cu-Zn obtenidos bajo estas condiciones. Estos resultados son relevantes desde el punto de vista industrial, debido a que la uniformidad de la coloración de los recubrimientos es un factor clave para la aceptación de nuevos baños electrolíticos de latón. Es importante resaltar que cuando se utilizaron las soluciones S0 y S1 la coloración fue no uniforme.
Aplicaciones de la fase intermetálica Cu-Zn como electrocatalizador para la producción de hidrógeno como vector energético
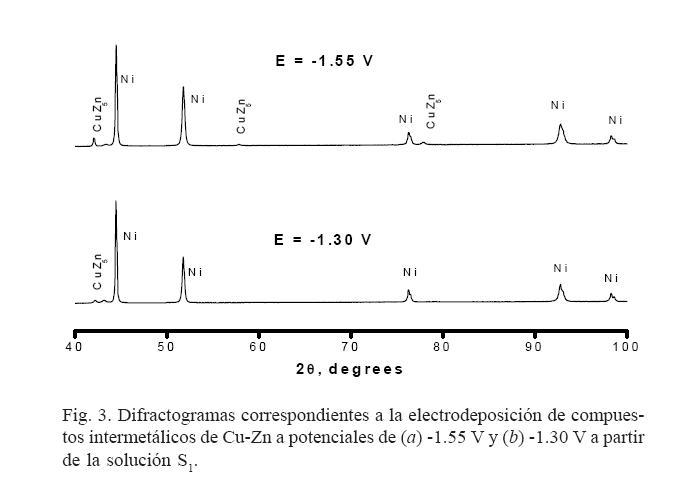
Los recubrimientos de Cu-Zn obtenidos en condiciones potenciostáticas dentro de la celda de tres electrodos se caracterizaron con la técnica de DRX. La figura 3 muestra los resultados de DRX de las películas de Cu-Zn obtenidas a partir de la solución S1, los cuales corresponden con el compuesto intermetálico CuZn5 de acuerdo con la tarjeta JCPDS No. 35-1151. Adicionalmente, también es posible detectar la presencia de señales correspondientes al níquel metálico.
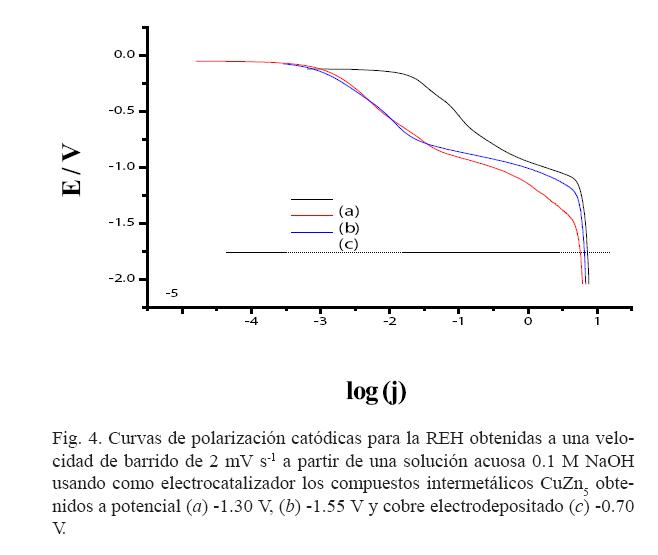
Los recubrimientos de Cu-Zn intermetálico se probaron como electrocatalizadores para la reacción de evolución de hidrógeno con una solución 0.1 M NaOH. La técnica empleada fue voltamperometría lineal, a una velocidad de barrido de 3 mV s-1.
La figura 4 muestra las curvas de polarización obtenidas para los tres materiales electrocatalíticos, y en ella se observa que ambos compuestos intermetálicos Cu-Zn presentan mejor actividad electrocatalítica que el níquel. Sin embargo, el compuesto intermetálico obtenido a -1.30 V mostró mayor actividad electrocatalítica.
Adicionalmente, los parámetros electrocinéticos que se calcularon para la REH, considerando que esta reacción sigue el mecanismo Volmer-Heyrovsky, (22, 23) son los siguientes: pendiente de Tafel (b, mV dec-1), corriente de intercambio (j0 , mA cm-2) y coeficiente de transferencia de carga (a). Los resultados para el electrodo Cu-Zn (-1.30 V), Cu-Zn (-1.55 V) muestran que la pendiente de Tafel obtenida para estos materiales se ubica el rango de valores obtenidos para metales de transición, los cuales se encuentran en el rango de 90-140 mV dec-1. (22)
CONCLUSIONES
Las aportaciones principales de este trabajo son la obtención por primera vez de electrocatalizadores intermetálicos con base en Cu-Zn, los cuales mostraron elevada actividad para la reacción de evolución de hidrógeno. Los resultados son comparables con los mejores materiales electrocatalíticos, con base en metales de transición. La estabilidad química de estos compuestos intermetálicos es otra ventaja que los torna potencialmente competitivos y susceptibles de escalarse a nivel de planta piloto para electrocatalizadores comerciales. La segunda aportación de esta investigación se relaciona con el uso de glicina como agente complejante eficaz para sustituir a los cianuros de las soluciones electrolíticas utilizadas para el latonado electrolítico de calidad comercial. Los resultados muestran que en condiciones de corriente constante fue posible obtener recubrimientos Cu-Zn, con un color de gran parecido a los recubrimientos comerciales.
RESUMEN
La presente investigación muestra los resultados del desarrollo de un nuevo proceso electroquímico para obtener recubrimientos de cobre-zinc (Cu-Zn) por electrodeposición a partir de una solución electrolítica no cianurada, la cual contiene glicina como el nuevo agente complejante a pH = 10. Los resultados indican que dos fases cristalinas se electrodepositaron: el compuesto intermetálico ε-CuZn5 y latón α-CuZn. Las aplicaciones de estos compuestos son en dos áreas: el ε-CuZn5 mostró propiedades electrocatalíticas para la reacción de evolución de hidrógeno, con actividad superior a la observada para níquel, y el caso de las películas con la fase α-CuZn mostró una coloración similar al latón decorativo.
Palabras clave: Recubrimientos Cu-Zn, Glicina, Hidrógeno, Aleaciones intermetálicas, Latón.
ABSTRACT
In the present work the results of the development of a novel electrochemical process to obtain copper-zinc coatings by electrodeposition through an electrolytic non-cyanide solution, which contains glycine as the new complex agent at pH = 10, are presented. The specific characteristics showed for each phase indicated that these can be applied as follows: ε-CuZn5 for hydrogen evolution reaction and α-CuZn as coating for decorative brass.
Keywords: Cu-Zn coatings, Glycine, Hydrogen, Intermetallic compounds, brass.
AGRADECIMIENTOS
Los autores agradecen el apoyo financiero para la ejecución de este trabajo, a través de los proyectos: INFRA-252753, CB-237049, Retención-239391 y UANL-CA-PIFI-2014.
* Universidad Autónoma de Nuevo León, FIC.
Contacto: jballesteros_pacheco@yahoo.com.mx
REFERENCIAS
1. J.R. Davis, Copper and Copper Alloys, ASM International Handbook, New York, (2001).
2. A. Brenner, Electrodeposition of Alloys, Principles and Practice, Academic Press, New York-London (1963).
3. Ramani Mayappan, Rosyaini A. Zaman, Zalina Z. Abidin, Alias Mohd N. Derman, Advanced Materials Research, 173 (2011) 90- 95.
4. T.A Vagramyan, Z. A. Solov’eva, Technology of electrodeposition, Ed. Robert Drapper Ltd., Teddington (1961).
5. M. Schlesinger, M. Paunovic, Modern Electroplating, John Wiley & Sons, Inc., New York (2000).
6. Y. Fujiwara, H. Enomoto, J. Electrochem. Soc., 147, (2000), 1840.
7. PPRC. Pollution prevention in Metal Finishing Plating. Pacific Northwest Pollution Prevention,(http://www.pprc.org)(1999).
8. Agency for Toxic Substances and Disease Registry. Toxicological profile for cyanide. (United States Public Health Service, 1989). .
9. D. Page, S. Roy, J. Phys. IV, Colloq. (France) 7 (1997) 269.
10. Y. Fujiwara, H. Enomoto, Surf. Coat. Technol. 35 (1988) 101.
11. R.M. Krishnan, V.S. Muralidharan, S.R. Natarajan, Bull. Electrochem.
12 (1966) 274. 12. Y. Fujiwara, H. Enomoto, Plat. Surf. Finish. 80 (1993) 52.
13. K. Johansen, Plat. Surf. Finish. 88 (2001) 104.
14. I. Rodríguez-Torres, G. Valentín, S. Chanel, F. Lapicque, Electrochim. Acta 46 (2000) 279-287.
15. A.E. Mohamed, S.M. Rashwan, S.M. Abdel-Wahaab, M.M. Kamel, J. Appl. Electrochem. 33 (2003) 1085-1092.
16. J.L. Ortiz-Aparicio, Y. Meas, G. Trejo, R. Ortega, T.W. Chapman, E. Chainet, P. Ozil, Electrochim. Acta 52 (2007) 4742-4751.
17. S.M. Rashwan, Mat. Chem. Phys. 89 (2005) 192-204.
18. F. Barbir, Energy, 34 (2009) 308–312.
19. T.N. Veziroglu, F. Barbir, Int. J. Hydrogen Energy, 17 (1992) 391–404.
20. M. Momirlan, T.N. Veziroglu, Renew. Sustain. Energy Rev., 6 (2002), 141–179.
21. K. Zeng, D. Zhang, Prog. Energy Combust. Sci., 36 (2010), 307– 326.
22. A. Lasia, W. Vielstich, A. Lamm, H.A. Gasteiger, Handbook of fuel cell technology, John Wiley and Sons Ltd., (2003).
23. A. Lasia, A. Rami, J. Electroanal. Chem., 294 (1990) 123–141.
24. A. Rami, A. Lasia, J. Appl. Electrochem., 22 (1992) 376–382.
25. L.L. Chen, A. Lasia, J. Electrochem. Soc., 139 (1992) 3214– 3219.
26. I. Herraiz-Cardona, E. Ortega, L. Vázquez-Gómez, V. Pérez-Herranz, Int. J. Hydrogen Energy, 36 (2011) 11578–11587.
27. C. Lupi, A. Dell’Era, M. Pasquali, Int. J. Hydrogen Energy, 34 (2009) 2101–2106
28. I. Herraiz-Cardona, E. Ortega, V. Pérez-Herranz, Electrochim. Acta, 56 (2011), pp. 1308–1315
29. E. Navarro-Flores, Z. Chong, S. Omanovic, J. Mol. Catal. A Chem., 226 (2005) 179–197.
30. R. Solmaz, G. Karda_´, Electrochim. Acta, 54 (2009) 3726– 3734.
31. M.J. Giz, S.C. Benito, E.R. González, Int. J. Hydrogen Energy, 25 (2000) 621–626.
32. N.V. Krstajic, V.D. Jovic, L. Gajic-Krstajic, B.M. Jovic, A.L. Antozzi, G.N. Martelli, Int. J. Hydrogen Energy, 33 (2008) 3676– 3687.
33. G.S. Tasic, S.P. Maslovara, D.L. Zugic, A.D. Maksic, M.P.M. Kaninski, Int. J. Hydrogen Energy, 36 (2011) 11588–11595.
34. R. Reshkov, M. Arnaudova, G. Avdeev, A. Zielonka, P. Jannakoudakis, A. Jannakoudakis, Int. J. Hydrogen Energy, 34 (2009) 2095–2100.
35. M.A. Oliver-Tolentino, E.M. Arce-Estrada, C.A. Cortés-Escobedo, A.M. Bolarín-Miro, F. Sánchez-De Jesús, R. González-Huerta, J. Alloys Compd., 536 (2012) S245–S249.
36. Q. Han, J. Chen, K. Liu, X. Li, X. Wei, Int. J. Hydrogen Energy, 29 (2004) 597–603.
37. M.A. Domínguez-Crespo, A.M. Torres-Huerta, B. BrachettiSibajab, A. Flores-Vela, Int. J. Hydrogen Energy, 36 (2011) 135– 151.
38. J.H. Westbrook and R.L. Fleisher Intermetallic Compounds. Principles and Practice, John Wiley and Sons, (1995).
39. J. Jakšica, Lj.Vracãra, S.G.Neophytidesb and N.Krstajic, J. New Materials for Electrochemical Systems 7, 205-212 (2004).
40. Sang-Heon Kim, Hansoo Kim and Nack J. Kim, Nature, 518 (2015) 77–79.
41. Xiang Li, Li An, Xin Chen, Nanlin Zhang, Dingguo Xia, Weifeng Huang, Wangsheng Chu and Ziyu Wu, Scientific Reports, 3 (2013).
42. F. Albert Cotton, Geoffrey Wilkinson, Carlos A. Murillo, Manfred Bochmann, Advanced Inorganic Chemistry, Wiley, 5th Ed., (1999).
43. R.M. Smith, A.E. Martell, Critical Stability Constants, Plenum, New York (1989).
44. D.D. Perrin, Stability Constants of Metal–ion Complexes, Pergamon, Oxford (1979).
45. E.P. Serjeant, B. Dempsey, Ionization Constants of Organic Acids in Aqueous Solution, Pergamon, Oxford (1972).
46. J.C. Ballesteros, E. Chainet, P. Ozil, G. Trejo, Y. Meas, Electrochim. Acta 56 (2011) 5443.
47. R. Juskenas, V. Karpaviciene, V. Pakstas, A. Selskis, V. Kapocius, J. Electroanal. Chem. 602 (2007) 237.
48. I.A. Carlos, M.R.H. de Almeida, J. Electroanal. Chem. 562 (2004) 153.
49. Southampton Electrochemistry Group, Instrumental Methods in Electrochemistry, Ellis Horwood Ltd, Chichester, 1985.
50. G. Gunawardena, G. Hills, I. Montenegro, J. Electroanal. Chem. 184 (1985) 357-369.
51. V. D. Jovic, R.M. Zejnilovic, A.R. Despic, J.S. Stevanovic, J. Appl. Electrochem. 18 (1988) 511.
52. J. Stevanovic, L.J. Skibina, M. Stefanovic, A. Despic, V.D. Jovic, J. Appl. Electrochem. 22 (1992) 172.
53. J.C. Ballesteros, E. Chainet, P. Ozil, G. Trejo, Y. Meas, J. Electroanal. Chem. 645 (2010) 94.
54. A. Milchev, E. Michailova, R. Lacmann, B. Müller-Zülow, Electrochim. Acta, 38 (1993) 535.
55. A. Milchev, R. Lacmann, Electrochim. Acta, 40 (1995) 1475.
56. Alexander Milchev, Emilia Michailova, Theodora Zapryanova,Electrochem. Commun. 6 (2004) 713.
57. O. Díaz-Morales, J. Monstany, C. Borrás, B. R. Scharifker, J.
Solid. State Electrochem. 17 (2013) 345.
Recibido: 23/09/15 Aceptado: 23/10/15