DENGUE, UNA ENFERMEDAD CON VACUNAS EN INVESTIGACIÓN
Nelly Daniela González Velázquez*
CIENCIA UANL / AÑO 23, No.104, noviembre-diciembre 2020
El dengue es una enfermedad viral transmitida mediante la picadura del mosquito Aedes aegypti, que habita principalmente en zonas tropicales y subtropicales, por tal motivo, México es considerado una zona endémica donde se encuentran aislados los serotipos (subespecies del virus con variación de antígenos en la superficie celular) inmunológicos del virus del dengue. A inicios de 2020, el Centro para el Control y la Prevención de Enfermedades Europeo (ECDC) reportó los países con más casos de infecciones, éstos se clasificaron por continentes:
- En Latinoamérica destacan Brasil, Paraguay y Bolivia con 1,195,529; 219,913 y 82,793 casos, respectivamente.
- En Asia destacan Indonesia, Malasia y Filipinas con 68,700; 59,378 y 50,169 casos, respectivamente.
- En África destacan Réunion, Mayotted y Comorost con 36,962; 4,156 y 696 casos, respectivamente
- En Australia y el Pacifico destacan la República de las Islas Marshall, Polinesia Francesa y Australia con 3,482; 2,940 y 191 casos, respectivamente.
Los serotipos DENV-1, 2, 3 y 4 interactúan con los anticuerpos que se encuentran en el suero de la sangre (líquido sanguíneo que permanece después de eliminar las células y componentes de ésta) y desencadenan la respuesta inmunológica contra el virus, lo que genera una variedad de signos y síntomas que comprometen la calidad de vida al depender de la severidad.
A manera de frenar la creciente cantidad de casos reportados en el mundo, se han desarrollado vacunas con el propósito de disminuir la tasa de contagios. Actualmente existen múltiples opciones, como la vacuna inactivada tetravalente TDENV-PIV, preferible al ser desarrollada a partir de una proteína o fragmentos de cada serotipo del virus, haciéndolos incapaces de revertirse a la forma infecciosa que provoca la enfermedad al no ser aptos para replicarse; y las vacunas atenuadas tetravalentes conocidas como TV003/TV005, DENVax y CYD-TDV, fundamentadas en la concentración del ADN de los cuatro serotipos del virus debilitado, que estimula el sistema inmunológico, lo que puede ser causante de la imitación de la infección natural (Hernández-Cortés et al., 2019).
MANIFESTACIONES CLÍNICAS EN EL ORGANISMO
La importancia del desarrollo de vacunas como una medida de prevención primaria está justificada en el impacto que establece el virus del dengue en el organismo; el serotipo transmitido y el efecto que causa sobre el sistema inmunológico son los factores de mayor impacto. Las manifestaciones clínicas son descritas mediante definiciones de caso:
- La enfermedad febril aguda se caracteriza por la presentación clínica de una cefalea frontal, dolor retroauricular, dolores musculares, dolores articulares y un exantema representado por una erupción cutánea (Martínez, 1995).
- La fiebre hemorrágica del dengue (FHD) se caracteriza por episodios de fiebre, manifestaciones hemorrágicas como las petequias que se presentan como manchas pequeñas, planas y circulares de color púrpura en la piel, moretones, sangrado de las mucosas o en sitios de inyección. Éstas son confirmadas mediante una prueba positiva de torniquete, una cuenta de plaquetas (fragmentos de células sanguíneas que ayudan a frenar el sangrado y facilitar la cicatrización de las heridas) disminuida (Martínez, 1995) y un aumento en el intercambio selectivo de sustancias entre la sangre y los tejidos vecinos, que se representa mediante el escape del agua y proteínas fuera del vaso sanguíneo, lo que produce la concentración de la sangre y la alteración de la concentración de los glóbulos rojos.
- El síndrome de shock por dengue (SCHD) se manifiesta principalmente con una hipotensión arterial, extremidades frías al tacto y confusión mental (Martínez, 1995).
DESARROLLO DE VACUNAS EN INVESTIGACIÓN
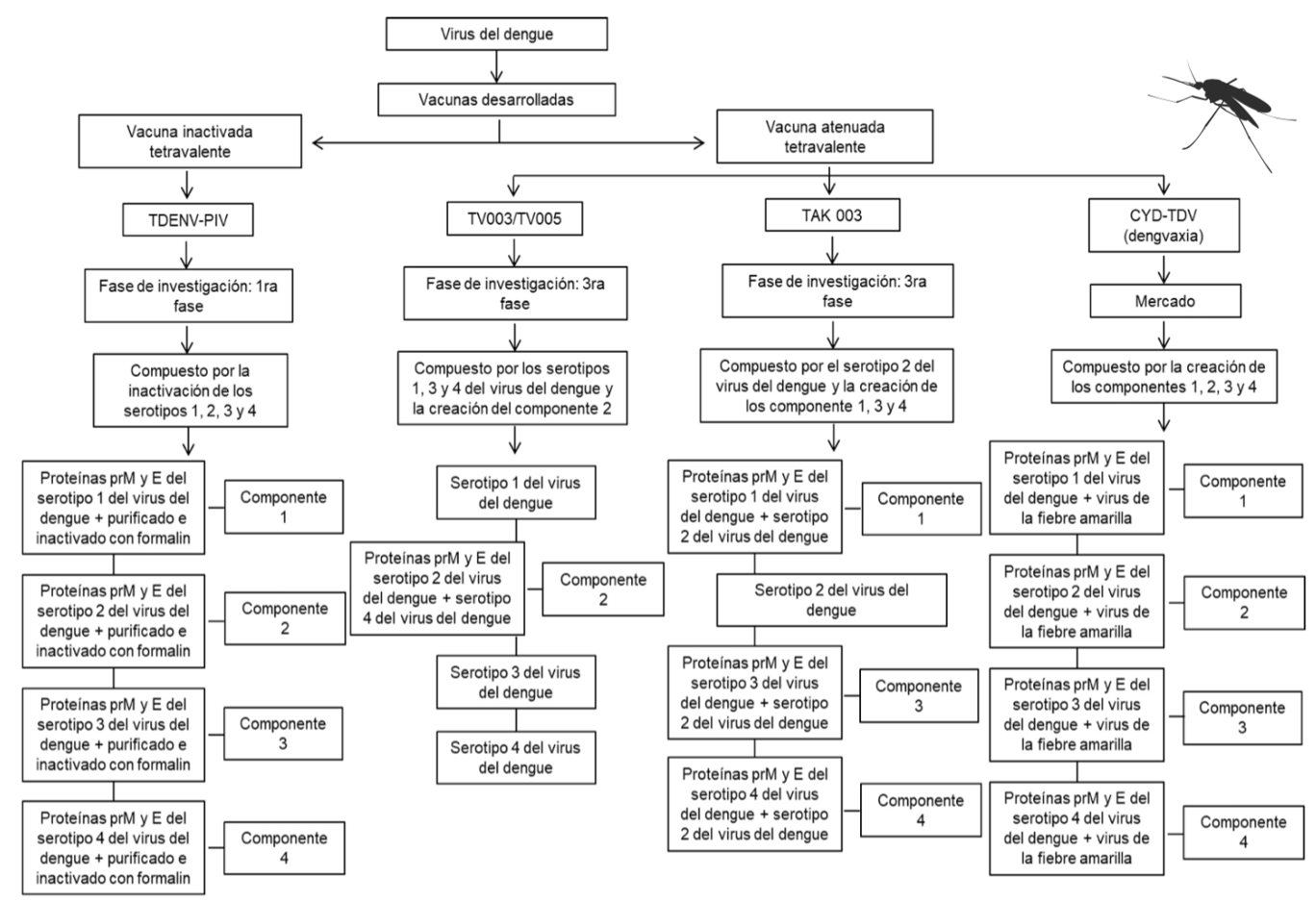
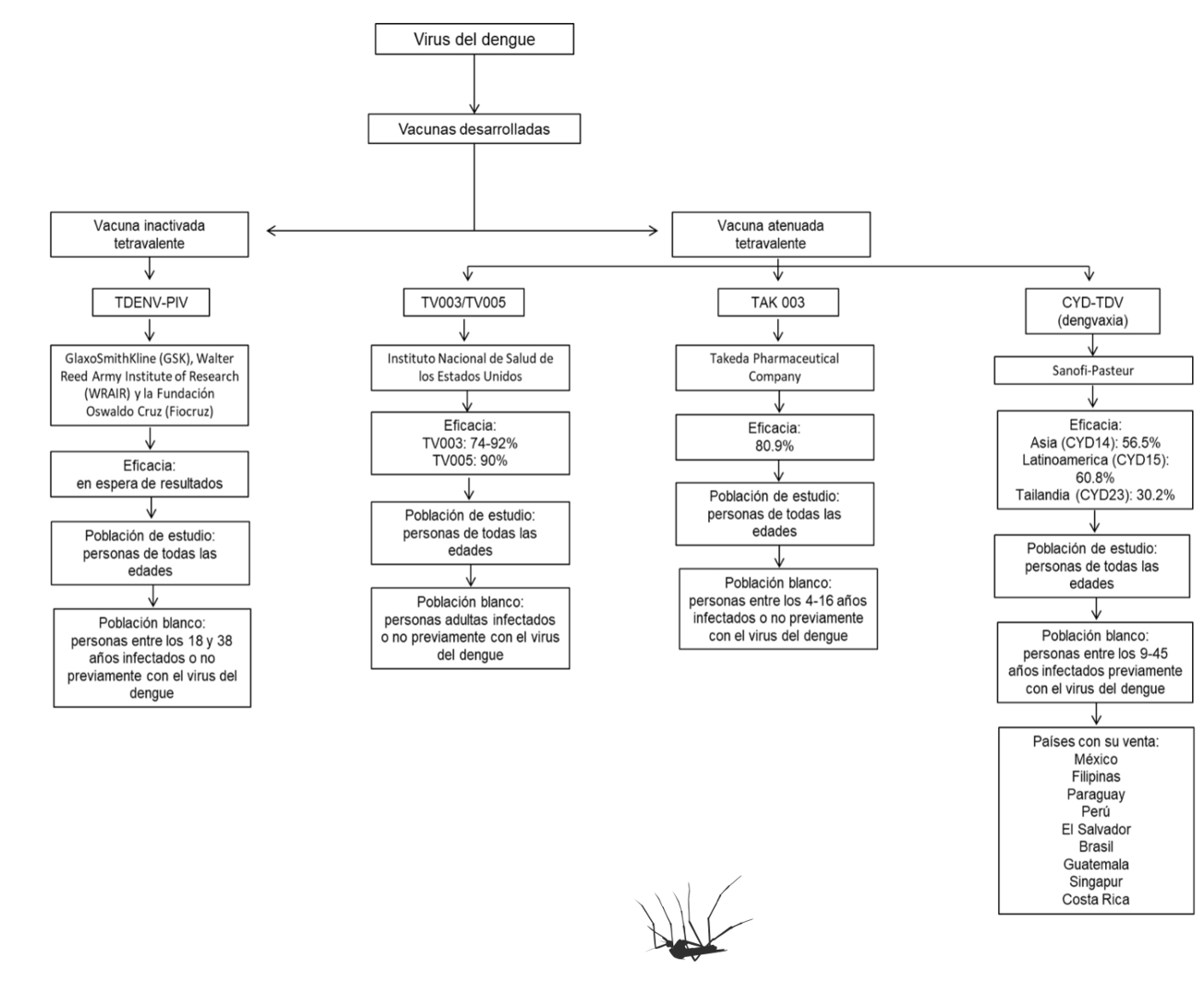
En 2015, Sanofi-Pasteur desarrolló la primera vacuna atenuada tetravalente, CYD-TDV (dengvaxia), la cual fue aprobada para su venta en el mercado por la Food and Drug Administration (FDA) en Estados Unidos y por la Comisión Federal para la Protección contra Riesgos Sanitarios en México. En sus fases de investigación los componentes del serotipo 1 al 4 fueron creados, éstos están fundamentados en la estructura y genética del virus de la fiebre amarilla, con la variante de incluir las proteínas prM y E correspondientes de cada serotipo del virus del dengue, a fin de crear un componente nuevo (figura 1). Los serotipos 3 y 4 reportaron una alta infectividad (capacidad del agente para invadir un organismo y provocar una enfermedad) y eficacia de protección, mientras que los serotipos 1 y 2 no reportaron impacto significativo. La inestabilidad de los últimos dos serotipos llevó a la implementación de una secuencia para elevar la concentración de anticuerpos y células T CD8+ específicas contra estos serotipos del virus. Esto se realizó mediante la administración de tres inyecciones, con la administración de la segunda y tercera inyección a los seis y 12 meses posteriores a la primera inyección (Vannice, Durbin y Hombach, 2016). Se debe tener en consideración que la vacuna sólo se debe administrar en personas previamente infectadas con el virus del dengue, en un rango de edad entre los 9 y 45 años (figura 2), esto debido a que la vacuna puede actuar como el origen de la infección si la persona no ha sido infectados con anterioridad.
La siguiente vacuna atenuada tetravalente es la TV003/TV005, la cual fue desarrollada por el Instituto Nacional de Salud de los Estados Unidos y se encuentra actualmente en la fase 3 de investigación. Se realizaron pruebas monovalentes para cada serotipo del virus del dengue en la fase 1, los componentes de los serotipos 1, 3 y 4 están fundamentados en la forma estructural y genética original de los serotipos del virus del dengue, mientras que el componente del serotipo 2 está basado en el serotipo 4 del virus con la variante de incluir las proteínas prM y E del serotipo 2 (Vannice, Durbin y Hombach, 2016) (figura 1). La administración de la inyección reportó una eficacia de 90% para la TV005 y de 74% para la TV003 (figura 2), esto fue comprobado debido a la alta concentración de anticuerpos y células T CD8+ específicas contra los serotipos del antígeno. No se reportó la inducción de la enfermedad por parte de la vacuna y los efectos secundarios se establecieron con base en la presentación clínica de un enrojecimiento de la piel en el área de inyección y una cuenta de neutrófilos, células de la sangre, disminuida (Lim y Poh, 2018).
La última vacuna atenuada tetravalente que presenta reportes avanzados de eficacia es la TAK 003, la cual fue desarrollada por Takeda Pharmaceutical Company en Japón. Dicha vacuna se encuentra actualmente en la fase 3 de investigación. Se realizaron pruebas para cada componente de los serotipos en la fase 1, el componente del serotipo 2 está fundamentado en la forma estructural y genética original del serotipo 2 del virus del dengue, mientras que la creación de los componentes de los serotipos 1, 3 y 4 estáfundamentado en el serotipo 2 con la variación de incluir las proteínas prM y E del serotipo correspondiente para formar los componentes nuevos (figura 1). Fue tolerado en niños y adultos entre los 4 y 16 años sin darle importancia a una infección previa por el virus del dengue (Lim y Poh, 2018) (figura 2). Se reportó la misma cantidad de elevación en la concentración de anticuerpos y células T CD8+ específicas contra los serotipos del antígeno, esto se realizó mediante la administración del virus atenuado tetravalente en una o dos inyecciones, donde la segunda inyección se aplicó entre el tercer y doceavo mes posterior a la primera inyección (Vannice, Durbin y Hombach, 2016).
Por otro lado, existe una vacuna inactivada tetravalente denominada TDENV-PIV, la cual fue desarrollada por GlaxoSmithKline (GSK), Wal- ter Reed Army Institute of Research (WRAIR) y la Fundación Oswaldo Cruz (Fiocruz), se encuentra actualmente en la fase 1 de investigación. Se realizaron pruebas para la obtención de los componentes de cada serotipo, del 1 al 4, los cuales fueron purificados e inactivados con una sustancia química conocida como formalina (figura 1). Se utilizaron diferentes cantidades de dosis y se administró una inyección de refuerzo al año posterior a la primera inyección a las personas entre las edades de 18 a 38 años (figura 2). Se reportó una concentración moderada de anticuerpos y células T CD8+ específicas contra los serotipos del antígeno, además de comprobar que la actividad de las células B de memoria perduran por más de 12 meses desde la primera inyección contra el antígeno. Los efectos secundarios se establecieron en base a la presentación clínica de dolor en el sitio de inyección y fiebre de menos de un día de duración (Schmidt et al., 2017).
UN FUTURO PROMETEDOR
Las vacunas expuestas anteriormente son aquéllas en fases de estudio avanzadas, se les permitió continuar en estado de estudio debido a los resultados prometedores reportados, una vez que comprueben su seguridad y efectividad para la población tendrán altas probabilidades de aprobación para salir al mercado. Esto nos lleva a concluir que a futuro este recurso puede ser utilizado como medida de prevención primaria al ser integrado en la cartilla de vacunación para evitar la diseminación y transmisión de la enfermedad desde de edades tempranas. A pesar de haber mencionado una cantidad limitada de vacunas, se debe comentar que actualmente existen un total de 23 vacunas en estudio, ya sea en fase preclínica o en fase de investigación.
* Universidad Autónoma de Nuevo León.
Contacto: nelly.daniela.gzz1a@gmail.com
REFERENCIAS
Hernández-Cortés, C., Fernández-Argüelles, R.A., Aguiar-Fuentes, E.G., et al. (2019). Revisión Integrativa sobre la pertinencia de las vacunas VPH, influenza y dengue para la salud pública en México. Revista Waxapa. 10(18):7-14.
Lim, C.S., y Poh, C.L. (2018). Development of dengue vaccines. Australasian Medical Journal. 11(6):370-380.
Martínez, E. (1995). Dengue y dengue hemorrágico: aspectos clínicos. Salud Pública de México. 37(Su1):29-44.
Schmidt, A.C., Lin, L., Martinez, L.J., et al. (2017). Phase 1 randomized study of a tetravalent dengue purified inactivated vaccine in healthy adults in the United States. The American Journal of Tropical Medicine and Hygiene. 96(6):1325-1337.
Vannice, K.S., Durbin, A., y Hombach, J. (2016). Status of vaccine research and development of vaccines for dengue. Vaccine. 34(26):2934-2938.